γ干扰素释放试验在儿童肺结核诊断中的价值
2014-06-27鲍磊李涛卢水华张文宏
鲍磊,李涛,卢水华,张文宏
1. 复旦大学附属华山医院感染科,上海 200040; 2. 上海市公共卫生临床中心,上海 201508
Keywords: Child; Pulmonary tuberculosis; Interferon γ release assay
结核病是威胁人类健康的主要传染病之一。据统计,全球约1/3人口受结核分枝杆菌感染。世界卫生组织(World Health Organization,WHO)2013年报道,2012年全球仍有860万新发病例,其中53万例为儿童[1]。中国尽管有较高的卡介苗(bacillus Calmette-Guérin,BCG)接种率,但每年仍有100万左右新发病例。因此,准确诊断结核病并规范治疗,对控制结核病的流行非常重要。
结核病的诊断较复杂,由于结核分枝杆菌与BCG及环境中其他非结核分枝杆菌存在交叉反应,过去100多年广泛使用的结核菌素皮肤试验(tuberculin skin test, TST)在中国这样的BCG高接种地区使用价值有限[2,3]。γ干扰素释放试验(interferon γ release assay, IGRA)是近10年来发展的新型结核病诊断手段。与TST使用的纯化蛋白衍生物不同,IGRA使用的2种抗原是由结核分枝杆菌特有的基因序列RD1编码产生,包括6 kDa早期分泌抗原靶分子(early secreted antigenic target of 6 kDa,ESAT-6)和培养滤液蛋白10(culture filtrate protein 10,CFP-10)。体外使用这2种抗原刺激机体特异性T细胞,产生并释放γ干扰素(interferon γ,IFN-γ),检测释放的IFN-γ可辅助结核病诊断。由于RD1只存在于结核分枝杆菌的基因序列中,假阳性结果减少,因此IGRA较传统TST具有更高的特异度[4]。
目前IGRA商用试剂盒有2种:QuantiFERON-Gold In-Tube(QFT-GIT)和T-SPOT.TB。前者主要通过酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测结核分枝杆菌特异性抗原刺激后释放的IFN-γ浓度,后者通过酶联免疫斑点(enzyme-linked immunospot,ELISPOT)检测抗原刺激后产IFN-γ的T细胞数。与T-SPOT.TB相比,QFT-GIT不需分离外周血单核细胞,操作更简单方便。这2项检测方法用于结核病诊断,主要集中在经济发达的低发病率国家,在结核病高发地区尤其是在儿童中的使用较少[5,6]。有报道显示,在欧洲结核病低发国家,与传统TST相比,IGRA在儿童结核病诊断中并无明显优势[7,8]。中国作为结核病高发地区,有较高的BCG接种率,本研究主要探讨QFT-GIT和T-SPOT.TB在这一地区儿童肺结核诊断中的价值。
1 材料与方法
1.1 研究对象
选取2010年12月~2011年8月就诊于上海市公共卫生临床中心和复旦大学附属儿科医院,具有咳嗽、咳痰、咯血、胸痛等症状,伴或不伴发热、盗汗、消瘦、乏力等全身表现,临床怀疑肺结核的16岁以下患儿共45例,抽取静脉血行QFT-GIT检测。选取2012年4月~2012年12月就诊于上海市公共卫生临床中心,同样具有上述临床表现的16岁以下患儿共69例,抽取静脉血行T-SPOT.TB检测。所有入组患儿的人类免疫缺陷病毒(human immunodeficiency virus,HIV)检测均为阴性,均接种过BCG。检测结果不影响临床治疗方案的制订。收集每例患儿的基本信息、临床表现、实验室检查结果、影像学资料、病理报告、治疗方案等相关信息,根据表1的分类标准进行诊断和分类[9]。
1.2 QFT-GIT和T-SPOT.TB
QFT-GIT试剂盒(澳大利亚Cellestis公司)包括阴性对照管、阳性对照管﹝(包被植物血凝素(phytohaemagglutinin,PHA)﹞及TB抗原管(分别包被ESAT-6、CFP-10、TB7.7)。首先,每个采血管各收集1 ml全血,摇晃混匀后于37 ℃培养箱培养16~24 h,离心并收集上清液。ELISA检测上清液中的IFN-γ浓度。TB抗原管中的IFN-γ浓度减去阴性对照管中的IFN-γ浓度作为结核分枝杆菌特异性抗原刺激机体产生的IFN-γ量。当该差值≥0.35 IU/ml且≥25%阴性对照管数值,结果判为阳性。差值<0.35 IU/ml或≥0.35 IU/ml但<25%阴性对照管,同时阳性对照管减去阴性对照管≥0.5 IU/ml,结果判为阴性。差值<0.35 IU/ml或≥0.35 IU/ml但<25%阴性对照管,同时阳性对照管减去阴性对照管<0.5 IU/ml;或阴性对照管>8.0 IU/ml,为结果不确定。
T-SPOT.TB(英国Oxford Immunotec公司)主要通过ELISPOT检测ESAT-6和CFP-10刺激后产IFN-γ的T细胞数。采集外周血后,分离外周血单核细胞,调整细胞数为2.5×105,分别加入空白对照孔、抗原A(ESAT-6)孔、抗原B(CFP-10)孔和阳性对照(PHA)孔,37 ℃孵育16~20 h后读数。当空白对照孔计数≤5,且抗原A或抗原B孔计数减去空白对照孔的数值 > 6; 或当空白对照孔计数>5个,且抗原A或抗原B孔计数至少为空白对照孔计数2倍时,结果为阳性(图1)。
1.3 统计方法
将确诊肺结核和高度怀疑肺结核组的患者作为肺结核患者,排除肺结核组的患者作为非结核患者,疑似肺结核组因最终诊断不明确,未纳入数据分析。计算QFT-GIT和T-SPOT.TB的灵敏度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)、阳性似然比、阴性似然比,其中QFT-GIT检测的不确定结果纳入灵敏度和特异度计算。卡方检验用于比较QFT-GIT与T-SPOT.TB诊断儿童肺结核的差异,P<0.05为有统计学差异。所有统计均用SPSS 19.0和GraphPad Prism 5.0软件进行。
2 结果
2.1 基本信息
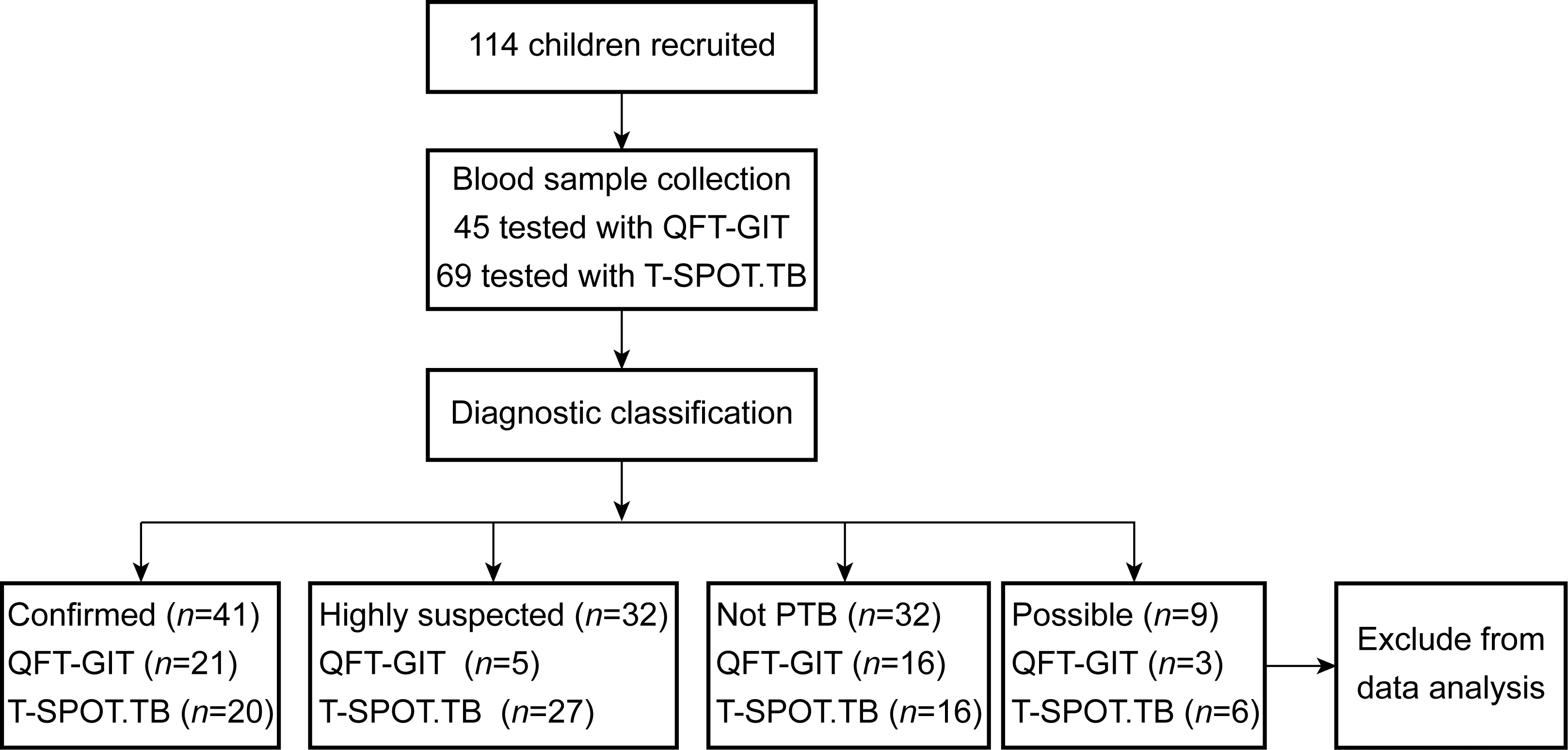
45例临床怀疑肺结核的患儿行QFT-GIT检测,69例行T-SPOT.TB检测。收集相关信息后,根据表1的诊断分类标准, 分为4个组。其中3例

图1 T-SPOT.TB 操作示意图Fig.1 Operation chart of T-SPOT.TB

表1 肺结核诊断分类标准Tab.1 Diagnostic classification of pulmonary tuberculosis
QFT-GIT检测和6例T-SPOT.TB检测的患儿,因归入疑似肺结核组, 故未纳入最后统计分析。其余105例患儿中,41例为确诊肺结核,其中21例行QFT-GIT检测、20例行T-SPOT.TB检测;32例为高度怀疑肺结核,其中5例行QFT-GIT检测、27例行T-SPOT.TB检测;32例排除肺结核的儿童,16例行QFT-GIT检测,16例行T-SPOT.TB检测(图2)。每组儿童年龄、性别、临床症状、影像学表现、BCG接种情况、治疗药物等相关信息见表2。
2.2 QFT-GIT和T-SPOT.TB的检测结果
确诊肺结核的41例患儿中,18例QFT-GIT检测阳性,14例T-SPOT.TB检测阳性;高度怀疑肺结核组中,4例QFT-GIT检测阳性,20例T-SPOT.TB检测阳性。这两组中的QFT-GIT和T-SPOT.TB检测阳性率均达70%以上。排除肺结核的儿童中,2例QFT-GIT检测阳性,1例QFT-GIT检测结果不确定,1例T-SPOT.TB检测阳性。具体结果见表3。
PTB, pulmonary tuberculosis.
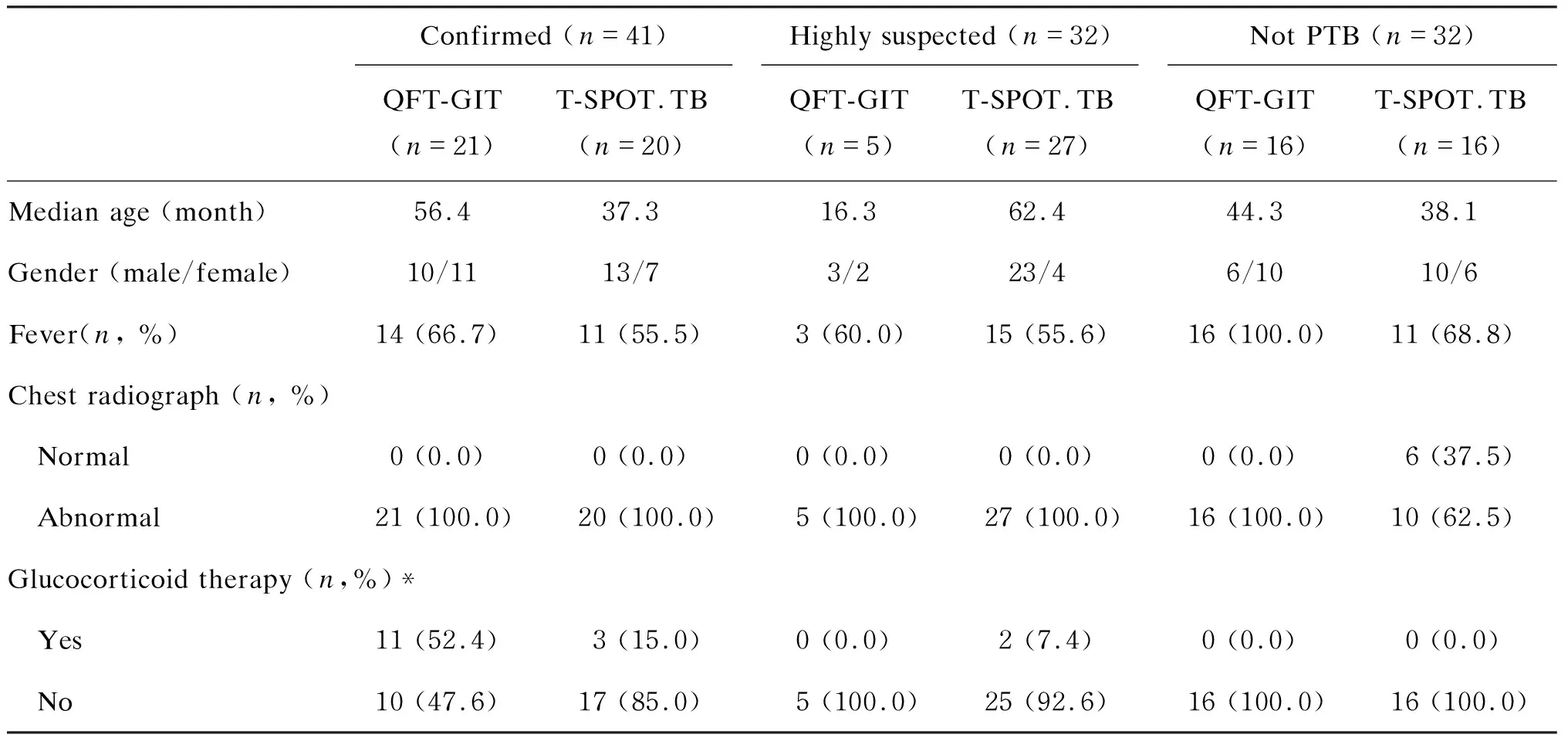
表2 入组儿童基本信息Tab.2 Demographic and clinical information of recruited children
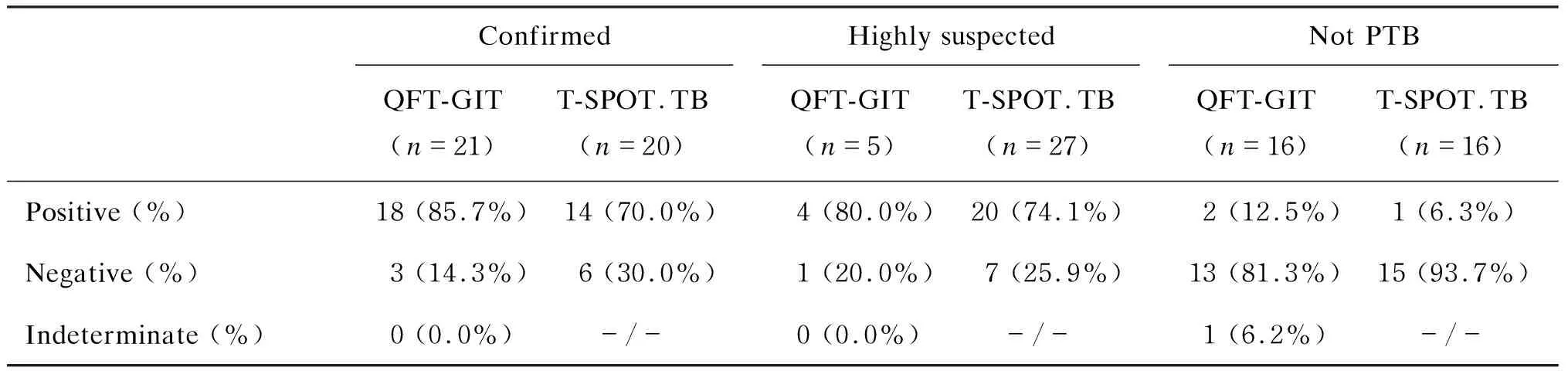
表3 QFT-GIT和T-SPOT.TB检测结果Tab.3 Results of QFT-GIT and T-SPOT.TB
2.3 QFT-GIT和T-SPOT.TB的诊断价值
比较这2种方法的灵敏度、特异度、PPV、NPV、阳性似然比和阴性似然比,结果显示QFT-GIT用于诊断儿童肺结核的灵敏度为84.6%(95% CI 为65.9%~94.5%),特异度为81.3%(95% CI为52.6%~94.2%);与QFT-GIT比较,T-SPOT.TB的灵敏度低(72.3%,95% CI 为58.1%~83.2%),特异度高(93.7%,95% CI为69.7%~99.9%)。2种检测方法的PPV均达90%以上(91.7%vs. 97.1%)(表 4)。此外,11例QFT-GIT检测和5 例 T-SPOT.TB检测的患儿在IGRA检测前1个月内接受过激素治疗(1 mg·kg-1·d-1)。比较使用激素与未使用激素的儿童,发现激素治疗后27.3%(3/11)患儿QFT-GIT结果阴性,其阳性率较未治疗组降低(72.7%vs. 93.3%); 40.0%(2/5)患儿T-SPOT.TB结果阴性,假阴性率较未治疗者增加(40.0%vs. 26.2%)。
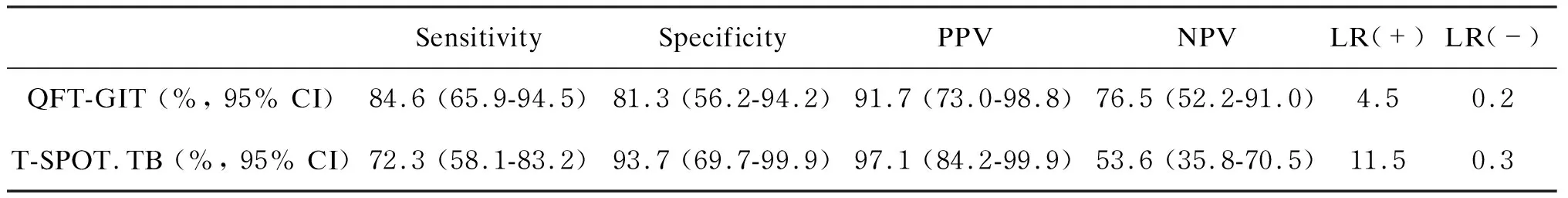
表4 QFT-GIT和T-SPOT.TB在儿童肺结核中的诊断价值Tab.4 Diagnostic value of QFT-GIT and T-SPOT.TB in childhood pulmonary tuberculosis
3 讨论
结核分枝杆菌涂片和培养阳性是结核病诊断的金标准[10],但结核分枝杆菌培养至少需2周才能获得阳性结果,而约50%培养阳性患者的涂片结果为阴性[11]。因此,开发更准确、更快速的诊断方法对提高结核病的早期诊断率有重要意义。2001年,QuantiFERON-TB被美国食品药品管理局(Food and Drug Administrator,FDA)批准用于结核分枝杆菌感染的辅助诊断后,越来越多的研究将目光投向该领域[12]。目前关于IGRA在结核病中的应用多集中于发达国家的成人中,在儿童中的研究较少。
本研究结果显示,QFT-GIT用于诊断儿童肺结核的灵敏度较T-SPOT.TB高(84.6%vs. 72.3%),而T-SPOT.TB的特异度则比QFT-GIT高(93.7%vs. 81.3%)。2种检测方法的PPV均超过90%(91.7%vs. 97.1%)。浙江省成人肺结核诊断研究显示,IGRA的PPV为88.2%[13]。由于潜伏性结核的感染比例随年龄增长而逐渐增加,因此儿童中IGRA更少受潜伏性结核感染的影响。本研究显示, 2种IGRA检测方法诊断儿童肺结核的PPV均较成人高。T-SPOT.TB的阳性似然比高达11.5,与QFT-GIT相比,更适合于儿童肺结核的诊断。
激素有抑制机体免疫反应的作用,长期以来人们一直认为其对IGRA结果存在负面影响,但有关报道较少[14]。本研究中,11例QFT-GIT检测和5例T-SPOT.TB检测患儿在IGRA检测前1个月内接受过激素治疗,2种检测的假阴性率分别增加至27.3%和40.0%。尽管这一差异没有统计学意义,但提示激素治疗会导致假阴性结果。因此,建议一旦怀疑结核分枝杆菌感染,应在使用激素前尽早行IGRA检测。受样本量的限制,本研究结果可能有一定的偏倚,故需扩大样本量以证实这一结论。
综上所述,QFT-GIT和T-SPOT.TB在中国这一BCG高接种、结核病高发地区用于儿童肺结核诊断的PPV较高,具有较高的肺结核辅助诊断价值。
[1] WHO. Global tuberculosis control: WHO report 2013 [R/OL]. http://www.who.int/tb/publications/global_report/en/.
[2] Cruz AT, Geltemeyer AM, Starke JR, Flores JA, Graviss EA, Smith KC. Comparing the tuberculin skin test and T-SPOT.TB blood test in children [J]. Pediatrics, 2011, 127(1): e31-e38.
[3] Wang L, Turner MO, Elwood RK, Schulzer M, FitzGerald JM. A meta-analysis of the effect of Bacille Calmette Guérin vaccination on tuberculin skin test measurements [J]. Thorax, 2002, 57(9): 804-809.
[4] Sester M, Sotgiu G, Lange C, Giehl C, Girardi E, Migliori GB, Bossink A, Dheda K, Diel R, Dominguez J, Lipman M, Nemeth J, Ravn P, Winkler S, Huitric E, Sandgren A, Manissero D. Interferon-gamma release assays for the diagnosis of active tuberculosis: a systematic review and meta-analysis [J]. Eur Respir J, 2011, 37(1): 100-111.
[5] Detjen AK, Keil T, Roll S, Hauer B, Mauch H, Wahn U, Magdorf K. Interferon-gamma release assays improve the diagnosis of tuberculosis and nontuberculous mycobacterial disease in children in a country with a low incidence of tuberculosis [J]. Clin Infect Dis, 2007, 45(3): 322-328.
[6] Soysal A, Bakir M. T-SPOT.TB assay usage in adults and children [J]. Expert Rev Mol Diagn, 2011, 11(6): 643-660.
[7] Bamford AR, Crook AM, Clark JE, Nademi Z, Dixon G, Paton JY, Riddell A, Drobniewski F, Riordan A, Anderson ST, Williams A, Walters S, Kampmann B. Comparison of interferon-gamma release assays and tuberculin skin test in predicting active tuberculosis (TB) in children in the UK: a paediatric TB network study [J]. Arch Dis Child, 2010, 95(3): 180-186.
[8] Kampmann B, Whittaker E, Williams A, Walters S, Gordon A, Martinez-Alier N, Williams B, Crook AM, Hutton AM, Anderson ST. Interferon-gamma release assays do not identify more children with active tuberculosis than the tuberculin skin test [J]. Eur Respir J, 2009, 33(6): 1374-1382.
[9] Rachow A, Clowes P, Saathoff E, Mtafya B, Michael E, Ntinginya EN, Kowour D, Rojas-Ponce G, Kroidl A, Maboko L, Heinrich N, Reither K, Hoelscher M. Increased and expedited case detection by Xpert MTB/RIF assay in childhood tuberculosis: a prospective cohort study [J]. Clin Infect Dis, 2012, 54(10): 1388-1396.
[10] Zumla A, Raviglione M, Hafner R, von Reyn CF. Tuberculosis [J]. N Engl J Med, 2013, 368(8): 745-755.
[11] Siddiqi K, Lambert ML, Walley J. Clinical diagnosis of smear-negative pulmonary tuberculosis in low-income countries: the current evidence [J]. Lancet Infect Dis, 2003, 3(5): 288-296.
[12] Mazurek GH, Jereb J, Vernon A, LoBue P, Goldberg S, Castro K; IGRA Expert Committee; Centers for Disease Control and Prevention (CDC). Updated guidelines for using interferon gamma release assays to detect Mycobacterium tuberculosis infection—United States, 2010 [J]. MMWR Recomm Rep, 2010, 59(RR-5): 1-25.
[13] 周祖模, 金嘉琳, 王森, 黄河清, 石勇明, 陈林, 张文宏, 翁心华. 全血γ干扰素释放试验在活动性肺结核诊断中的应用[J]. 中华实验和临床感染病杂志(电子版), 2012, 6(6): 527-531.
[14] 李晓菲, 赵勤, 汪亚玲, 余文林. 两种结核分枝杆菌相关γ-干扰素定量检测试剂盒检测结核分枝杆菌感染结果比较研究[J]. 中国防痨杂志, 2011, 33(5): 267-270.
