重组人源SNX7蛋白在大肠杆菌中的表达、纯化及磷脂结合特异性分析
2014-06-24冯站许婷婷徐进新
冯站,许婷婷,徐进新
1安徽大学生命科学学院,安徽合肥230601
2中国科学院广州生物医药与健康研究院,广东广州510530
图2融合PX-BARSNX7蛋白在大肠杆菌Rosseta 2 (DE3)中诱导表达的SDS-PAGE检测结果
Fig.2SDS-PAGE result of the expression of the recombinant humanPX-BARSNX7 in E.coli Rosseta2 (DE 3)at 16℃.M:protein molecular weight standard; 1:total protein before IPTG induction;2:total protein after IPTG induction;3:pellet fraction;4:soluble fraction.
医学与免疫生物技术
重组人源SNX7蛋白在大肠杆菌中的表达、纯化及磷脂结合特异性分析
冯站1,2,许婷婷2,徐进新2
1安徽大学生命科学学院,安徽合肥230601
2中国科学院广州生物医药与健康研究院,广东广州510530
冯站,许婷婷,徐进新.重组人源SNX7蛋白在大肠杆菌中的表达、纯化及磷脂结合特异性分析.生物工程学报,2014, 30(9):1436−1445.
Feng Z,Xu TT,Xu JX.Expression,purification and phosphoinositide binding specifity of recombinant human SNX7 expressed in Escherichia coli.Chin J Biotech,2014,30(9):1436−1445.
Sorting nexins(SNXs)是一类含有SNX-PX结构域,并在细胞内吞和内体分选运输过程中发挥重要调节作用的蛋白。SNX7是SNXs家族中的一员,含有PX结构域和BAR结构域,属于SNX-PX-BAR亚家族。斑马鱼实验表明,SNX7是在肝脏中大量表达的抗凋亡蛋白,并在胚胎肝脏的发育中发挥关键作用。为了从蛋白水平对SNX7进行研究,首先将编码人源PX-BARSNX7(SNX7的一个片段,包含PX和BAR结构域)的cDNA片段插入到原核表达载体p28a中,再将重组质粒转化到大肠杆菌Rosseta 2(DE3)中诱导表达,并用亲和层析、离子交换和分子筛层析对PX-BARSNX7进行了纯化。Western blotting结果表明,亲和层析、离子交换和分子筛层析纯化后获得了高纯度的PX-BARSNX7蛋白。动态光散射实验显示PX-BARSNX7蛋白均一性良好。磷脂结合实验表明,PX-BARSNX7具有较为广泛的磷脂酰肌醇结合能力,能够与PtdIns(5)P、PtdIns(4,5)P2和PtdIns(3,4,5)P3结合。
Sorting nexin 7(SNX7),磷脂结合,均一性,表达纯化
Sorting nexins(SNXs)是一类含有PX结构域,并在细胞内吞和蛋白分选运输等细胞过程中发挥重要作用的蛋白[1-5]。PX结构域特异性地与磷脂酰肌醇结合,并介导SNXs靶向富含特异磷脂酰肌醇的细胞器。根据结构域组成,目前在哺乳动物中发现的33种SNXs可以分为3大类:SNX-PX,这类SNXs只含有PX结构域和侧翼序列,包括SNX3、SNX10、SNX11、SNX12、SNX22和SNX24;SNX-PX-BAR,这类SNXs含有PX结构域和BAR结构域,包括SNX1、SNX2、SNX4、SNX5、SNX6、SNX7、SNX8、SNX9、SNX18、SNX30、SNX32和SNX33;SNX-PX-other,这类SNXs除了含有PX结构域外,还含有除了BAR结构域外的其他结构域[3]。
在SNXs蛋白中,SNX-PX-BAR的功能研究较多,它们被认为在内体的分选运输中发挥着关键的调节作用。SNX1、SNX2、SNX5和SNX6组成retromer的膜结合亚复合物,调节阳离子非依赖性的甘露糖-6-磷酸受体(CI-MPR)由内体向高尔基体的逆向运输[6-11]。SNX4参与调节转铁蛋白受体(TfnR)由内体向质膜的循环转运[12]。SNX9、SNX18和SNX33除了含有PX结构域和BAR结构域,还有SH3结构域,它们在网格蛋白介导的细胞内吞作用中发挥重要作用。SNX9和SNX18的表达沉默会抑制转铁蛋白受体的吸收[13-14],而SNX33的表达将抑制转铁蛋白受体的吸收[15]。此外,SNX9通过结合WASP还能调节T细胞信号传导和调节肌动蛋白依赖性的液相内吞[16]。最近,舒晓东等以斑马鱼为模式动物,对SNX7的生物功能进行了初步的研究。他们发现SNX7是在肝脏中大量表达的抗凋亡蛋白,是斑马鱼胚胎发育早期肝母细胞的生存所必需的[17]。
SNX7属于SNX-PX-BAR亚家族,包含N端的PX结构域和C端的BAR结构域。为了从蛋白水平对SNX7进行研究,并为SNX7的结构生物学研究建立基础,我们对SNX7的一个片段PX-BARSNX7(包含PX结构域和BAR结构域)进行了表达、纯化和磷脂酰肌醇结合特异性分析。我们成功地在大肠杆菌中表达了可溶的PX-BARSNX7蛋白。我们用亲和层析、离子交换和分子筛层析对PX-BARSNX7进行了纯化,并获得了高纯度的蛋白。磷脂结合实验表明,PX-BARSNX7能结合多种磷脂酰肌醇:PtdIns(4)P、PtdIns(5)P、PtdIns(4,5)P2以及PtdIns(3,4,5)P3。
1 材料与方法
1.1 材料
大肠杆菌菌株Rosseta 2(DE3),质粒p28a均由中国科学技术大学周丛照实验室赠送;插入人源snx7(isoform b,序列号:EAW72996.1)cDNA的PCR3.1-snx7质粒由中国科学院广州生物医药与健康研究院(GIBH)裴端卿实验室赠送。
镍亲和层析柱购于Qiagen公司。离子交换柱(QFF)、分子筛层析柱HiLoad 16/60 Superdex 200 prep grade、AKTA purifier纯化系统均购于GE healthcare公司。蛋白电泳仪、Model 550酶标仪购于Bio-Rad公司。动态光散射仪The DynaPro TITAN购自Wyatt Technology公司。普通DNA产物纯化试剂盒、质粒小提试剂盒、Bradford蛋白质定量试剂盒购于TIANGEN公司。一抗(His鼠单抗)购于Qiagen公司,二抗(羊抗鼠)购自北京中杉金桥生物技术有限公司。DNA聚合酶、限制性内切酶NdeⅠ和XhoⅠ均购于TaKaRa公司。异丙基硫代-β-D-半乳糖苷(IPTG)购于Amresco公司。其他试剂为国产分析纯。
1.2 方法
1.2.1 人源重组PX-BARSNX7片段表达载体的构建
用分子克隆的方法将编码人源PX-BARSNX7 (氨基酸残基从25–384)的cDNA片段插入到p28a载体中。首先用PCR扩增出目的DNA片段,目的DNA片段的理论大小为1 101 bp,PCR引物如下:5′-CCGCATATGGATGAACCAGATTTAA AGGA-3′,5′-TGGCTCGAGTCATTCAGAGGCT TCTTCCAAGTGAA-3′。PCR扩增反应条件为:94℃预变性5 min;98℃变性10 s,55℃退火30 s,72℃延伸1.5 min,5个循环;98℃变性10 s,62℃退火30 s,72℃延伸1.5 min,25个循环;72℃延伸5 min。再将p28a载体和PCR产物用限制性内切酶NdeⅠ和XhoⅠ进行酶切。最后,将双酶切后的PCR产物连接到p28a载体上,把构建好的载体转化到大肠杆菌Top10,涂板后,置于37℃过夜培养。挑取单克隆进行菌落PCR鉴定,菌落PCR使用载体上的通用引物(5′-TAATACGACTCACTATAGG-3′;5′-GCTAG TTATTGCTCAGCGG-3′)。菌落PCR产物的理论大小约为1 301 bp。提取阳性质粒,并进行DNA测序验证,测序验证无误后,用于下一步实验。
1.2.2 人源重组融合蛋白PX-BARSNX7的表达
将构建成功的质粒p28a-px-barsnx7转化到大肠杆菌Rosseta 2(DE3),涂板后于37℃恒温箱内培养14–16 h。挑取单克隆接种于含有氯霉素和氨苄的LB培养基中培养12–14 h,按照1%的体积转移到含有500 mL LB培养基的培养瓶中,于37℃培养。当OD600值达到0.6–0.8时,加入终浓度为0.6 mmol/L的异丙基硫代-β-D-半乳糖苷(IPTG),16℃诱导表达20 h。离心收集菌体,于–30℃保存。
1.2.3 人源重组融合蛋白PX-BARSNX7的纯化
将收集保存的菌体放于冰上解冻,用裂解缓冲液(20 mmol/L Tris-HCl,pH 7.5,300 mmol/L NaCl,5%甘油,7 mmol/L β-巯基乙醇,10 mmol/L咪唑,1 mmol/L PMSF)重悬菌体。用低温高压破碎的方法充分破碎菌体,12 000 r/min离心30 min,分别取沉淀和上清液进行SDS-PAGE电泳检测。上清液经过超滤后用镍亲和层析柱进行亲和纯化。镍亲和层析柱用10个柱体积的结合缓冲液(20 mmol/L Tris-HCl,pH 7.5,300 mmol/L NaCl,5%甘油,7 mmol/L β-巯基乙醇,10 mmol/L咪唑,1 mmol/L PMSF)平衡后上样。然后用洗涤蛋白缓冲液(咪唑浓度分别为20 mmol/L和40 mmol/L)充分洗涤除去镍柱中非特异性结合在柱子上的杂蛋白,分别收集洗涤蛋白液。最后用5个柱体积的蛋白洗脱缓冲液(20 mmol/L Tris-HCl,pH 7.5,300 mmol/L NaCl,5%甘油,7 mmol/L β-巯基乙醇,250 mmol/L咪唑,1 mmol/L PMSF)特异性洗脱目的蛋白,收集洗脱液进行SDS-PAGE电泳检测。镍亲和层析纯化收集的洗脱蛋白液超滤后再用离子交换柱(QFF)继续纯化,首先用离子交换缓冲液A(20 mmol/L Tris-HCl,pH 7.0,7 mmol/L β-巯基乙醇)平衡柱子,上样后用含有高浓度NaCl的缓冲液B (20 mmol/L Tris-HCl,pH 7.0,1 mol/L NaCl,7 mmol/L β-巯基乙醇)进行梯度洗脱,收集蛋白,并进行SDS-PAGE电泳检测。最后将蛋白收集液超滤浓缩后,用分子筛(Superdex 200 16/60)纯化,分子筛缓冲液成分是20 mmol/L Tris-HCl,pH 7.5(4℃),300 mmol/L NaCl,5%甘油,5 mmol/L DTT,收集出峰位置的样品进行SDS-PAGE电泳检测。把样品混合浓缩后用Bradford法测定其蛋白浓度。
1.2.4 人源重组融合蛋白PX-BARSNX7的Western blotting分析
分子筛纯化的蛋白进行SDS-PAGE后,用电转仪将所测蛋白从凝胶转移至PVDF膜上,转膜结束后用脱脂奶粉封闭过夜,与鼠抗组氨酸标签的单抗室温孵育1 h,再与羊抗鼠二抗室温孵育1 h,ECL显色,最后压片曝光。
1.2.5 人源重组融合蛋白PX-BARSNX7的动态光散射实验
动态光散射仪能通过测量样品散射光强度起伏的变化得出样品中颗粒大小的信息。根据散射光强度的变化,测得溶液中分子的扩散系数D,经公式:D=KT/6πηR可求出分子的流体动力学半径R(式中K为玻尔兹曼常数,T为绝对温度,η为溶液的粘滞系数)。结合光强(Mass)、多分散性(Polydispersity,Pd)和R指标可以分析蛋白溶液中颗粒大小的均一性。
1.2.6 人源重组融合蛋白PX-BARSNX7的磷脂结合检测
磷脂结合实验采用Protein-Lipid Overlay Assay方法,实验参照文献中的步骤进行[18]。从Echelon Biosciences公司购得醋酸纤维膜(PIP Strips,货号:P-6001)上有多种磷脂斑点。该膜用含有3%牛血清蛋白的PBS-T缓冲液(10 mmol/L Tris-HCl,pH 8.0,150 mmol/L NaCl,0.1%(V/V) Tween-20)在室温下孵育1 h,然后放入含有1 μg/mL的人源重组融合蛋白PX-BARSNX7在缓冲液中孵育1 h。用PBS-T缓冲液洗涤6次,每次5 min。为了检测被结合在膜上的蛋白,将膜在含有抗组氨酸标签抗体的溶液中孵育1 h,洗涤6次,每次5 min。再置于羊抗鼠二抗的缓冲液中,室温孵育1 h,充分结合后,再次洗涤,最后在胶片上曝光,观察结果。
2 结果
2.1 p28a-px-barsnx7片段表达载体的构建
本实验采用的p28a载体是在pET28a的基础上进行了改造的载体,去除了His标签和NdeⅠ酶切位点之间的序列。PCR反应获得的px-barsnx7片段经NdeⅠ和XhoⅠ双酶切,然后插入到经同样酶切处理的p28a载体中。利用载体上的通用引物进行菌落PCR筛选重组载体,菌落PCR产物的理论大小约为1 301 bp(图1)。将阳性质粒进行测序验证。
2.2 人源重组融合蛋白PX-BARSNX7的表达

图1 重组质粒p28a-px-barsnx7的菌落PCR鉴定图谱Fig.1Identificationofrecombinantplasmid p28a-px-barsnx7.1:DNA molecular weight standard (DL 2000);2:PCR product.
将质粒p28a-px-barsnx7成功转化到大肠杆菌Rosseta 2(DE3),经37℃培养的菌液的OD600达到0.6–0.8时,加入终浓度为0.6 mmol/L的异丙基硫代-β-D-半乳糖苷(IPTG),在16℃诱导目的蛋白表达,收集菌体,并进行SDS-PAGE电泳检测。SDS-PAGE结果显示,与诱导前相比,IPTG诱导之后在44 kDa附近有一条明显的蛋白条带,与重组融合蛋白His-PX-BARSNX7的分子量(43.9 kDa)基本相当(图2)。菌体经高压破碎后离心,分别取上清和沉淀进行SDS-PAGE分析。结果表明,部分PX-BARSNX7以可溶的形式表达于上清中(图2)。
2.3 人源重组融合蛋白PX-BARSNX7的纯化及Western blotting检测结果
人源重组融合蛋白PX-BARSNX7是氨基端带有组氨酸标签的融合蛋白,我们首先用镍亲和柱纯化PX-BARSNX7。上样后PX-BARSNX7与镍充分结合,再依次用含有40 mmol/L咪唑和250 mmol/L咪唑的缓冲液洗脱杂蛋白和目的蛋白。收集洗脱的蛋白,并进行SDS-PAGE检测。SDS-PAGE电泳检测显示,大部分的目的蛋白都被含有250 mmol/L咪唑的缓冲液洗脱(图3)。

图1 重组质粒p28a-px-barsnx7的菌落PCR鉴定图谱Fig.1Identificationofrecombinantplasmid p28a-px-barsnx7.1:DNA molecular weight standard (DL 2000);2:PCR product.
图2融合PX-BARSNX7蛋白在大肠杆菌Rosseta 2 (DE3)中诱导表达的SDS-PAGE检测结果
Fig.2SDS-PAGE result of the expression of the recombinant humanPX-BARSNX7 in E.coli Rosseta2 (DE 3)at 16℃.M:protein molecular weight standard; 1:total protein before IPTG induction;2:total protein after IPTG induction;3:pellet fraction;4:soluble fraction.
再将经镍亲和柱纯化后的蛋白用离子交换柱(QFF)进行进一步纯化,如图4A所示,在离子交换纯化过程中出现了3个蛋白洗脱峰(P1、P2和P3)。SDS-PAGE电泳结果显示大部分目的蛋白出现在峰P2中(图4B)。
将离子交换纯化后的蛋白再用分子筛层析纯化,结果如图5A所示,在77.26 mL位置处出现蛋白洗脱峰,峰形较好,收集峰处蛋白样品,并进行SDS-PAGE电泳检测。SDS-PAGE电泳结果显示,PX-BARSNX7蛋白的纯度达到95%以上(图5B)。最后,将纯化后的蛋白进行Western blotting检测(图6)。

图3 融合蛋白PX-BARSNX7镍柱纯化SDS-PAGE检测Fig.3SDS-PAGE result of the purified recombinant humanPX-BARSNX7 by Ni column.M:protein molecular weight standard;1:elution fraction by 40 mmol/L imidazole;2:elution fraction by 250 mmol/L imidazole.

图4 融合蛋白PX-BARSNX7离子交换纯化的(QFF)AKTA色谱图(A)及SDS-PAGE检测图(B)Fig.4(A)The ion exchange chromatography of the purified recombinant humanPX-BARSNX7.(B)SDS-PAGE result of the purified recombinant humanPX-BARSNX7 by ion exchange.M:protein molecular weight standard;C:PX-BARSNX7 before loading on the ion exchange column;FT:flow through;P1:the first peak;P2:the second peak;P3: the third peak.

图5 融合蛋白PX-BARSNX7分子筛纯化的AKTA色谱图(A)及SDS-PAGE检测图(B)Fig.5(A)The gel filtration chromatogram of the purified recombinant humanPX-BARSNX7.(B)SDS-PAGE result of the purified recombinant humanPX-BARSNX7 by gel filtration.M:protein molecular weight standard;1:purified recombinant humanPX-BARSNX7.

图6 融合蛋白PX-BARSNX7的Western blotting检测Fig.6Western blotting of recombinant humanPX-BARSNX7. M:proteinmolecularweightstandard;1:purified recombinant humanPX-BARSNX7.
2.4 人源重组融合蛋白PX-BARSNX7的均一性检测
为了检测PX-BARSNX7在溶液中的状态,将分子筛纯化的蛋白用动态光散射分析。动态光散射结果显示:蛋白溶液中100%Mass的散射光均来自R为5.7 nm的颗粒物质。Pd<15%,说明颗粒物质存在形式单一,具有良好的均一性(图7)。这些指标都说明,经过纯化,人源重组融合蛋白PX-BARSNX7可以达到良好的均一性。
2.5 人源重组融合蛋白PX-BARSNX7与磷脂结合特异性分析
PX结构域具有特异性地与磷脂酰肌醇结合的能力。为了检测PX-BARSNX7是否也具有磷脂酰肌醇结合的能力以及磷脂结合的特异性,我们将PX-BARSNX7进行了磷脂结合实验。如图8所示,融合蛋白PX-BARSNX7能结合PtdIns(4)P、PtdIns(5)P、PtdIns(4,5)P2、PI(3,4,5)P3。其中,
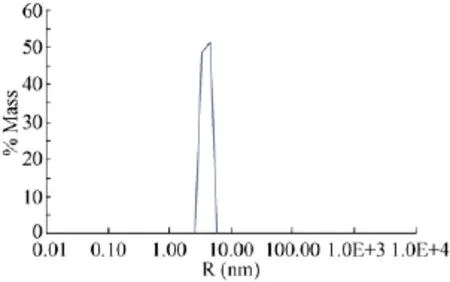
图7 融合蛋白PX-BARSNX7动态光散射结果(R:流体动力学半径;%Mass:质量分数)Fig.7Dynamiclightscattering(DLS)sized distribution result of the purified recombinant humanPX-BARSNX7.R:hydrodynamic radius;%Mass:mass fraction.
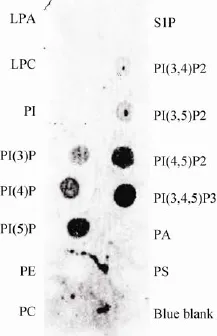
图8 融合蛋白PX-BARSNX7的膜脂结合检测Fig.8Protein-Lipid Overlay Assay of recombinant humanPX-BARSNX7.
与PtdIns(5)P、PtdIns(4,5)P2、PtdIns(3,4,5)P3相互作用较强,而和PtdIns(4)P的作用相对较弱。这表明PX-BARSNX7具有较为广泛的磷脂结合能力,能结合多种磷脂酰肌醇。
3 讨论
SNX-PX-BAR是在细胞内吞和蛋白分选运输中发挥重要作用的蛋白,具有两个可以与膜结合的结构域:PX结构域和BAR结构域。PX结构域特异性地与磷脂酰肌醇结合[19]。BAR结构域可以感应膜的曲率或诱导膜的弯曲,在膜的重塑中发挥重要作用[2,20-21]。
不同SNX-PX-BAR蛋白与磷脂酰肌醇的结合能力不同。SNX1可以结合PtdIns(3)P和PtdIns(3,5)P2[22];SNX2结合PtdIns(3)P[23];SNX9可以结合PtdIns(3)P、PtdIns(3,4)P2、PtdIns(4,5)P2和PtdIns(3,4,5)P3[24];SNX18可以结合PtdIns(3,4)P2和PtdIns(4,5)P2[25]。我们首次对SNX7的磷脂酰肌醇结合能力进行了研究。Protein-Lipid Overlay Assay实验表明,与SNX9类似,SNX7也具有较为广泛的磷脂酰肌醇结合能力,能结合多种磷脂酰肌醇。其中,SNX7与PtdIns(5)P、PtdIns(4,5)P2和PtdIns(3,4,5)P3的结合能力相对较强,与PtdIns(4)P的结合能力较弱。
目前,SNX7的研究才刚刚起步。揭示SNX7的功能及其机制,还需要更多的细胞生物学和结构生物学的研究。SNX7的PX结构域的晶体结构虽然已被解析,但尚缺乏PX-BARSNX7(包括PX结构域和BAR结构域的SNX7片段)或SNX7全长的结构。
本研究在大肠杆菌中成功表达了PX-BARSNX7蛋白。通过镍柱亲和层析、离子交换和分子筛纯化,获得纯度大于95%的PX-BARSNX7蛋白。动态光散射实验表明,纯化后的PX-BARSNX7蛋白在溶液中的状态是较为均一的。这些研究为PX-BARSNX7蛋白的结构研究奠定了基础。
REFERENCES
[1]Carlton J,Bujny M,Rutherford A,et al.Sorting nexins--unifyingtrendsandnewperspectives. Traffic,2005,6(2):75–82.
[2]Cullen PJ.Endosomal sorting and signalling:an emerging role for sorting nexins.Nat Rev Mol Cell Biol,2008,9(7):574–582.
[3]Seet LF,W Hong.The Phox(PX)domain proteins and membrane traffic.Biochim Biophys Acta, 2006,1761(8):878–896.
[4]Teasdale RD,BM Collins.Insights into the PX (phox-homology)domain and SNX(sorting nexin) protein families:structures,functions and roles in disease.Biochem J,2012,441(1):39–59.
[5]Worby CA,Dixon JE.Sorting out the cellular functions of sorting nexins.Nat Rev Mol Cell Biol, 2002,3(12):919–931.
[6]Cullen PJ,HC Korswagen.Sorting nexins provide diversity for retromer-dependent trafficking events. Nat Cell Biol,2012,14(1):29–37.
[7]Hong Z,Yang Y,Zhang C,et al.The retromer componentSNX6interactswithdynactin p150(Glued)andmediatesendosome-to-TGN transport.Cell Res,2009,19(12):1334–1349.
[8]WassmerT,AttarN,BujnyMV,etal.A loss-of-function screen reveals SNX5 and SNX6 as potential components of the mammalian retromer.J Cell Sci,2007,120(Pt 1):45–54.
[9]RojasR,KametakaS,HaftCR,etal. Interchangeable but essential functions of SNX1 and SNX2 in the association of retromer with endosomesandthetraffickingofmannose 6-phosphate receptors.Mol Cell Biol,2007,27(3): 1112–1124.
[10]Carlton J,Bujny M,Peter BJ,et al.Sorting nexin-1 mediatestubularendosome-to-TGNtransport throughcoincidencesensingofhigh-curvature membranes and 3-phosphoinositides.Curr Biol, 2004,14(20):1791–1800.
[11]McGoughIJ,CullenPJ.Recentadvancesin retromer biology.Traffic,2011,12(8):963–971.
[12]Traer CJ,Rutherford AC,Palmer KJ,et al.SNX4 coordinatesendosomalsortingofTfnRwith dynein-mediatedtransportintotheendocytic recycling compartment.Nat Cell Biol,2007,9(12): 1370–1380.
[13]Park J,Kim Y,Lee S,et al.SNX18 shares a redundant role with SNX9 and modulates endocytic trafficking at the plasma membrane.J Cell Sci, 2010,123(Pt 10):1742–1750.
[14]Soulet F,Yarar D,Leonard M,et al.SNX9 regulates dynamin assembly and is required for efficient clathrin-mediated endocytosis.Mol Biol Cell,2005,16(4):2058–2067.
[15]Heiseke A,Schöbel S,Lichtenthaler SF,et al.The novel sorting nexin SNX33 interferes with cellular PrP formation by modulation of PrP shedding. Traffic,2008,9(7):1116–1129.
[16]BadourK,McGavinMKH,ZhangJ,etal. InteractionoftheWiskott-Aldrichsyndrome protein with sorting nexin 9 is required for CD28 endocytosis and cosignaling in T cells.Proc Natl Acad Sci USA,2007,104(5):1593–1598.
[17]Xu L,Yin W,Xia J,et al.An anti-apoptotic role of SNX7isrequiredforliverdevelopmentin zebrafish.Hepatology,2012,55(6):1985–1993.
[18]Dowler S,Deak M,Kular G,et al.Identification of pleckstrin-homology-domain-containingproteins with novel phosphoinositide-binding specificities. Biochem J,2000,351(Pt 1):19–31.
[19]Ago T,Takeya R,Hiroaki H,et al.The PX domain asanovelphosphoinositide-bindingmodule. BiochemBiophResCommun,2001,287(3): 733–738.
[20]Peter BJ,Kent HM,Mills IG,et al.BAR domains as sensors of membrane curvature:the amphiphysin BARstructure.Science,2004,303(5657): 495–499.
[21]van Weering JRT,Sessions RB,Traer CJ,et al.Molecular basis for SNX-BAR-mediated assembly of distinct endosomal sorting tubules.The EMBO J,2012,31(23):4466–4480.
[22]Cozier GE,Carlton J,McGregor AH,et al.The phoxhomology(PX)domain-dependent, 3-phosphoinositide-mediated association of sorting nexin-1withanearlysortingendosomal compartment is required for its ability to regulate epidermal growth factor receptor degradation.J Biol Chem,2002,277(50):48730–48736.
[23]ZhongQ,LazarCS,TronchèreH,etal. Endosomal localization and function of sorting nexin 1.Proc Natl Acad Sci USA,2002,99(10): 6767–6772.
[24]Yarar D,Surka MC,Leonard MC,et al.SNX9 activitiesareregulatedbymultiple phosphoinositidesthroughbothPXandBAR domains.Traffic,2008,9(1):133–146.
[25]Håberg K,Lundmark R,Carlsson SR.Carlsson, SNX18isanSNX9paralogthatactsasa membrane tubulator in AP-1-positive endosomal trafficking.J Cell Sci,2008,121(Pt 9):1495–1505.
(本文责编郝丽芳)
Expression,purification and phosphoinositide binding specifity of recombinant human SNX7 expressed in Escherichia coli
Zhan Feng1,2,Tingting Xu2,and Jinxin Xu2
1 School of Life Science,Anhui University,Hefei 230601,Anhui,China
2 Guangzhou Institutes of Biomedicine and Health,Chinese Academy of Sciences(GIBH),Guangzhou 510530,Guangdong,China
Sorting nexins(SNXs)are a large group of proteins that contain Phox(PX)domain and involve in regulating endocytosis and endosome sorting.SNX7,a member of SNXs family,contains a PX domain and a BAR domain.In zebrafish,SNX7 is a liver-enriched anti-apoptotic protein and indispensible for the liver development.A fragment of SNX7 cDNA(px-barsnx7),encoding the PX domain and the BAR domain,was inserted into the expressing vector p28a,transformed into E.coli Rosseta 2(DE3),and then induced by isopropyl β-D-1-Thiogalactopyranoside(IPTG).After affinity,ion exchange and gel filtration purification,the purity ofPX-BARSNX7 reached over 95%.Dynamic light scattering(DLS) experiment indicated thatPX-BARSNX7 was homogeneous in solution.Lipid overlay assay showed thatPX-BARSNX7 can bind to PtdIns(5)P,PtdIns(4,5)P2and PtdIns(3,4,5)P3.
Sorting nexin 7(SNX7),lipid overlay assay,homogeneity,expression and purification
November 25,2013;Accepted:February 11,2014
Jinxin Xu.Tel:+86-20-32015240;E-mail:xu_jinxin@gibh.ac.cn
Supported by:National Basic Research Program of China(973 Program)(No.2012CB917200).
国家重点基础研究发展计划(973计划)(No.2012CB917200)资助。
时间:2014-03-10网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.130600.html
