萌动小麦生化指标及Mixolab糊化特性的变化
2014-06-11李兴军路子显
李兴军 姜 平 路子显
(国家粮食局科学研究院,北京 100037)
小麦收获前穗上发芽,在我国长江流域的山谷小麦产区、东北春小麦产区及华北、西北的冬小麦产区,时有发生。不正常年份,我国小麦的穗发芽,面积能够达到2 471万hm2,占我国小麦种植面积的83%[1]。有研究表明, 90 g小麦中如果有一粒小麦严重发芽,就严重地影响测定样品的降落数值和糊化值[2]。因此建立快速有效的芽麦检测方法,选育抗穗发芽的小麦品种,是粮食工作者的重要目标之一。闫长生等[3]采用收获时种子发芽率和面粉降落数值法于2000~2002年评价了我国小麦主产区1950年以来主要推广的781个品种(系)的穗发芽抗性,发现穗发芽抗性20世纪90年代育成的品种与80年代的相近,但是明显弱于50~70年代育成的品种。一个重要原因是进入80年代,出粉率高的白麦品种受到偏爱,白麦抗穗发芽能力不如红麦。从白粒小麦品种或特殊种质资源选育抗穗发芽品种进展缓慢,于是利用基因工程技术反义导入α-淀粉酶活性的调控基因来加快抗穗发芽育种[4-6]。
Fox等[7]指出优质小麦面粉包含有α-淀粉酶、β-淀粉酶、蛋白酶等多种酶。其中的大多酶在不发芽、含水率低的完整粒小麦中活性很低,加入水时才能被活化,然而他们对面粉、面包及其他加工品的功能和营养属性起重要影响。小麦萌动(发芽)时,蛋白酶活性增加了17倍[8],而蛋白质及游离氨基酸含量报道较少。本试验分析了萌动小麦游离氨基酸、总蛋白质及水溶性糖类的含量、面团Mixolab糊化特性的变化,以期对我国芽麦检测及小麦营养品质的评价提供参考。
1 材料与方法
1.1 试验样品及准备
采用的小麦样品如表1。芽麦制备方法如下:100粒小麦在培养皿打湿的滤纸上于25 ℃萌动48 h,然后60 ℃烘干,40目粉碎,4 ℃保存。大量小麦样品在潮湿的双层纱布上萌动,供Mixolab 面团糊化特性测定。

表1 采用的小麦样品
注:发芽率在20 ℃测定;LSD test,P=0.05,同一列相同字母表示品种之间差异不显著。
1.2 仪器设备
肖邦Mixolab混合实验仪、肖邦SD matic仪:特雷首邦(北京)贸易有限公司。
1.3 试剂
含内切和外切酶活的蛋白酶来自Bacillusamy-loliquefaciens,仅含内切活性的蛋白酶来自Aspergillus melleus:Sigma公司。
1.4 样品制备
小麦样品粉碎(40目筛)后,称取1.0 g面粉于50 mL塑料离心管中,加入15 mL己烷,充分涡旋,盖上盖子。常温下振荡3 h,在4 ℃ 4 000 r/min离心10 min,取沉淀并在通风橱将己烷挥发掉。然后在沉淀中加入15 mL无氨蒸馏水,研磨,在室温下提取5 min, 在4 ℃ 4 000 r/min离心10 min,上清液即为提取液。
1.5 游离氨基酸含量测定
按照文献[9]方法。吸取0.50 mL样品提取液于10 mL带塞刻度试管中,依次加入无氨蒸馏水0.25 mL、乙酸-乙酸钠缓冲液0.5 mL、3% 茚三酮0.5 mL, 混匀,盖上塞子。置沸水浴中12 min,冷却,立即于每管中加入95%乙醇5 mL,塞好塞子,剧烈涡旋试管,促进加热时形成的红色产物被空气中的氧所氧化而褪色。最终溶液显示蓝紫色,于570 nm波长下测其吸光值。以亮氨酸作标准曲线,游离氨基酸含量单位是μg氨基态氮/g 干重(dw)。
1.6 还原糖和总糖含量测定
采用3,5-二硝基水杨酸(DNS)方法[10]。800 μL提取液加入4.4 mmol/L DNS反应液600 μL,混匀,沸水浴5 min。冷却至室温,加入蒸馏水定容至10 mL,测定D540。以葡萄糖作标准曲线。总糖含量采用苯酚-硫酸方法[11]。0.5 mL提取液加入5% 苯酚水溶液0.5 mL,混匀,再加入浓硫酸3 mL,混匀,冷却后测定D490。
1.7 蛋白酶和内切蛋白酶水解
含有内切和外切活性的Bacillusamyloliquefaciens蛋白酶,酶解条件是50 mg样品中加入2 mL 50 mmol/L Tris-HCl缓冲液pH 7.5、酶活0.106 U,37 ℃酶解3 h。Aspergillusmelleus内切蛋白酶酶解条件是50 mg样品加入2 mL 50 mmol/L Tris-HCl缓冲液pH 7.5、酶活0.120 U,37 ℃酶解3 h。酶解产物测定游离氨基酸含量。
1.8 破损淀粉含量测定
破损淀粉含量采用肖邦公司SD matic仪器测定。取1 g小麦粉样品放到仪器样品小斗中,在反应杯中加入1滴95%乙醇、3 g硼酸、3 g碘化钾和120 mL水。仪器会自动把反应杯中的温度上升到35 ℃,然后面粉自动落入反应杯中。根据溶液中残留碘的浓度,仪器自动计算出小麦粉中损伤淀粉的含量,以UCD单位表示。最终的小麦粉破损淀粉考虑含水率、蛋白质含量的影响,以UCDC单位表示。蛋白含量测定采用全自动氮元素快速分析仪。
1.9 Mixolab面团糊化特性测定
小麦粉糊化特性采用Mixolab混合实验仪分析,进行恒量加水试验。水分基数14%湿基;参数按照Rosell等[12]方法,包括目标扭矩(1.1±0.5)Nm,转速80 r/min,面团重量75 g,和面初始温度30 ℃,水箱温度30 ℃,水合作用55%,第1阶段30 ℃恒温8 min,第2阶段从30 ℃升温到90 ℃共15 min,第3阶段90 ℃恒温保持7 min,第4阶段从90 ℃降温至50 ℃ 10 min,第5阶段50 ℃恒温5 min,试验总时间45 min。
1.10 数据分析
数据统计与处理采用Excel软件,差异显著性分析采用单因素方差分析,P<0.05为差异显著。
2 结果分析
2.1 萌动小麦中游离氨基酸和糖类含量变化
从表2~表4看出,6个小麦品种萌动后,游离氨基酸总量均显著增加。除了顺义9843,其他5个品种的水溶性还原糖含量在萌动后也显著增加。对6个小麦品种,萌动前后水溶性总糖含量差异不显著。
注:LSD test,P=0.05,同一列相同字母表示品种之间差异不显著,下同。
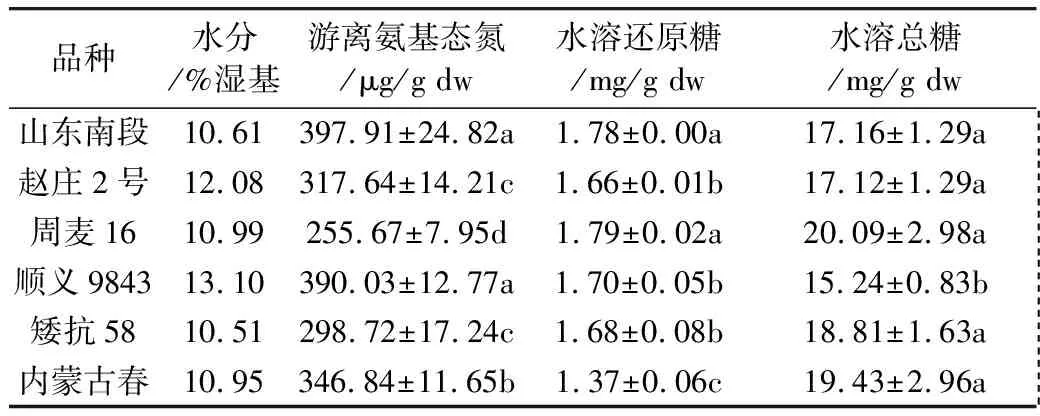
表3 萌动小麦游离氨基酸及糖类含量
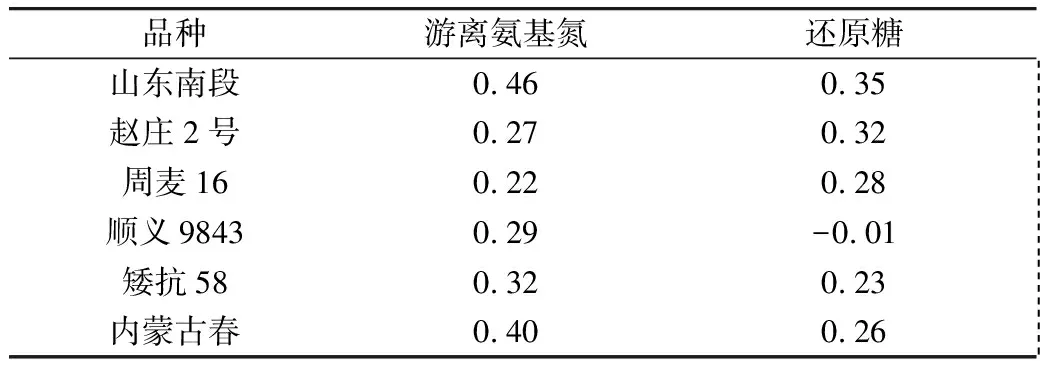
表4 萌动小麦游离氨基酸和还原糖增加的倍数
2.2 小麦萌动后外源蛋白酶对面粉蛋白的降解作用
为了探讨萌动小麦对外源蛋白酶降解的敏感程度,采用微生物蛋白酶处理萌动小麦面粉。从表5~表6看出,小麦萌动后,加入Bacillusamyloliquefaciens蛋白酶(含内切和外切酶),产生大量游离氨基酸,但是小麦品种之间、萌动前后之间游离氨基酸总量差异不显著。加入Aspergillusmelleus蛋白酶(仅含内切酶),酶解产生的游离氨基酸数量约是加入Bacillusamyloliquefaciens蛋白酶酶解产物的0.14~0.23倍;与未萌动小麦比较,除了赵庄2号,萌动的其他5个小麦品种被内切蛋白酶酶解产生的游离氨基酸含量显著增加。

表5 蛋白酶(内切+外切)降解萌动小麦粉产生游离氨基酸的量/μg氨基氮/g dw
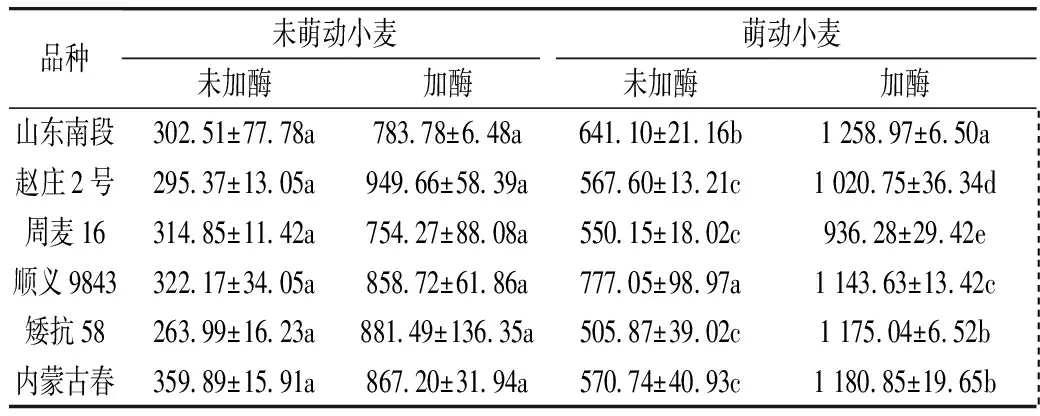
表6 内切蛋白酶酶解萌动小麦粉产生游离氨基酸的量/μg氨基氮/g dw
2.3小麦萌动后蛋白质、破损淀粉含量及Mixolab糊化特性的变化
就小麦萌动对蛋白质的影响,从表7看出,萌动小麦蛋白含量(%干基)增大。小麦粉中淀粉粒的破损率与小麦硬度及研磨剧烈度有关,在同样粉碎条件下,2个硬麦品种周麦16、山东南段破损淀粉含量各是15.07、18.90 UCDC,萌动后稍增加;2个软麦品种顺义9843、赵庄2号破损淀粉含量各是18.54、20.67 UCDC,萌动后显著减少。说明小麦籽粒萌动48 h对蛋白质合成的影响较淀粉晶体结构的影响明显。
Mixolab曲线能够提供小麦粉的吸水率、面团蛋白质结构网络及淀粉糊化信息。从图1a~图1b及表8看出,和面恒量加水率对4个品种萌动小麦是61.6%~64.0%,与对未萌动小麦的63.6%~65.4%相似。C1是30 ℃ 面团达到最大扭矩所需的时间(面团形成时间),萌动小麦<未萌动小麦。4个品种萌动小麦C1稠度峰值(1.09~1.11 Nm)类似未萌动小麦的C1稠度峰值(1.09~1.15 Nm);和面峰值带宽对4个品种萌动小麦是0.05~0.10 Nm,对未萌动小麦品种是0.06~0.09 Nm;面团稳定时间是面粉团在最大扭矩保持的时间,对4个品种萌动小麦是1.87~3.78 min,对未萌动小麦是2.03~5.63 min。

表7 小麦粉大量样品的蛋白质及破损淀粉含量

图1 未萌动小麦与萌动小麦恒量加水Mixolab面团糊化特性曲线

表8 Mixolab测定的面团糊化特性
注:样品编号同表7。
C2稠度谷值为机械和热约束引起的蛋白质网络弱化度,高C2稠度谷值表示强烈的蛋白质网络。最初阶段过度混合期间面团稳定性及抗变形能力萌动小麦<未萌动小麦。蛋白网络弱化度(C1-C2)萌动小麦>未萌动小麦。
高C3淀粉糊化峰值,表示凝胶形成能力萌动小麦<未萌动小麦。C4淀粉糊化黏度谷值、C5淀粉回生终点值均是萌动小麦<未萌动小麦。有趣的是,与其他小麦品种比较,萌动的顺义9843(样品编号8)小麦淀粉糊化谷值较大,C3-C4表示的内源淀粉酶活性(淀粉衰减值)极低,与该品种小麦萌动后还原糖含量不增加相一致。
3 讨论
穗发芽鉴定方法有测定淀粉降解酶的浊度法、二硝基水杨酸(DNS)法、底物染色法及ELISA法、降落数值法,测定黏度参数的快速黏度分析仪和布氏黏培仪[13],检测脂肪酶的荧光法[14],以及Donelson等[15]提出的预凝胶化淀粉处理的α-淀粉酶活法。降落数值法、快速黏度分析仪和布氏黏培仪都是通过控温(92~100 ℃)使小麦面粉-水悬浮液达到凝胶状态,再利用内源淀粉水解酶使这种凝胶态转变为溶胶态,测定悬浮液的黏度下降。Mixolab能够定性面团在混合和温度双重限制条件下的理化特性,Dapcevic等[16]发现Mixolab测定值与传统经验式流变学设备粉质仪和糊化仪的测定值具有显著的相关性。Mixolab仪分析的是面团蛋白网络弱化程度和淀粉糊化特性[17]。本研究显示,萌动小麦淀粉糊化峰值和谷值均减小,淀粉回生终点值降低。另外,与其他小麦品种比较,萌动的顺义9843小麦淀粉衰减值(C3-C4)表示的内源淀粉酶活性是极低的。这个结果与该小麦品种萌动时DNS法测定的还原糖含量不增加相一致。这说明采用DNS法检测芽麦还原糖增多,不是芽麦检测的可靠指标。
许多学者认为,小麦籽粒发生穗发芽过程中,蛋白水解酶对于小麦品质的不利影响不及α-淀粉酶[13]。他们的理由是,蛋白水解酶是一个复杂的体系,依据底物分类为内肽酶、羧肽酶、氨肽酶及其他肽酶,目前还没有确切的证据来判断蛋白水解酶对小麦品质影响的精确程度[13]。本研究则首次表明,小麦萌动后,内源蛋白酶解产生显著量的游离氨基酸,而且快速定氮仪显示蛋白含量增大,Mixolab仪显示蛋白质网络弱化程度(C1-C2)加大,即说明小麦萌动过程蛋白质合成和降解同时存在,游离氨基酸积累。
小麦本身蛋白酶对面团形成的调控作用已经争议了多年,多数人认为他们对面粉蛋白的物理化学变化起微小作用[18],可能在于面粉蛋白酶的最佳pH值是4,在较高pH值时酶快速失活,而且 pH、盐、氧化剂、机械力对小麦蛋白质结构具有显著的影响。在小麦萌动(发芽)时,蛋白酶活性增加了17倍,以血红素为底物测定外切蛋白酶活性,他对发芽变化贡献很小;以偶氮酪蛋白为底物测定内切蛋白酶活性,他贡献发芽状况下的大部分蛋白酶活性[19]。本研究中,萌动小麦蛋白质结构网络弱化程度加大,内切蛋白酶容易进攻小麦贮藏蛋白,产生大量游离氨基酸,用于合成淀粉代谢的蛋白酶类。
4 结论
萌动小麦面粉蛋白质结构网络弱化程度加大,游离氨基酸总量显著增加,以及淀粉糊化峰值和谷值降低,可以作为芽麦及其面粉质量评价的参考依据。
[1]Xiao S H, Zhang X Y, Yan C S, et al. Germplasm improvement for preharvest sprouting resistance in Chinese white-grained wheat: An overview of the current strategy [J]. Euphytica, 2002, 126: 35-38
[2]Jensen S A, Law D P. A rapid method for the detection of sprouting in populations of wheat kernels [J]. Cereal Chemistry, 1983, 60(5):406-407
[3]闫长生,张海萍,海林,等. 中国小麦品种穗发芽抗性差异的研究[J].作物学报, 2006, 32(4): 580-587
[4]任江萍,尹君,牛烘斌,等. 反义trxs基因对转基因小麦种子内源trxh基因表达的影响[J].植物生理与分子生物学学报, 2007, 33(4):325-332
[5]杨燕,张春利,陈新民,等. 穗发芽率和发芽指数及STS标记Vp1B3在小麦抗穗发芽基因型鉴定中的应用[J].麦类作物学报, 2007, 27(4): 577-582
[6]兰秀锦,郑有良,任晓波,等. RSP抗穗发芽基因育种利用研究初报[J].植物遗传资源学报, 2005, 6(2):204-209
[7]Fox P F, Morrissey P A. Exogenous enzymes in food processing [M]//Vitale L, Simeon V. Industrial and Clinical Enzymology. New York: Pergamon Press, 1981:39-48
[8]Preston K R, Dexter J E, Kruger J E. Relationship of exoproteolytic and endoproteolytic activity storage protein hydrolysis in germinating durum and hard red spring wheat [J]. Cereal Chemistry, 1978, 55: 877-888
[9]李兴军,姜平,陆晖. 小麦及加工品中游离氨基酸总量测定[J]. 粮食科技与经济, 2013, 38(1)35-36
[10]西北农业大学主编.基础生物化学实验指导[M].西安:陕西科学技术出版社,1986, 51-53
[11]Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry,1956, 28: 350-356
[12]Rosell C M, Collar C, Haros M. Assessment of hydrocolloid effects on the thermo-mechanical properties of wheat using the Mixolab [J]. Food Hydrocolloids, 2007, 21: 452-462
[13]肖世和,闫长生,张海萍,等. 小麦穗发芽研究[M]. 北京:中国农业科学技术出版社,2004
[14]李兴军. 芽麦快速检测的几种方法[C]//中国粮油学会粮油质检研究分会编、粮油标准质量管理与检验. 第一届中国粮油标准质量年会优秀论文汇编.北京:中国标准出版社,2010: 24-27
[15]Donelson J R, Gaines C S, Donelson T S, et al. Detection of wheat preharvest sprouting using a pregelatinized starch substrate and centrifugation[J]. Cereal Chemistry, 2001, 78(3):282-285
[16]Dapcevic T, Hadnadev M, Polic M. Evaluation of the possibility to replace conventional rheological wheat flour quality control instruments with the new measurement tool-Mixolab [J]. Agriculturae Conspectus Scientificus, 2009, 74(3):169-174
[17]Torbica A, Hadnadev M, Dapcevic T. Rheological, textural and sensory properties of gluten-free bread formulations based on rice and buckwheat flour [J]. Food Hydrocolloids, 2009, 74(3):169-174
[18]McDonald C E. Proteolytic enzymes of wheat and their relation to baking quality [J]. Bakers Digest, 1969, 43(4):26-30, 32
[19]Preston K R. Note on separation and partial purification of wheat proteases by affinity chromatography [J]. Cereal Chemistry, 1978, 55: 793-798.
