经皮经肝双极射频消融导管恶性梗阻性黄疸20例
2014-06-09崔宁李晓群
崔宁,李晓群
·非血管介入Non-vascular intervention·
经皮经肝双极射频消融导管恶性梗阻性黄疸20例
崔宁,李晓群
目的探讨经皮经肝双极射频消融(RFA)导管治疗恶性梗阻性黄疸的可行性、安全性及初步疗效。方法选取20例失去手术治疗机会的恶性胆道梗阻患者(其中2例胆道支架再堵塞),采用经皮经肝穿刺胆道路径双极RFA治疗,消融功率为5~12W,单次消融时间为60~120 s,消融持续时间平均4.66min(1.5~8.5min),有效消融范围平均为5.76 cm(4~10 cm)。消融后导入球囊扩张阻塞段,再植入胆道金属支架,观察术后疗效、安全性及并发症。结果20例患者均成功完成RFA治疗:17例植入胆道支架,其中11例支架植入前用球囊扩张;1例单行球囊扩张术未放置支架;2例胆道支架再阻塞后消融(1例球囊扩张)。术后未出现胆漏、胆道感染、肝贯通伤、腹膜炎等并发症。20例胆道引流均获成功;中位随访期为3个月(0.5~10个月);术后1、3个月分别有19例和14例支架通畅,术后1、3个月分别有19例和14例生存,随访期内,20例患者中8例生存,12例死亡。中位生存期为144 d(13~330 d),支架通畅中位时间为90 d(13~210 d)。12例死亡患者中8例因恶病质、多脏器功能衰竭死亡,但随访期内总胆红素等指标无升高。结论经皮肝穿刺胆道内导管射频消融术作为一种新型安全、可行的治疗方法,取得了一定疗效,但远期疗效仍有待进一步探讨。
恶性胆道梗阻;胆管;导管;射频消融;支架
恶性梗阻性黄疸临床常见病因包括原发于胆道系统的恶性肿瘤。对于无法手术切除的胆道肿瘤患者,临床目前尚缺乏直接针对肿瘤组织的有效治疗。射频消融(RFA)对损毁肿瘤组织和延长患者生存期的作用已被广泛接受[1-3]。HabibTMEndoHPB作为一种新型双极RFA导管,可采用内镜或经皮经肝穿刺胆道路径消融,摧毁部分胆道肿瘤,使胆道狭窄堵塞段再通;也可在穿刺成功后使用双极射频导管清除已堵塞金属支架内的肿瘤、坏死组织,从而达到治疗恶性梗阻性黄疸的作用[4]。本研究采用新型双极消融导管治疗20例恶性胆道阻塞患者,取得了初步疗效。
1 材料与方法
1.1 材料
1.1.1 临床资料选取2011年9月—2013年9月20例不能手术治疗的恶性胆道梗阻患者,采用经皮经肝穿刺胆道内导管RFA治疗(其中包括胆道支架再阻塞2例)。20例中男14例,女6例;年龄31~86岁,平均64岁。患者术前总胆红素23.3~461.9μmol/L,平均312μmol/L;直接胆红素12.3~316.3μmol/L,平均209.4μmol/L。导致恶性阻塞性黄疸的原因有:胆管癌6例,肝癌4例,肝转移癌5例,胰腺癌4例(2例为胰腺癌肝转移),十二指肠壶腹周围癌1例。
1.1.2 主要设备射频发生器为美国AngioDynamics公司生产的RITA 1500X型射频发生器。射频电极由Emcision公司(英国)生产,TMEndoHPB导管。导管顶端有2个相隔8mm的电极,消融时在两电极间可产生长约(25±3)mm柱形凝固性坏死区(电极距头端5 mm)。消融功率为5~10W,消融时间为90~120 s。可以根据肿瘤的长度重复一次或多次消融。植入支架采用镍钛记忆合金胆道支架,用COOK公司PTBD套装等。
1.2 方法
1.2.1 术前禁食、禁水6 h,作碘过敏试验及抗生素过敏试验,备好所需物品与器械,术前30 min肌内注射盐酸哌替啶50 mg。检查活化部分凝血活酶时间(APTT),凝血酶原时间(PT),纤维蛋白原(FIB),凝血酶时间(TT),血小板计数。根据CT或MRI等影像资料了解胆道狭窄部位及程度。
1.2.2 术中
1.2.2.1 经皮经肝穿刺胆道造影:患者平卧,心电监护下,常规消毒,局麻后在X线透视定位下,穿刺肝内肝管胆道明确狭窄段。穿刺成功后先行造影显示梗阻部位、范围、程度。
1.2.2.2 胆管消融:顺导丝送入套管进入胆管后,用泥鳅导丝通过胆管梗阻段进入十二指肠,再通过导丝引导,把8F的HabibTMEndoHPB消融导管送至梗阻部位,消融治疗从病变远端开始并超出病变范围;消融功率为5~10W,消融时间为60~120 s。
1.2.2.3 球囊扩张、支架植入:RFA后用胆道球囊或扩张探条扩张狭窄处后,植入自膨式金属支架,其两端均超过梗阻段至少1 cm,再造影见胆道通畅,最后放置内外引流管。(图1、2)。
1.2.3 术后禁食、禁水2 h,24 h内绝对卧床休息,避免增加腹压,监测生命体征,准确记录胆汁引流量及性状。观察记录皮肤、巩膜黄染情况,有否加深或减退。注意引流管是否通畅,观察并记录胆汁引流量及颜色,同时观察胆汁是否有杂质,如血块、坏死组织等;每天需以无菌技术更换引流袋并观察伤口周围皮肤情况,是否出现红肿、有无渗液等情况。引流管冲洗时按无菌操作原则进行。当每日引流管<50 ml后拔除外引流管。
1.2.4 疗效评价患者术后定期(术后第1、3、5、7天和术后1个月,以后每3个月1次)复查肝功能,明确患者黄疸消褪情况。通过电话方式随访,了解患者支架通畅及存活情况。
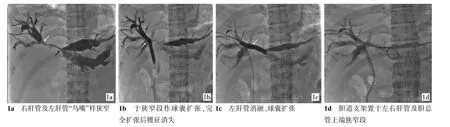
图1 肝门区胆管癌、肝内多发转移并肝内胆管扩张

图2 胆管癌支架再阻塞消融术
2 结果
2.1 手术相关情况及疗效
20例患者均成功完成胆道RFA治疗,引流均获成功,术后所有患者症状完全或部分缓解。20例患者中,17例植入胆道支架,其中11例用球囊扩张后再放置支架;1例患者消融后单行球囊扩张术,未植入支架;2例为胆道支架再堵塞,消融后支架再通。所有患者胆道梗阻长度为1.1~8.0 cm,平均3.8 cm;烧灼次数为1~5次,平均2.3次;消融平均功率为9.2W;消融持续时间平均为4.7 min(1.5~8.5min),有效消融范围平均为5.76 cm(4~10 cm);消融前病变胆管管腔平均直径为1 mm(0~2 mm);消融后病变管腔平均直径为7.8 mm(6~8 mm)。手术时间为40~60 min。消融前总胆红素平均312μmol/L(23.3~461.9μmol/L),直接胆红素平均209.4μmol/L(12.3~316.3μmol/L),消融术后1、3、5、7 d内总胆红素和直接胆红素均有下降,总胆红素术后7 d降至186μmol/L,直接胆红素降至134.8μmol/L。
本组1个月末19例支架通畅,3个月末11例支架通畅,4、5、6个月时分别有5、4、2例支架通畅;1、3、5和7个月时分别有19、14、5和2例患者生存;中位生存期是144 d(13~330 d),支架通畅中位数为90 d(13~210 d),(图3、4显示了Kaplan-Meier曲线描绘生存和支架通畅曲线);其中8例患者因恶病质多脏器功能衰竭死亡,随访期内总胆红素等指标无升高。
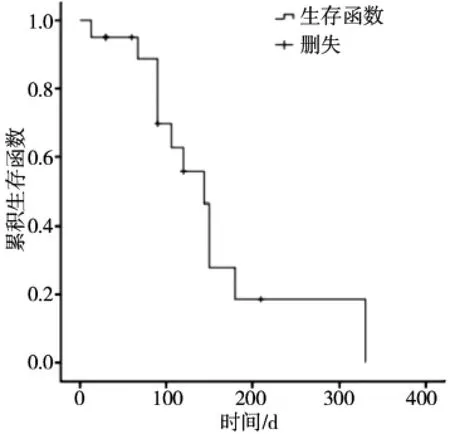
图3 RFA治疗后生存函数图
本组患者,消融后支架内残留坏死的组织或血栓块等,术后复查显示支架有充盈缺损的征象,留置外引流管在术后1、3、5、7 d引流并冲洗,复查显示扩张胆管明显回缩,支架充盈缺损减少,关闭引流管1~3 d后复查。若见胆管仍回缩良好且支架充盈缺损消失,表明支架通畅情况良好,胆汁流通顺畅,当每日胆汁引流量<50m l后拔除引流管。
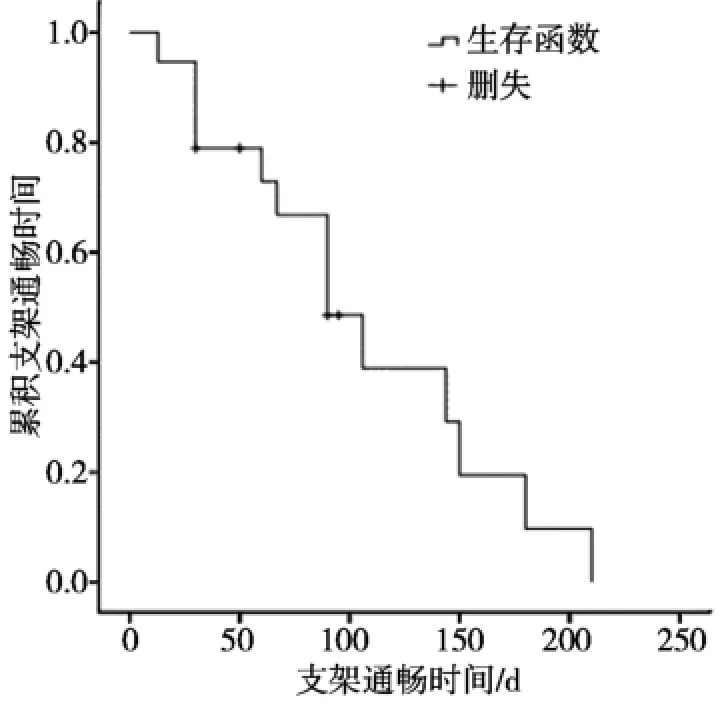
图4 RFA治疗支架通畅时间示意图
2.2 并发症
部分患者术后偶有恶心呕吐,对症处理后24 h内缓解。所有患者均未出现胆道感染、胆漏、菌血症及败血症、动静脉瘘、引流管堵塞脱落、水电解质失衡、胰腺炎等并发症。
2.3 随访和支架通畅情况
所有患者通过电话每月1次的方式随访,中位随访期为3个月(0.5~10个月)。随访期内5例患者支架堵塞,通过相关影像学(DSA)及胆红素复查,出现胆道对比剂不下行再次梗阻,胆管扩张及总胆红素、直接胆红素升高作出诊断。其中3例堵塞后行经皮经肝胆道引流(PTBD),其中1例生存期延长至330 d。
3 讨论
据文献统计未接受治疗恶性胆道梗阻的患者生存期不足3个月[5],接受胆管引流后生存期可达6~7个月[6-7],胆道金属支架植入引流术作为治疗恶性胆道梗阻一种姑息性方法得以普遍应用[8],但由于单纯的支架植入只能引流而不能直接治疗肿瘤,故仍有50%患者在6个月内出现肿瘤生长而造成支架再狭窄或阻塞[9]。
近年来逐渐开展的胆道内导管RFA治疗联合金属支架植入新技术有望改善这一现状[10],在这项技术发展过程中最早出现的是经内镜单极RFA联合支架植入术,并取得良好疗效[9]。此法不足之处是对于高位恶性胆道梗阻治疗较为困难[11-12],而且以往多采用单极探头,消融范围有限,治疗时间长,治疗过程中组织损伤和电流热效应变化无法及时评估,采用经皮肝穿刺路径配合新型HabibTMEndoHPB双极RFA导管胆道内消融联合金属支架植入术更适于治疗高位胆管梗阻[10]。
RFA导管的临床应用安全性基于动物模型报告[13]。Patterson等[14]实验结果表明,典型的RFA区包括针道区、凝固区和周围环状出血区。周文平等[15]在离体猪肝的胆管内RFA实验报道了凝固区长轴直径与裸露电极针长度有关,凝固区短轴半径与输出功率和消融时间有关。导管RFA由于热穿透的深度比较有限(3 mm左右),仍是一项姑息性局部热损毁治疗,不可能达到根治性消除肿瘤的目的。因而胆道内导管RFA对于胆道恶性梗阻疗效、适应证的选择仍有待进一步探讨。
我们认为,作为胆道消融治疗效果重点在于治疗后支架通畅时间。技术参数表明HabibTMEndoHPB双极消融导管可产生半径5 mm,长约(25±3)mm柱形凝固性坏死区。为了提高疗效,需最大程度毁损恶性梗阻区病变,延长胆管再通时间,故以下技术要素必须保证:①导管消融范围必须超出病变范围,本组资料表明由于狭窄段长度从1.1~8.0 cm,需要电极的准确定位采取单次或分段多次RFA,以达到最大范围毁损病变目的;②导管消融后需采用与支架直径相匹配球囊扩张压缩毁损病变,扩张梗阻胆管,这样更利于胆汁引流、强化和巩固导管消融效果;③导管消融时金属支架内须留置引流管,导管消融产生的坏死组织碎屑可阻塞胆管,本组早期有1例消融术后即时拔管患者黄疸不降反升,术后3 d再次相同路径穿刺造影显示胆管内有多量充填缺损阻塞,只得再次置管冲洗数日后缓解,故在消融术后需置管冲洗3~5 d待胆管内组织碎屑形成的充填缺损完全清洗消除后方可拔管。
导管RFA可用于治疗胆道支架再阻塞,本组有2例恶性胆道阻塞支架再堵塞患者,采用双极RFA导管加球囊扩张清除支架再堵塞组织扩张胆道消融段行再通重建术,并留置内外引流管冲洗引流以排除残留在胆道里坏死组织,延长了胆道支架通畅时间,但与夏宁等[16]及国外学者Pai等[17]的129 d和65~321 d比较,本组患者支架再通时间较短。
本组6例患者因胆道梗阻严重无法顺利建立胆道消融通道,因此术前先行PTBD引流数日待胆道梗阻缓解、通道顺畅后再行RFA治疗,余患者穿刺成功后均直接行胆道消融治疗。本组患者中位生存期为144 d(13~330 d)与单纯胆管引流后生存期6~7个月相比并无明显优势可言,因此胆管消融加球囊扩张及支架植入治疗恶性胆道梗阻生存期是否优于单纯支架植入,仍需大样本研究加以证实。
胆道内双极射频导管消融治疗常见的并发症为胆道穿孔、胆管炎、出血性胰腺炎等。本组患者术中均无出血、胸膜损伤、血(气)胸、胆汁性腹膜炎、胆心反射、肝贯通伤等并发症;术后部分患者偶有恶心呕吐,对症处理后24 h内缓解,未出现胆漏、菌血症、败血症、动静脉瘘、引流管堵塞脱落、水电失衡、胰腺炎等并发症。认为经皮肝穿胆道内RFA技术并发症发生率低在于:①术中消融功率控制较低、消融时间短。②患者配合度高,操作方便。通过影像设备(DSA、B超)引导依靠娴熟的穿刺技术安全且较为容易,避免损伤重要组织及血管,引起出血性胰腺炎及穿孔的并发症相对较少[10]。③相比内镜下RFA的热力传导易使胰腺组织损伤及胰管开口处的水肿、胰液流出不畅,诱发胰腺炎,经皮肝路径可减少此类风险;同时对于高位的梗阻,经皮经肝路径可减少器械反复进出胆道刺激,方便消融术后置管以清洗消除胆管内坏死组织碎屑,防止胆汁引流不畅,降低胆管感染发生[18]。
总之,本组治疗经验显示,经皮穿刺双极RFA导管治疗恶性胆道梗阻,在技术上安全、可行,近期疗效确实,但长期疗效以及最佳方案仍有待进一步探讨。
[1]张孔志,余文昌,林海澜,等.恶性胆道梗阻的介入治疗策略[J].微创医学,2008,3:302-304.
[2]TTT,GjM.Systematic review and meta-analysis of survival and disease recurrence after radiofrequency ablation for hepatocellular carcinoma[J].Br J Surg,2011,98:1210-1224.
[3]Lencioni R,Cioni D,Della Pina C,et al.Hepatocellular carcinoma:new options for image-guided ablation[J].J Hepatobiliary Pancreat Sci,2010,17:399-403.
[4]Mizandari M,Pai M,Xi F,et al.Percutaneous intraductal radiofrequency ablation is a safe treatment formalignant biliary obstruction:feasibility and early results[J].Cardiovasc Intervent Radiol,2013,36:814-819.
[5]石莹,陈晓星,徐顺福,等.内镜置入可膨式金属胆道支架治疗恶性梗阻性黄疸的疗效观察[J].中华肝胆外科杂志,2012,18:118-122.
[6]Choi JM,Kim JH,Kim SS,et al.A comparative study on the efficacy of covered metal stent andplastic stent in unresectable malignant biliary obstruction[J].Clin Endosc,2012,45:78-83.
[7]Maluf-Filho F,Retes FA,Neves CZ,et al.Transduodenal endosonography-guided biliary drainage and duodenal stenting forpalliation of malignant obstructive jaundice and duodenal obstruction[J].JOP,2012,13:210-214.
[8]Das A,Sivak MV Jr.Endoscopicpalliation for inoperablepancreatic cancer.Cancer Control 7:452-457
[9]Steel AW,Postgate AJ,Khorsandi S,et al.Endoscopically applied radiofrequency ablation appears to be safe in the treatment of malignant biliary obstruction[J].Gastrointest Endosc,2011,73:149-153.
[10]何国林,徐小平,周陈杰,等.一种恶性梗阻性黄疸介入治疗的新方法-经皮肝穿刺胆道内射频消融内支架置入术[J].南方医科大学学报,2011,31:721-723.
[11]虞希祥,朱国庆,施昌盛,等.高位胆道恶性梗阻介入治疗[J].中华肝胆外科杂志,2010,16:30-33.
[12]邹建伟,倪才方,刘一之,等.不同类型高位恶性胆道梗阻的介入治疗[J].临床放射学杂志,2011,30:1523-1526.
[13]Zacharoulis D,Lazoura O,Sioka E,et al.Habib EndoHPB:A novel endobiliary radiofrequency ablation device[J].An Experimental Study.J Invest Surg,2013,26:6-10.
[14]Patterson EJ,Scudamore CH,Owen DA,et al.Radiofrequency ablation ofporcine liver in vivo:effects of blood flow and treatment time on lesion size[J].Ann Surg,1998,227:559-565.
[15]周文平,董家鸿,王春晖,等.肝门部胆管腔内射频消融相关并发症活体实验观察[J].中国现代普通外科进展,2008,11:191-194.
[16]夏宁,程永德,王忠敏.胆道支架再狭窄的介入治疗进展[J].介入放射学杂志,2014,23:82-85.
[17]Pai M,Valek V,Tomas A,et al.Percutaneous intraductal radiofrequency ablation for clearance of occluded metal stent in malignant biliary obstruction:feasibility and early results[Z],2013.
[18]胡冰,吴军,高道键,等.腔内射频消融治疗胆管恶性狭窄的初步研究[J].中华消化内镜杂志,2012,29:487-490.
Percutaneous transhepatic bipolar radiofrequency catheter ablation for the treatm ent of malignant obstructive jaundice:prelim inary experience in 20 cases
CUI Ning,LI Xiao-qun.Interventional Treatment Center,Affiliated Taihe Hospital,HubeiMedical College,Shiyan City,Hubei Province 442000,China
LIXiao-qun,E-mail:xiaoqun_lii@sina.com
ObjectiveTo investigate the feasibility,safety and clinical effect ofpercutaneous transhepatic bipolar radiofrequency catheter ablation in treating malignant obstructive jaundice.MethodsTwentypatients with inoperablemalignant biliary obstruction were enrolled in this study.Of the 20 cases,2 had biliary stent re-occlusion.Percutaneous transhepatic bipolar radiofrequency catheter ablation was carried out in allpatients.The ablationpower was 5-12 W,single ablation time was 60-120 s,the average duration of ablation was 4.66min(1.5-8.5min),and themean effective ablation extentwas 5.76 cm(4-10 cm).After ablation,balloon catheter was inserted to dilate the occluded segment,which was followed by implantation of biliary metal stent.The clinical efficacy,safety and complications were recorded.Resu lts Percutaneous transhepatic bipolar radiofrequency catheter ablation was successfully completed in all the 20patients.Implantation of biliary metal stentwasperformed in 17patients,among them balloon dilatation was employed in 11patients before stent implantation,simple balloon dilatation with no stent implantation was employed in onepatient,and ablation was adopted after biliary stent re-occlusion occurred in twopatients. After the ablation,no complications such as biliary fistula,biliary tract infections,liverpenetrating injuries,peritonitis,etc.occurred.Biliary drainage was successfully completed in allpatients.The median follow-upperiodwas threemonths(0.5-10 months);the stentpatency rate at the end of one and three months was 100%(19/19)and 79%(11/14)respectively.The one-monthand 3-month survival rate was 95%(19/20)and 93%(14/15)respectively.During the follow-upperiod,8 of the 20patients were alive and 12 died.Themedian survival time was 144 days(13-330 days)and the median time of stentpatencywas 60 days(30-210 days).Of the 12 fatalpatients,8 died of cachexiawith multi-system failure although their total bilirubin level was not elevated during the follow-upperiod. Conclusion For the treatment of malignant obstructive jaundice,percutaneous transhepatic bipolar radiofrequency catheter ablation is a newly-developed,safe and feasiblemeans.Clinically,this technique has already achieved some certain effect although its long-term results need to be further evaluated.(J Intervent Radiol,2014,23:693-697)
malignant biliary obstruction;biliary tract;catheter;radiofrequency ablation;stent
R735.7
A
1008-794X(2014)-08-0693-05
2014-02-22)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2014.08.010
442000湖北省十堰市湖北医药学院附属太和医院介入中心(崔宁);广东省中山市人民医院介入治疗室(李晓群)
李晓群E-mail:xiaoqun_lii@sina.com
