肠外营养支持治疗对围化疗期晚期胃肠道肿瘤患者营养状况及免疫功能的影响
2014-06-05李竟长倪秉强蒋志雄陈日新张志红秦佳宁
李竟长,倪秉强,蒋志雄,陈日新,张志红,秦佳宁,朱 州
(广西壮族自治区柳州市人民医院,1.肿瘤内科;2.营养科,广西柳州,545006)
肠外营养支持治疗对围化疗期晚期胃肠道肿瘤患者营养状况及免疫功能的影响
李竟长1,倪秉强1,蒋志雄2,陈日新1,张志红1,秦佳宁1,朱 州1
(广西壮族自治区柳州市人民医院,1.肿瘤内科;2.营养科,广西柳州,545006)
目的探讨肠外营养支持治疗对围化疗期晚期胃肠道肿瘤患者营养状况及免疫功能的影响。方法将90例晚期胃肠道肿瘤患者随机分为对照组和观察组,通过检测2组患者化疗前后的各项营养指标和免疫指标的变化,对2种治疗效果进行对比研究。结果观察组患者化疗前和第1、2疗程后与对照组比各项营养指标和免疫功能指标均无明显变化;第3疗程后各项营养指标和免疫功能指标较对照组均有明显改善,观察组白细胞减少、血小板减少、恶心呕吐、腹泻发生率显著低于对照组;耐受性更好。结论肠外营养支持治疗可改善晚期胃肠道肿瘤化疗患者的营养状况及免疫功能,减轻化疗不良反应,保证围化疗期安全有重要意义。
肠外营养;围化疗期;胃肠道肿瘤
1 资料与方法
1.1 一般资料
选取2011年1月—2013年1月在本科住院治疗的晚期胃肠道恶性肿瘤患者共90例,通过随机方法分为观察组与对照组各45例,观察组中男性26例,女性19例,中位年龄51.5岁,其中胃癌18例,结肠癌15例,直肠癌12例;对照组中男性28例,女性17例,中位年龄53岁,其中胃癌20例,结肠癌12例,直肠癌13例。2组患者的年龄、性别、病种、病理类型、分期比较的均无统计差异(P>0.05)。患者入组标准:有病理和(或)细胞学依据;临床分期为Ⅲ、Ⅳ期;1个月内未行放、化疗等特殊治疗;无肠梗阻,能进全流质或半流质饮食;无明显心、肝、肾功能不全,无高血压、糖尿病史或控制良好,能耐受化疗;卡氏评分>60分;预计生存≥3个月;每例患者至少化疗4个周期。
1.2 营养支持方法
采用30%脂肪乳、复方氨基酸、10%葡萄糖、脂溶性维生素、水溶性维生素、微量元素和各种电解质。观察组根据病史、体征及营养状况,计算能量、热氮的需要量,在给予普通饮食的基础上肠外营养支持治疗,将葡萄糖、氨基酸、脂肪乳、维生素、电解质及微量元素等混合,按照“全合一”3升袋配置方法,在洁净层流无菌室配制,营养液严格按处方配制,能量计算19~26 kcal/(kg·d),氮量计算:0.15~0.20 g/(kg·d)。化疗前3 d开始使用,直至每周期化疗结束后7 d。对照组患者在化疗期间则按普通饮食。
1.3 化疗方案
2组均给予FOLFIRI或FOLFOX6方案化疗,FOLFIRI方案:伊立替康180 mg/m2静脉滴注第1天,甲基四氢叶酸钙400 mg/m2静脉滴注,第1天,5-氟尿嘧啶400 mg/m2静脉注射,第1天,5-氟尿嘧啶2 400~3 000 mg/m2静脉滴注,维持48 h;每2周重复。FOLFOX6方案:奥沙利铂100 mg/m2静脉滴注第1天,甲基四氢叶酸钙400 mg/m2静脉滴注,第1天,5-氟尿嘧啶4 0 0 mg/m2静脉注射,第1天,5-氟尿嘧啶2 400~3 000 mg/m2静脉滴注,维持48 h;每2周重复,至少化疗4周期以上。2组化疗方案的构成具有可比性。化疗期间同时配合止吐、抑酸护胃、护肝、补液等对症支持治疗。
1.4 观察指标
1.4.1 营养指标:2组患者均在化疗前、每周期化疗后第7天分别测体质量、抽血检测血清总白蛋白(TP)、清蛋白(ALB)、前白蛋白(PA)、血红蛋白(Hb)。
1.4.2 免疫指标:每次化疗前、每周期后第7天抽血,采用流式细胞计数仪检测细胞亚群,包括自然杀伤细胞(NK)、CD4、CD8、CD4/CD8;酶联免疫法测定免疫球蛋白(IgG、IgA、IgM)。
1.4.3 不良反应:根据WHO抗癌药急性及亚急性毒性分级标准制定,分为0度(无)、Ⅰ度(轻度)、Ⅱ度(中度)、Ⅲ度(重度)和Ⅳ度(威胁生命)。
表1 2组患者化疗前后营养指标的比较±s)
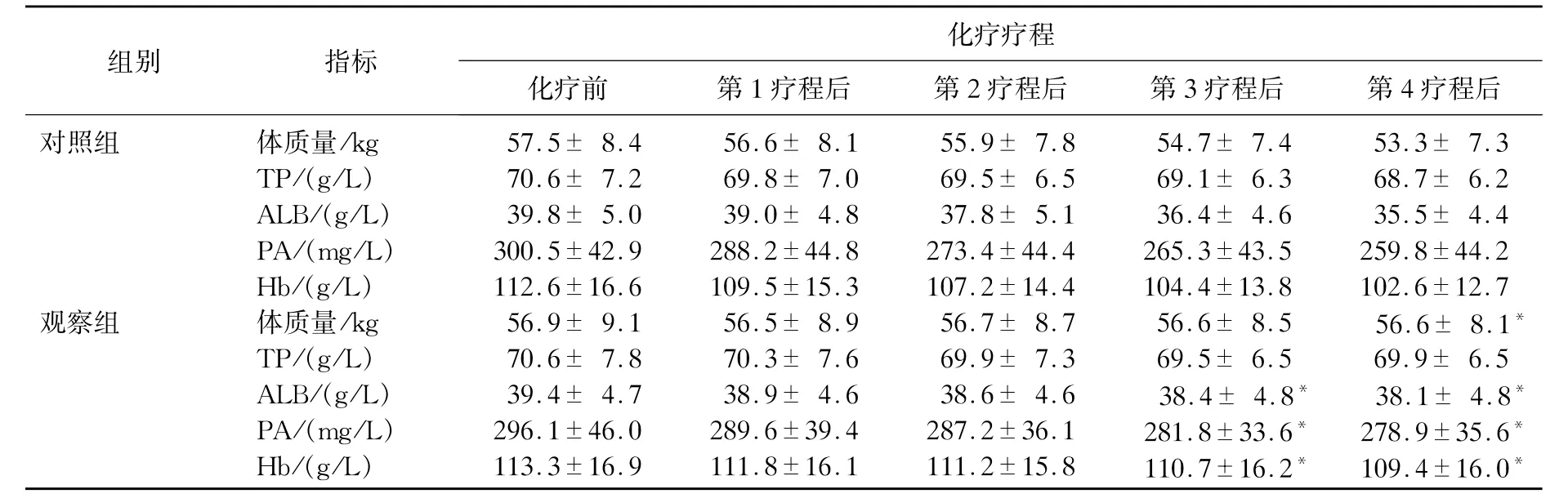
表1 2组患者化疗前后营养指标的比较±s)
与对照组比较,*P<0.05。
组别 指标化疗疗程化疗前 第1疗程后 第2疗程后 第3疗程后 第4疗程后对照组 体质量/kg 57.5±8.4 56.6±8.1 55.9±7.8 54.7±7.4 53.3±7.3 TP/(g/L) 70.6±7.2 69.8±7.0 69.5±6.5 69.1±6.3 68.7±6.2 ALB/(g/L) 39.8±5.0 39.0±4.8 37.8±5.1 36.4±4.6 35.5±4.4 PA/(mg/L) 300.5±42.9 288.2±44.8 273.4±44.4 265.3±43.5 259.8±44.2 Hb/(g/L) 112.6±16.6 109.5±15.3 107.2±14.4 104.4±13.8 102.6±12.7观察组 体质量/kg 56.9±9.1 56.5±8.9 56.7±8.7 56.6±8.5 56.6±8.1*TP/(g/L) 70.6±7.8 70.3±7.6 69.9±7.3 69.5±6.5 69.9±6.5 ALB/(g/L) 39.4±4.7 38.9±4.6 38.6±4.6 38.4±4.8*38.1±4.8*PA/(mg/L) 296.1±46.0 289.6±39.4 287.2±36.1 281.8±33.6*278.9±35.6*Hb/(g/L) 113.3±16.9 111.8±16.1 111.2±15.8 110.7±16.2*109.4±16.0*
2 结果
2.1 2组患者化疗前后各项营养指标的变化
对照组化疗后体质量、TP、ALB、PA、Hb下降均较观察组更为明显,差异有统计学意义(P<0.05),见表1。
2.2 2组患者化疗前后免疫指标的变化
化疗前,2组免疫指标比较无统计学差异,随着化疗进程,2组免疫指标均不同程度的下降,但对照组下降尤为明显,第3周期化疗后2组免疫指标变化更为显著,观察组中CD4、CD4/CD8、NK、IgG、IgM、IgA较对照组明显升高,差异有统计学意义(P<0.05),见表2。

表2 2组患者化疗前后免疫指标的比较
2.3 不良反应
观察组白细胞减少、血小板减少、恶心呕吐、腹泻发生率显著低于对照组(P<0.05);Ⅲ~Ⅳ°不良反应中,对照组白细胞减少症5例,血小板减少2例,恶性、呕吐6例,腹泻2例,均高于观察组。2组的神经毒性、转氨酶升高及静脉炎发生率相近,均无显著性差别。不良反应经对症处理后均可以恢复,不影响治疗,无不良反应相关死亡。见表3。
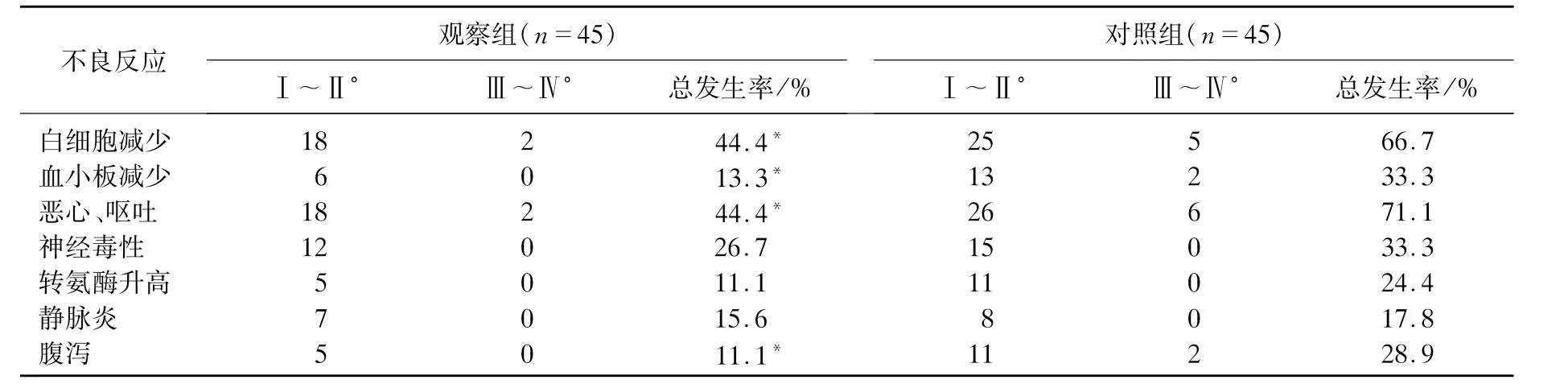
表3 2组患者化疗不良反应的比较
3 讨论
恶性肿瘤往往容易导致营养不良状况发生,大约40%~80%的恶性肿瘤患者存在营养不良[4]。约15%的患者在确诊时6个月内体质量下降超过10%,尤以胃肠道或头颈部肿瘤最为常见[5-7]。胃肠道恶性肿瘤患者营养不良原因主要是在患病后患者食欲的改变,物质和能量代谢紊乱等综合因素引起。化疗是晚期胃肠道肿瘤治疗的重要手段,由于化疗药物的副作用,化疗后患者极易出现食欲减退,恶心呕吐,腹泻等消化系统副作用,造成机体营养状况进一步下降。营养不良对肿瘤患者产生多种负面影响,如导致肿瘤患者住院费用增加,住院时间延长,增加入院次数,并发症发生率和死亡率均较高[8-9]。由于营养不良,血浆蛋白水平下降,导致机体对化疗药物的吸收、分布、代谢及排泄产生障碍,影响化疗药物的药代动力学,使化疗药物的毒性作用进一步增加,机体耐受性下降,抗肿瘤治疗效果也明显影响。有研究[10-11]显示,营养不良和营养良好的患者比较,对化疗的顺应性和响应性明显下降,生存时间亦缩短。营养不良可引起包括胸腺在内的所有淋巴组织的萎缩,细胞免疫机能下降,血清的抗体反应性下降,补体下降和铁传递蛋白减少,炎症应答受损,增加化疗后感染的发生率[12-13]。因此,良好的营养状况是化疗得以顺利进行的重要保证,通过营养支持治疗在肿瘤的综合治疗中必不可少,对于改善患者生活质量、提高治疗疗效、减少或降低不良反应具有积极的意义。
本研究显示,2组患者化疗前各项营养指标和免疫指标均无统计学差异,化疗后出现不同程度下降,观察组由于围化疗期给予肠外营养支持治疗,保证充足热能和蛋白质等营养素,故体质量、白蛋白、前白蛋白、血红蛋白等各项营养指标下降并不明显,而对照组只给予普通膳食,热能和蛋白质等营养素补充不足,故各项营养指标下降的幅度要比观察组大,随着化疗的进程,下降的幅度也越来越大,从第3周期化疗后各项营养指标开始出现统计学差异,说明在晚期胃肠道肿瘤患者围化疗期给予营养支持治疗可改善或维持患者的营养状况。这与国内有关报道[14-15]相似。2组患者化疗后各项免疫指标同样出现不同程度下降,说明化疗除了对癌细胞有杀伤作用以外,对患者的免疫功能也会产生影响,可引起机体免疫功能下降;进一步分析显示,观察组中CD4、CD4/CD8、NK、IgG、IgM、IgA下降缓慢,或短暂下降后再次回升,而对照组中各项免疫指标呈持续下降趋势,表明营养支持治疗可减轻化疗药物对机体免疫功能的损伤和(或)迅速恢复机体受损的免疫功能。不良反应发生率方面,观察组白细胞减少、血小板减少、恶心呕吐、腹泻等总发生率明显低于对照组;Ⅲ~Ⅳ°不良反应中,对照组白细胞减少症5例,血小板减少2例,恶性、呕吐6例,腹泻2例,均高于观察组。
综上所述,晚期胃肠道肿瘤患者在围化疗期给予肠外营养支持治疗,可改善患者的营养状况以及免疫功能,提高其对化疗的耐受性,对保证患者的围化疗期安全性和提高治疗效果也会产生积极作用。
[1]Higashiguchi T.Cancer patient therapy and nutritional support[J].Gan To Kagaku Ryoho,2011,38(8):1235.
[2]Fan B G.Parenteral nutrition prolongs the survival of patients associated with malignant gastrointestinalobstruction[J].JPEN J Parenter Enteral Nutr,2007,31(6):508.
[3]de Graeff A,Vogel J,Jager-Wittenaar H,et al.Malnutrition in patients with cancer[J].Ned Tijdschr Geneeskd,2012,156(38):A4911.
[4]Ollenschlager G,Viell B,Thomas W,et al.Tumour anorexia:causes assessment,treatment[J].Recent Results Cancer Res,1991,121:249.
[5]Bozzetti F,Mariani L,Lo Vullo S,et al.The nutritional risk in oncology:a study of 1,453 cancer outpatients[J]. Support Care Cancer,2012,20(8):1919.
[6]Muscaritoli M,Molfino A,Laviano A,et al.Parenteral nutrition in advanced cancer patients[J].Crit Rev Oncol Hematol,2012,84(1):26.
[7]Zang YS,Fang Z,Li B.Erlotinib plus parenteral nutrition:an opportunity to get through the hardest days of advancednon-small cell lung cancer with cancer anorexia-cachexia syndrome[J].Am J Hosp Palliat Care,2013,30(2):210.
[8]Gupta D,Vashi PG,Lammersfeld C A,et al.Roleof nutritional status in Predicting the length of stay in cancer:a systematic review of the epidemiological literature[J].Ann Nutr Metab,2011,59(2-4):96.
[9]Soo I,Gramlich L.Use of parenteral nutrition in patients with advanced cancer[J].Appl Physiol Nutr Metab,2008,33(1):102.
[10]Montoya J E,DomingoF Jr,Luna CA,et al.Nutritional status of cancer Patients admitted for chemotherapy at the National Kidney and Transplant Institute[J].Singapore Med J,2010,51(11):860.
[11]Maruyama M,Nagahama T,Sugano N,et al.Loco-regional chemotherapy at the outpatient clinic for gastric cancer patients with homeenteral nutrition[J].Gan To Kagaku Ryoho,2011,38(12):2366.
[12]Faber J,Vos P,Kegler D,et al.Beneficial immune modulatory effects of a specific nutritional combination in a murine model for cancer cachexia[J].Br JCancer,2008,99(12):2029.
[13]Hasenberg T,Essenbreis M,Herold A,et al.Early supplementation of parenteral nutrition is capableof improving quality of life,chemotherapy-related toxicity and body composition in patients with advanced colorectal carcinoma undergoing palliative treatment:results from a prospective,randomized clinical trial[J].Colorectal Dis,2010,12(10 Online):e190.
[14] 钟海均,应杰儿,马胜林.肿瘤专用型肠内营养乳剂对胃癌患者营养状况和免疫功能的影响[J].中华胃肠外科杂志,2006,9(5):405.
[15] 汪建军.肠内营养对结直肠癌患者围术期临床指标的影响[J].浙江中西医结合杂志,2013,(9):720.
Influence of parenteral nutrition supportive therapy on the nutritional status and immune function in patients with advanced gastrointestinal tumor in peri-chemotherapy period
LI Jingzhang1,NI Bingqiang1,JIANG Zhixiong2,CHEN Rixin1,ZHANG Zhihong1,QIN Jianing1,ZHU Zhou1
(1.Department of Oncology;2.Department of Nutrition,Liuzhou People′s Hospital,Liuzhou,Guangxi,545006)
ObjectiveTo explore the influence of parenteral nutrition(PN)supportive therapy on the nutritional status and immune function in patients with advanced gastrointestinal tumor in peri-chemotherapy period.Methods90 patients with advanced gastrointestinal tumor were randomly divided into control group and observation group.Efficacy was compared between two groups by detecting the changes of various nutritional and immune indexes before and after chemotherapy.ResultsThere were no significant differences of the nutritional and immune function indexes between two groups before chemotherapy and after the first-second cycle of chemotherapy.All nutritional and immune function indexes after the third cycle of chemotherapy in the observation group were significantly better than those in the control group.The incidence rate of complications such as leucopenia,thrombocytopenia,nausea,vomiting and diarrhea in the observation group was significantly lower than the control group.ConclusionPN supportive therapy can not only ameliorate the nutritional status and immune function of patients with advanced gastrointestinal tumor,but also alleviate the chemotherapy-induced adverse reactions,so it is very important for safety in peri-chemotherapy period.
parenteral nutrition;peri-chemotherapy period;gastrointestinal tumor化疗是晚期胃肠道恶性肿瘤多学科综合治疗中的一个重要手段,而胃肠道恶性肿瘤患者多数合并营养不良,化疗常会引起恶心、呕吐等不良反应,造成患者营养状况进一步恶化,化疗耐受性下降,甚至影响治疗效果。因此,合理有效地提供营养支持治疗对于该类患者而言具有非常积极的意义[1-3]。本研究对围化疗期晚期胃肠道肿瘤患者配合肠外营养支持治疗取得良好效果,现报告如下。
R 735.2
A
1672-2353(2014)05-020-04
10.7619/jcmp.201405007
2013-12-07
中国高校医学期刊临床专项资金(11321706)
倪秉强,Email:nbq181@gmail.com
