冻结过程中肾细胞体积变化的实验研究与数值计算
2014-06-05王雅博张于峰王艳娇
王雅博,诸 凯,,3,张于峰,安 娜,王艳娇
冻结过程中肾细胞体积变化的实验研究与数值计算
王雅博1,诸 凯1,2,3,张于峰1,安 娜2,王艳娇2
(1. 天津大学环境科学与工程学院,天津300072;2. 天津商业大学天津市制冷技术重点实验室,天津 300134;3. 天津大学中低温热能高效利用教育部重点实验室,天津 300072)
以肾细胞为研究对象,采用低温显微系统研究了不同降温速率时细胞的脱水传质过程,观察了冻结过程中细胞体积的变化;同时,采用差示扫描量热仪(DSC)测定了肾细胞冻结过程中的放热量,通过理论模型计算出细胞冻结过程中的体积变化.由低温显微镜直接观察和DSC方法获得了相似的细胞体积和体积变化趋势.最后,针对不同的降温速率,根据细胞水分渗透模型计算出细胞膜水分的渗透系数和表观渗透活化能.这些参数的获得为优化细胞的保存条件提供了理论依据.
肾细胞;低温保存;细胞水分渗透;差示扫描量热仪
对生物组织而言,胞内水的质量大约占细胞总质量的80%.在常温下细胞与周围的溶液处于平衡状态,细胞内、外的温度和浓度相同.在冷却过程中,细胞外的溶液先被冷却到溶液的凝固点以下,当降温速率较慢时,由于胞外冰晶的形成导致细胞外溶液浓度增加,形成高渗透压,促使细胞内水分不断通过细胞膜外流,细胞不断脱水、皱缩[1].另一方面,快速降温将形成胞内冰,胞内冰的产生对细胞是致命的.为了获得最优的细胞存活率,细胞降温过程要避免慢速降温引起的“溶液效应”及快速降温产生的“胞内冰”.胞外冰产生后,细胞内存留的水分是决定细胞保存成功与否的重要因素.为了深入理解细胞低温保存过程,需要在冻结过程中测定细胞膜对水分的渗透特性[2].细胞膜对水分的渗透特性可以通过细胞体积随外界环境(渗透压)的变化来反映[3].
目前有两种方法用于研究细胞冻结过程中的体积变化:低温显微观察和差式扫描量热仪(differential scanning calorimetry,DSC).Acharya等[4]利用低温显微镜研究了Jurkat细胞和Hela细胞在不同降温速率下的体积变化规律,并计算出相对温度(0,℃)下,细胞膜对水分的渗透系数和表观活化能.Choi等[5]根据低温显微镜观察获得的细胞体积,计算了冻结过程中人真皮纤维细胞悬浮和贴壁状态下的动力学参数. Devireddy等[6]采用低温显微镜和DSC测量并计算了淋巴细胞在不同降温条件下的细胞体积变化及动力学参数. DSC还可用于计算不规则形状细胞冻结过程中的体积变化规律[7-8].Mori等[9]联合使用低温显微镜和DSC研究了细胞悬液冻结过程中的水分运输和胞内冰形成机理.
笔者采用低温显微系统观察并获得了肾细胞冻结过程中的体积变化.使用DSC测定了肾细胞悬液慢速冷冻过程中的放热量,并通过理论模型计算得到细胞冻结过程中的细胞体积变化.根据细胞体积随外界环境的变化,计算细胞在冻结过程中,细胞膜渗透系数和水分透过细胞膜的表观渗透活化能[10].
1 实 验
1.1 肾活细胞悬液的制备
将BALB/C(巴比赛)鼠脱臼处死,取出肾脏剪碎,用0.074,mm(200目)尼龙网研磨.然后用生理盐水缓慢冲洗,收集细胞悬液,台盼蓝染色活细胞数在80%以上[11].
1.2 差示扫描量热仪
采用TA-Q1000型差示扫描量热仪记录样品冻结过程中的热流曲线.使用前,用高纯铟对仪器进行温度校准得到炉子常数为1.19.实验扫描温度范围为25~-60,℃.
1.3 低温显微系统
低温显微系统包括光学显微镜和BCS-196冷热台及其温度控制系统.显微镜装有CCD,图像经计算机上的图像采集卡转换后予以存储.冷热台可实现-196~125,℃内升降温速率的精确控温,精度为0.01,℃.
在进行显微观察时,样品的准备尤其重要.为了获得单层细胞,笔者采用的方法是:将一片载玻片置于另一片石英载玻片之上,利用液体的表面张力将细胞悬液吸入至两载玻片之间.由此得到的试样是体现单层(monolayer)细胞的细胞悬液,有利于观察细胞体积的变化,并且可以防止观察过程中细胞悬液的蒸发和泄漏.
2 结果与分析
2.1 低温显微镜的动态观察
以不同降温速率(5,℃/min,10,℃/min,20,℃/ min)降温至-35,℃,采用低温显微镜观察细胞的脱水传质变化过程.为了消除时间因素的影响,降温至-35,℃后恒温30,min.由于胞内冰对细胞的破坏较大,所以有些细胞在冻结过程中逐渐在视野中“消失”,因此只选择在冻结过程中保持细胞完整形状的细胞进行分析.图1给出了以5,℃/min的速率降温时,胞外冰产生过程中细胞体积的直观变化.使用Image-Pro软件测量细胞的投影面积.每次选取3个细胞,测量3次,求平均值.在计算过程中,将细胞认为是理想球体,低温显微镜得到的投影面积与细胞体积两者存在如下关系:
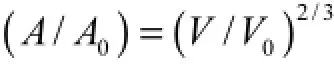
由低温显微观察发现(见图1),随着温度的下降,溶液中会突然出现分散的冰晶,继而冰晶呈树枝状生长.这一过程体现为胞外冰的形成.胞外冰形成初期对细胞外形没有明显的影响.随着胞外冰晶的增多,细胞外浓度增大,细胞内水分通过细胞膜流出细胞,细胞皱缩;并且由于胞外冰的挤压,部分细胞扭转变形.图2为以不同速率降温时,细胞体积随温度变化的曲线.随着温度的降低,细胞体积逐渐减小.当温度降至-25,℃后,无论以何种降温速率降温,细胞体积都不再产生明显变化;并且在恒温阶段,细胞体积也不再发生改变.这是由于以5,℃/min或10,℃/min降温时,细胞逐渐接近其非渗透平衡体积.在5,℃/min降温工况时,细胞的最小体积为0.26V0;10,℃/min时,细胞的最小体积为0.25V0.而快速降温(20,℃/min)时,一部分来不及渗出的水分在细胞内冻结形成冰晶. 在20,℃/min降温工况时,细胞的最小体积为0.34V0.
将细胞看作理想球体并根据投影面积计算出的细胞体积与实际细胞体积之间存在一定的误差.这是因为在进行细胞显微观察时,只能观察并记录细胞在二维平面的投影,不能直接获得三维体积.虽然未冻结的细胞基本呈圆形,但在冻结过程中由于胞外冰的挤压作用及细胞内外渗透压差,细胞形状发生变化.虽然将细胞假设为理想球体进行计算存在一定的误差,但是由于细胞体积非常小,国内外的研究普遍采用这一假设[4,6,9].

图1 5,℃/min降温时胞外冰产生过程中细胞体积变化Fig.1 Volume change of renal cells during extracellular ice freezing at different temperatures(5,/min℃)

图2 细胞体积随温度变化的显微观察结果Fig.2 Volumetric response of renal cells as a function of temperature from cryomicroscope
2.2 DSC测定
2.2.1 DSC测定细胞体积的理论模型
根据Devireddy等[6]提出的测定细胞水分渗透特性的DSC方法,在细胞悬液的冻结过程中,细胞体积随温度的变化与DSC测得的热流数据之间有如下关系[6-7]:

整理后可得
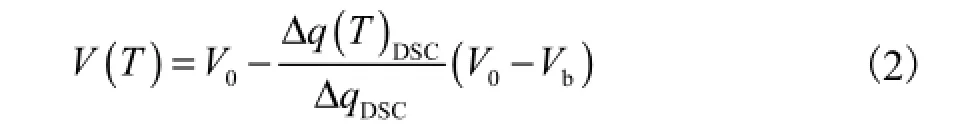
式中:ΔqDSC为分别冻结活细胞(具有渗透活性的细胞)和死细胞(失去渗透活性的细胞)过程中,释放的总热流量的差值;Δq(T)DSC为分别冻结活细胞和死细胞至某一温度T时,释放的热流差值;V0为初始细胞体积;Vb为细胞的非渗透平衡体积.
2.2.2 DSC实验结果
图3为活细胞(具有渗透活性的细胞)和死细胞(失去渗透活性的细胞)在冻结过程中释放的总热流量曲线.从图3中可以看出,冻结过程中活细胞释放的总热量要高于死细胞.活细胞在慢速冷却过程中,由于胞外冰形成,细胞外溶液浓度增加,形成高渗透压,使细胞内的自由水外流.自由水冻结过程释放的热量为αβΔHf,其中:α为细胞的体积分数;β 为细胞内自由水的体积分数,β=1-Vb/V0;ΔHf为水的相变潜热.
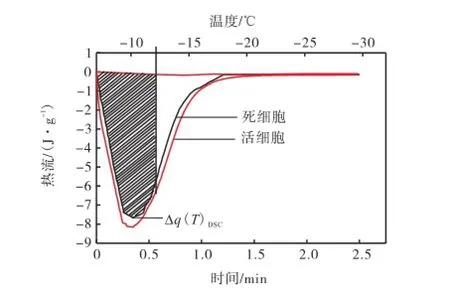
图3 冻结活细胞和死细胞过程中释放的总热流量曲线Fig.3 Total heat release during freezing of live and dead cells
同一样品经快速冷却(一般快速降温速率达200,℃/min)后,基本上所有细胞都经历胞内冰而死亡.由于胞内冰破坏了细胞膜结构,细胞质、细胞膜碎片与基质溶为一体,因此原来细胞内的自由水可以看作是与细胞悬液具有相同浓度的溶液.这部分自由水在冻结过程中释放的潜热为αβΔHec,其中ΔHec为等渗溶液的相变潜热.由于纯水的相变潜热高于等渗溶液(生理盐水)的相变潜热,因此,αβΔHf≥αβΔHec,且两者的差值就可作为计算细胞体积的依据.根据冻结过程的放热量,通过式(1)计算出细胞无量纲体积.
将低温显微测量结果与DSC方法计算的细胞体积进行比较可以看出,计算结果能够真实反映细胞在冻结过程中的体积变化规律,如图4所示.通过对3种降温速率获得的细胞体积变化规律进行比较可知,降温至某一温度时,降温速率越快,细胞脱水越不充分,细胞体积越大.同时,根据图4可知,计算值与实验值存在一定的误差,并且这一误差随着降温速率的增大而增大.以5,℃/min降温时,计算结果的平均误差为2.3%,最大误差为4.8%;而以20,℃/min降温时,计算结果的平均误差增大至2.5%,最大误差增大至8.0%.这是由于在低温显微实验中,只选择能够保持细胞完整形状的活细胞分析其脱水过程.但DSC反映的是大量细胞的平均反应.众所周知,快速降温将导致胞内冰的产生,因此在快速降温(大于5,℃/min)时,DSC测量的活细胞降温热流曲线是胞外冰和胞内冰形成放热曲线的叠加.低温显微实验也显示:当降温速率小于等于5,℃/min时,肾细胞在冻结过程中几乎没有胞内冰出现;当降温速率大于5,℃/ min时,在-7~-25,℃这一温度范围内,胞内冰逐步出现.Mori等[9]及Seki等[12]的研究也证实了这一结论.因此对于肾细胞,在利用DSC测量细胞体积变化时,降温速率应小于5,℃/min,以避免胞内冰的影响.
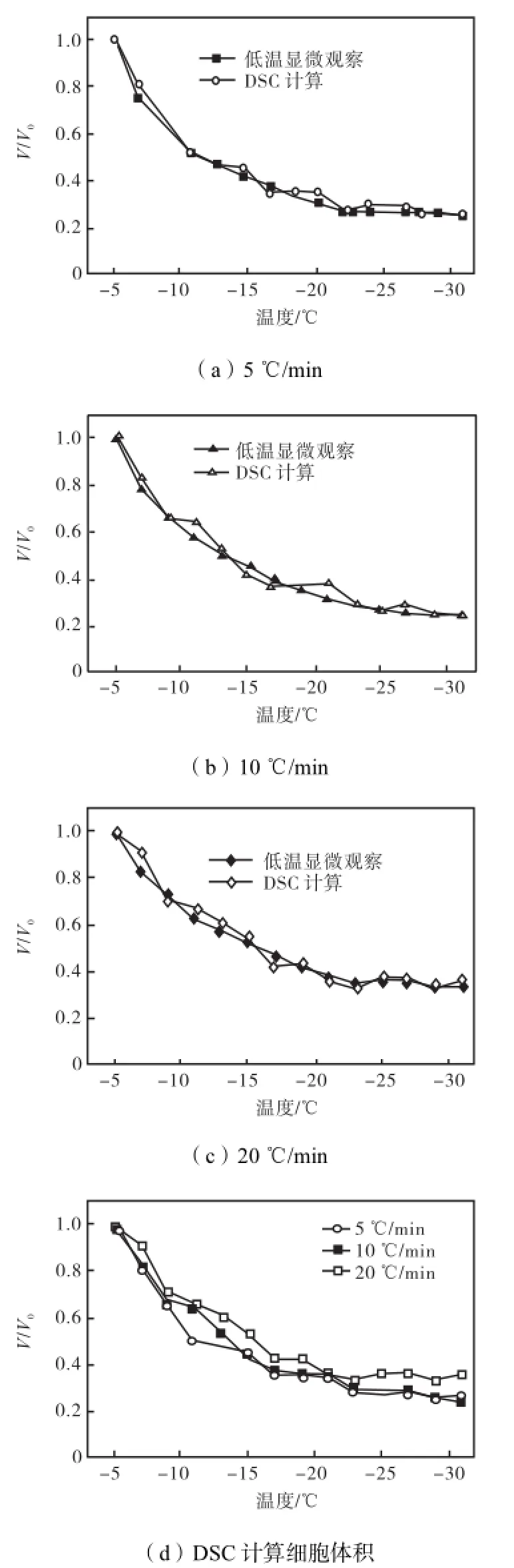
图4 DSC计算的细胞体积与低温显微细胞体积的比较Fig.4Comparison of volumetric response of renal cells between cryomicroscopy and DSC
2.3 细胞膜水分渗透参数
2.3.1 细胞膜水分渗透模型
Mazur[1]根据热力平衡原理提出了冻结过程中单个悬浮细胞体积变化情况的数学模型,具体描述如下:

其中

式中:V为某一温度下的细胞体积,将细胞看作为理想的球体;T为绝对温度;Lp为细胞膜的水分渗透系数;Lpg为TR=273.15K 时细胞膜的水分渗透系数;ELp为表观渗透活化能;R为气体常数;B为降温速率;Ac为渗透过程中的有效膜面积,Ac=4πr02;vw为水的偏摩尔体积;ns为细胞内的溶质的物质的量;φs为氯化钠的分解常数,φs=2.
2.3.2 细胞膜水分渗透参数的确定
采用龙格-库塔格式对方程(3)离散,根据由低温显微镜观察的细胞体积变化数据,求出不同温度下细胞膜水分渗透系数Lp[13].应用MATLAB中的lsqnonlin函数对方程进行非线性回归的最小二乘优化[2].计算结果如表1所示.
由表1可以看出,降温速率很大程度上影响细胞膜对水分的渗透特性.细胞膜的水分渗透系数是反映水分通过细胞膜难易程度的参数.随降温速率的增加,相对温度(TR=273.15,K)下,细胞膜水分渗透系数(Lpg)不断减小,这是由于较慢的降温速率使细胞内的水分有更多的时间渗出,与细胞外液达到化学势平衡.表观渗透活化能是决定渗透反应速率的另一个重要因素,是指增大细胞膜上高分子链间的距离,使细胞内水分子通过细胞膜流至细胞外所需的能量[14].通过计算结果可知,肾细胞膜表观渗透活化能随降温速率的增加而减小,说明快速降温时,水分流失所需的活化能较小.
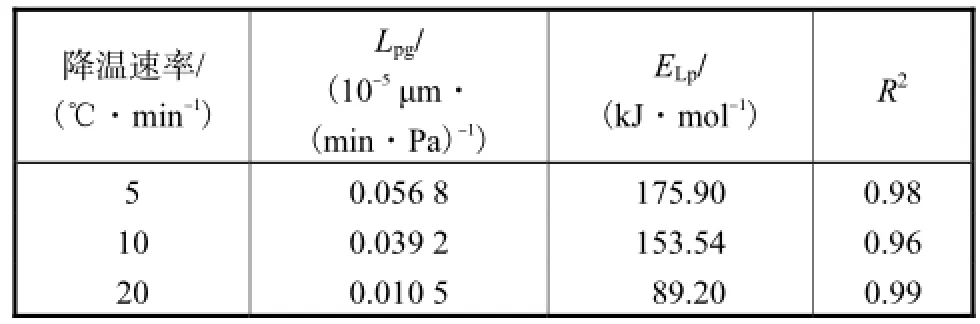
表1 肾细胞水分流失参数Tab.1 Water transport parameters of renal cell
3 结 论
(1) 分别采用DSC和低温显微系统获得了胞外冰存在条件下的肾细胞体积.通过这两种方法获得的细胞体积,无论体积本身还是变化趋势都非常相似.降温初期细胞体积变化明显,随着温度的下降,细胞内外渗透压逐渐平衡,细胞体积变化减慢直至稳定.同一温度下,降温速率越快,细胞脱水越不充分,细胞体积越大.对于肾细胞,DSC方法只能比较精确地反映慢速降温(≤5,℃/min)时的细胞体积变化,快速降温(>5,℃/min)时由于胞内冰的出现使活细胞冻结曲线发生波动影响计算的精确性.
(2) 计算了胞外冰存在条件下细胞膜水渗透参数.通过计算可知在相同的温度时,渗透系数随降温速率的增加而降低,表明较慢的降温速率有利于细胞的脱水.同时,表观渗透活化能同样随降温速率的增加而降低.细胞体积变化和动力学参数的获得,对确定最优的降温速率,具有极强的指导意义.
[1] Mazur P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing[J]. The Journal of General Physiology,1963,47:347-369.
[2] Bryant G. DSC measurement of cell suspensions during successive freezing runs:Implications for the mechanisms of intracellular ice formation[J]. Cryobiology,1995,32(2):114-128.
[3] 王 欣,程启康,高 才,等. 降温过程中组织工程用真皮成纤维细胞膜水分渗透特性的实验研究[J]. 中国科学E辑,2005,35(9):946-953.
Wang Xin,Cheng Qikang,Gao Cai,et al. Experiment study of water transport characteristic of dermal fibroblast cell membrane during freezing[J]. Science in China Series E,2005,35(9):946-953(in Chinese).
[4] Acharya T,Devireddy R V. Cryomicroscopic investigations of freezing processes in cell suspensions[J]. The Open Biotechnology Journal,2010,4:26-35.
[5] Choi J,Bischof J C. Cooling rate dependent biophysical and viability response shift with attachment state in human dermal fibroblast cells[J]. Cryobiology,2011,63(3):285-291.
[6] Devireddy R V,Raha D,Bischof J C. Measurement of water transport during freezing in cell suspensions usinga differential scanning calorimeter[J]. Cryobiology,1998,36(2):124-155.
[7] Thirumala S,Huang Changjiang,Dong Qiaoxiang,et al. A theoretically estimated optimal cooling rate for the cryopreservation of sperm cells from a live-bearing fish,the green swordtail Xiphophorus helleri[J]. Theriogenology,2005,63(9):2395-2415.
[8] Devireddy R V,Swanlund D J,Roberts K P,et al. Subzero water permeability parameters of mouse spermatozoa in the presence of extracellular ice and cryoprotective agents[J]. Biology of Reproduction,1999,61(3):764-775.
[9] Mori Shoji,Choi Jeunghwan,Devireddy R V,et al. Calorimetric measurement of water transport and intracellular ice formation during freezing in cell suspensions[J]. Cryobiology,2012,65(3):242-255.
[10] Kleinhans F W,Mazur P. Determination of the water permeability(Lp)of mouse oocytes at -25,℃ and its activation energy at subzero temperatures[J]. Cryobiology,2009,58(2):215-224.
[11] 彭 宇,郑清莲,李信民,等,胎肾细胞悬液对卵巢大鼠自由基的影响[J]. 中国中西医结合杂志,2010, 30(4):416-418.
Peng Yu,Zheng Qinglian,Li Xinmin,et al. Effects of fetal renal cell suspension on free radicals in ovariectomized rats[J]. Chinese Journal of Integrated Traditional and Western Medicine,2010,30(4):416-418(in Chinese).
[12] Seki S,Kleinhans F W,Mazur P. Intracellular ice formation in yeast cells vs. cooling rate:Predictions from modeling vs. experimental observations by differential scanning calorimetry[J]. Cryobiology,2009,58(2):157-165.
[13] Balasubramanian S K,Bischof J C,Hubel A. Water transport and IIF parameters for a connective tissue equivalent[J]. Cryobiology,2006,52(1):62-63.
[14] 陈立装,高延敏,邹 俊,等. 温度变化对含硬脂酸包覆滑石粉环氧涂层渗水率的影响[J]. 腐蚀科学与防护技术,2006,18(5):367-369.
Chen Lizhuang,Gao Yanmin,Zou Jun,et al. Effect of temperature on permeability of water vapor through epoxy coating with talcum powder coated by stearic acid [J]. Corrosion Science and Protection Technology,2006,18(5):367-369(in Chinese).
(责任编辑:田 军)
Experimental Study and Numerical Calculation of Volume Change of Renal Cell During Freezing
Wang Yabo1,Zhu Kai1,2,3,Zhang Yufeng1,An Na2,Wang Yanjiao2
(1. School of Environmental Science and Engineering,Tianjin University,Tianjin 300072,China;2. Tianjin Key Laboratory of Refrigeration Technology,Tianjin University of Commerce,Tianjin 300134,China;3. Key Laboratory of Efficient Utilization of Low and Medium Grade Energy,Tianjin University,Tianjin 300072,China)
The renal cell was treated as the object forstudy. The cryomicroscopy was used to study the mass transfer process and the volume change of cells at different cooling rate. Meanwhile, the heat release during cooling was assessed by differential scanning calorimetry (DSC), and the volume change was calculated by the theoretic model. The data obtained from cryomicroscopy and DSC are in good agreement in terms of cell volume and changing trends. The membrane permeability and the activation energy were calculated according to cell volume data obtained by cryomicroscopy. These parameters can provide theoretical basis for the optimization of cell preservation conditions.
renal cell;cryopreservation;water transport;differential scanning calorimetry (DSC)
Q65
A
0493-2137(2014)02-0149-06
10.11784/tdxbz201205023
2012-05-08;
2012-10-26.
国家自然科学基金资助项目(51076117).
王雅博(1984— ),女,博士研究生,wang_yabo@tju.edu.cn.
诸 凯,zhukai210@tju.edu.cn.
