鞣花酸对骨髓瘤SP2/0细胞的作用
2014-05-15赵宁黄永吉马广斌严冬雪
赵宁,黄永吉,马广斌,严冬雪
(桂林医学院附属医院脊柱骨病外科,桂林 541000)
·血液系统疾病用药专栏·
鞣花酸对骨髓瘤SP2/0细胞的作用
赵宁,黄永吉,马广斌,严冬雪
(桂林医学院附属医院脊柱骨病外科,桂林 541000)
目的 探讨五倍子提取物鞣花酸抗骨髓瘤的生物学活性及相关机制。方法20,40和60 μg·mL-1鞣花酸体外孵育骨髓瘤SP2/0细胞株,采用细胞形态学、细胞增殖实验和流式细胞仪检测鞣花酸对SP2/0细胞株增殖、凋亡和细胞周期的影响,通过Western blotting技术检测肿瘤细胞增殖与凋亡相关基因COX-2的表达。结果20,40, 60 μg·mL-1鞣花酸孵育骨髓瘤SP2/0细胞株48 h后,细胞周期阻滞于G1期,G1期细胞百分率分别为(55.21±3.01)%, (64.48±0.43)%,(75.10±2.46)%,与对照组(34.04±1.74)%比较,差异有统计学意义(P<0.01)。20,40和60 μg·mL-1鞣花酸细胞抑制率分别为(21.18±5.92)%,(44.58±3.43)%和(70.15±2.90)%,与对照组比较,差异有统计学意义(P<0.01)。细胞早期凋亡率分别为(9.60±0.56)%,(19.30±1.51)%和(35.10±5.26)%,与对照组(3.23± 0.85)%比较,差异有统计学意义(P<0.01),随药物浓度的增加COX-2的表达逐渐下降。结论鞣花酸能够抑制骨髓瘤SP2/0细胞增殖,促进其凋亡。
鞣花酸;骨髓瘤;SP2/0细胞;增殖;凋亡
多发性骨髓瘤(multiple myeloma,MM)好发于中老年人,其发病率有明显的地域性差异,近几年欧美国家发病率每10万人约为4例,约为我国的4倍[1]。多发性骨髓瘤患者多数以腰骶部及胸部疼痛为首发症状,误诊率及死亡率较高,目前其病因以及发病机制尚未清楚,治疗效果欠佳[2]。因此,寻找有效的抗骨髓瘤药物与防治方法已是骨髓瘤研究的重要课题[3]。鞣花酸是一种天然多酚,存在于五倍子等多种中草药和水果中,它是多环芳烃诱变作用的拮抗剂,也是肿瘤的抑制剂,其抗氧化、抗突变和抗癌的活性已初步得到证实,鞣花酸是潜在的抗肿瘤药物[4-6]。目前,五倍子提取物鞣花酸抗骨髓瘤的研究笔者尚未见报道。本研究通过对鞣花酸抗骨髓瘤生物学活性的研究,为临床应用鞣花酸防治骨髓瘤提供实验依据。
1 材料与方法
1.1 材料 骨髓瘤细胞株SP2/0由桂林医学院科学实验中心提供,鞣花酸粉(批号:10148850)由Alfa公司提供,四甲基偶氮唑盐[3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-diphenytetrazoliumromide,MTT]、二甲亚砜(dimethyl sulfoxide,DMSO)、碘化丙啶(propidiumiodide,PI)为美国Sigma公司产品,RPMI-1640、小牛血清为美国Gibco公司产品,兔抗人COX-2抗体由Bioworld公司提供,Hoechst33258、ECL发光液、β-actin抗体、辣根过氧化物酶(horseradish peroxidase,HRP)、山羊抗兔IgG二抗和辣根过氧化物酶山羊抗小鼠IgG二抗由北京中杉金桥生物技术有限公司提供。
1.2 细胞培养 骨髓瘤SP2/0细胞株培养于10%小牛血清RPMI-1640培养液中,每毫升含青霉素80 U及链霉素100 U,置37℃、5%二氧化碳(CO2)的饱和湿度培养箱中培养。
1.3 药物配备 称取鞣花酸粉50 mg,连同称量纸置于无菌超净操作台上,在紫外灯下照射1 h后,倒入高压灭菌过的玻璃瓶中,加入DMSO 10 mL,震荡、摇匀,使鞣花酸充分溶解,经过内径0.22 μm微孔过滤器过滤,然后将DMSO溶液配制的5 μg·mL-1鞣花酸溶液分装于2 mL EP管中,在4℃下保存。
1.4 细胞形态学检测 SP2/0细胞接种于6孔板,接种密度为每孔1×106个,每孔培养液2.0 mL。观察组分别加入终浓度为20,40和60 μg·mL-1鞣花酸,对照组不加鞣花酸孵育,每组设3个复孔,培养48 h后,置倒置显微镜下观察细胞的生长状况并摄像。去培养液后,每孔加入4%多聚甲醛0.5~1.0 mL,室温下固定10 min。去固定液,磷酸盐缓冲液(phosphate buffered solution,PBS)洗2次,每孔加入适量Hoechst33258染料,染色10 min。PBS洗2次后,加一滴抗荧光淬灭封片液,然后对细胞进行封片。制作好的细胞染色片置荧光显微镜下观察凋亡细胞并摄像。
1.5 细胞增殖抑制率检测 细胞密度为1× 105个·mL-1的对数生长期单细胞悬液接种于96孔板,每孔0.2 mL,培养过夜后,观察组细胞加入鞣花酸至终浓度分别为20,40和60 μg·mL-1,对照组加入等量药物溶剂,每组设4个复孔,孵育48 h后,每孔加入5 μg·mL-1MTT 20 μL,孵育4 h。去上清液,每孔加入DMSO 200 μL,振荡器上轻轻振荡5~10 min,使结晶完全溶解,置波长490 nm酶标仪上测定吸光度(A)值。计算细胞增殖抑制率,细胞增殖抑制率(%)= (对照组A值-观察组A值)/(对照组A值-空白对照组A值)×100%。
1.6 细胞早期凋亡检测 取对数生长期骨髓SP2/0细胞,观察组加入鞣花酸至终浓度分别20,40, 60 μg·mL-1,孵育培养24 h后,PBS洗涤1次,收集细胞,分别加入1×Binding Buffer 100 μL,悬浮细胞,加入Annexin V 3 μL和PI 3 μL,室温避光1 h,再加入1 ×Binding Buffer100 μL,流式细胞仪测细胞早期凋亡。
1.7 细胞周期检测 对数生长期的骨髓瘤SP2/0细胞接种100 μL培养瓶中,培养过夜,观察组加入鞣花酸至终浓度分别20,40,60 μg·mL-1,孵育培养48 h后,PBS洗涤2次,收集细胞,转入离心管,2 325×g离心10 min,PBS洗涤2次后,加入预冷70%乙醇(无水乙醇+PBS配制)4℃固定过夜。调整细胞浓度至106个·mL-1,取悬液1 mL,2 325×g离心10 min,PBS洗涤2次;弃上清液,加入RNase A 20 μL,37℃水浴30 min,加入终浓度为50 μg·mL-1PI染液1 mL悬浮细胞,4℃避光30 min,流式细胞仪检测细胞周期。
1.8 Western blotting技术检测相关基因的表达 收集不同药物浓度处理48 h的SP2/0细胞,分别加入蛋白裂解液后置碎冰上15 min,超声波处理,4℃下22 065×g离心30 min;分离上清液,采用BCA法测定上清液总蛋白浓度;取上清液总蛋白50 μg与上样缓冲液混合,置沸水浴10 min,上样后进行电泳;采用湿转法将蛋白转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉(TBST配置)封闭1 h,加入一抗(1∶500),30℃摇荡2 h,TBST洗膜3次,加入HRP标记的二抗,30℃,摇荡2 h,TBST洗膜3次;采用电致化学发光(electrochemiluminescence, ECL)液进行发光,压片、显影、定影。
1.9 统计学方法 实验数据应用SPSS17.0版统计软件分析。计量资料以均数±标准差(±s)表示。多组资料比较采用完全随机的单因素(One-Way ANOVA)方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 鞣花酸对SP2/0细胞形态的影响 20,40和60 μg·mL-1鞣花酸孵育SP2/0细胞48 h后,细胞增殖均受抑制,形态也发生改变:对照组贴壁细胞多,细胞大小均匀,轮廓清楚,细胞间接触紧密;鞣花酸孵育组,随药物浓度增加,贴壁细胞逐渐减少,细胞变圆,漂浮的死亡细胞增多(图1)。Hoechst33258染色显示,对照组细胞核染色均匀,鞣花酸孵育组细胞核强染色、核固缩细胞比例随鞣花酸的浓度增加而升高,细胞核或细胞质内出现致密浓染的颗粒状或条块状荧光染色(图2)。
2.2 鞣花酸对SP2/0细胞增殖的影响 终浓度为20,40和60 μg·mL-1鞣花酸孵育骨髓瘤SP2/0细胞48 h,细胞增殖均受抑制,抑制率分别为(21.18± 5.92)%,(44.58±3.43)%和(70.15±2.90)%,与对照组比较,差异有统计学意义(P<0.01)。随药物浓度的升高,细胞的抑制率增加。
2.3 鞣花酸对SP2/0细胞早期凋亡影响 终浓度为20,40和60 μg·mL-1鞣花酸孵育骨髓瘤SP2/0细胞24 h,细胞早期凋亡率分别为(9.60±0.56)%, (19.30±1.51)%和(35.10±5.26)%,与对照组(3.23±0.85)%比较,差异有统计学意义(P<0.01)。Q4象限早期凋亡细胞随药物浓度增加而增多。见图3。
2.4 鞣花酸对SP2/0细胞周期的影响 终浓度为20, 40和60 μg·mL-1鞣花酸孵育骨髓瘤SP2/0细胞48 h,细胞阻滞于G1期,随药物浓度的增高G1期细胞百分率也逐渐增加,分别为(55.21±3.01)%,(64.48±0.43)%, (75.10±2.46)%,与对照组的(34.04±1.74)%比较,差异有统计学意义(P<0.01)。见图4。

A.对照组;B.20 μg·mL-1鞣花酸组;C.40 μg·mL-1鞣花酸组;D.60 μg·mL-1鞣花酸组图1 显微镜观察细胞生长形态(×200)A.control group;B.20 μg·mL-1ellagic acid group;C.40 μg·mL-1ellagic acid group;D.60 μg·mL-1ellagic acid groupFig.1 Cell morphology detected by microscopic examination(×200)
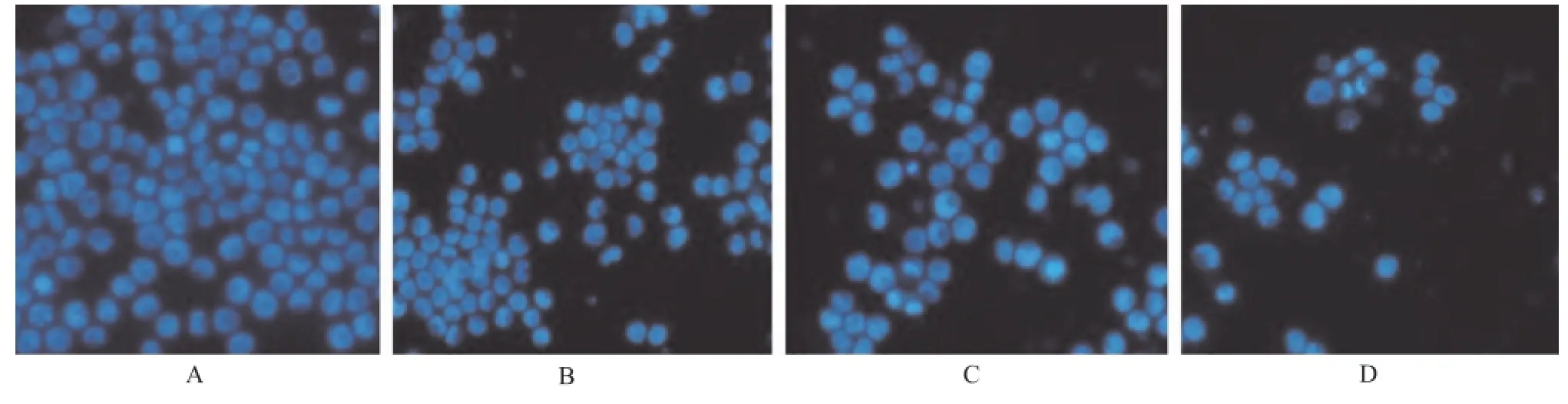
A.对照组;B.20 μg·mL-1鞣花酸组;C.40 μg·mL-1鞣花酸组;D.60 μg·mL-1鞣花酸组图2 Hoechst33258荧光染色检测细胞凋亡(×200)A.control group;B.20 μg·mL-1ellagic acid group;C.40 μg·mL-1ellagic acid group;D.60 μg·mL-1ellagic acid groupFig.2 Cell apoptosis detected by Hoechst33258 fluorescence staining(×200)
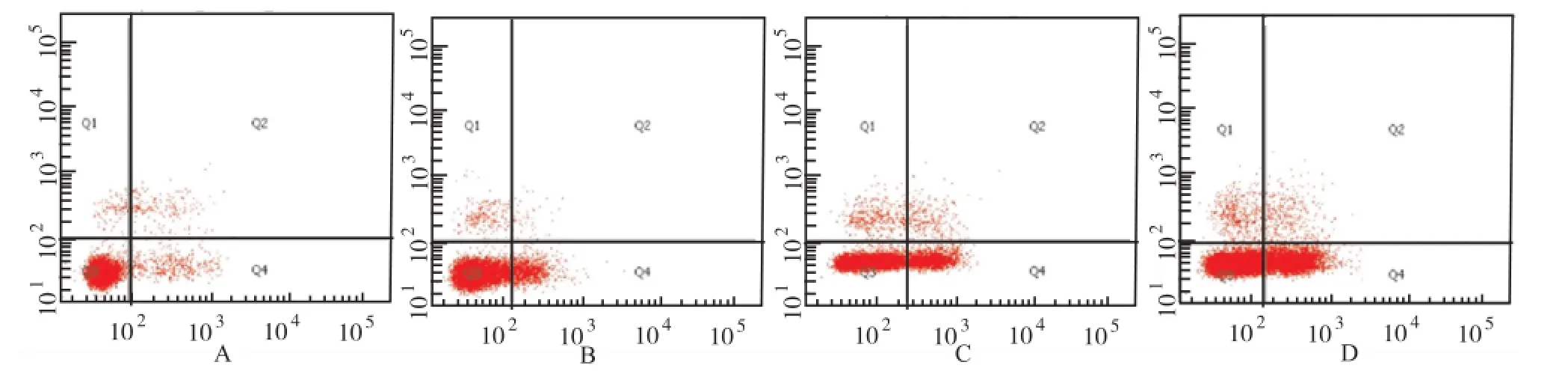
A.对照组;B.20 μg·mL-1鞣花酸组;C.40 μg·mL-1鞣花酸组;D.60 μg·mL-1鞣花酸组图3 以Annexin FITC/PI双染法检测细胞早期凋亡率A.control group;B.20 μg·mL-1ellagic acid group;C.40 μg·mL-1ellagic acid group;D.60 μg·mL-1ellagic acid groupFig.3 Cell apoptosis rate at early phase detected by Annexin FITC/PI staining
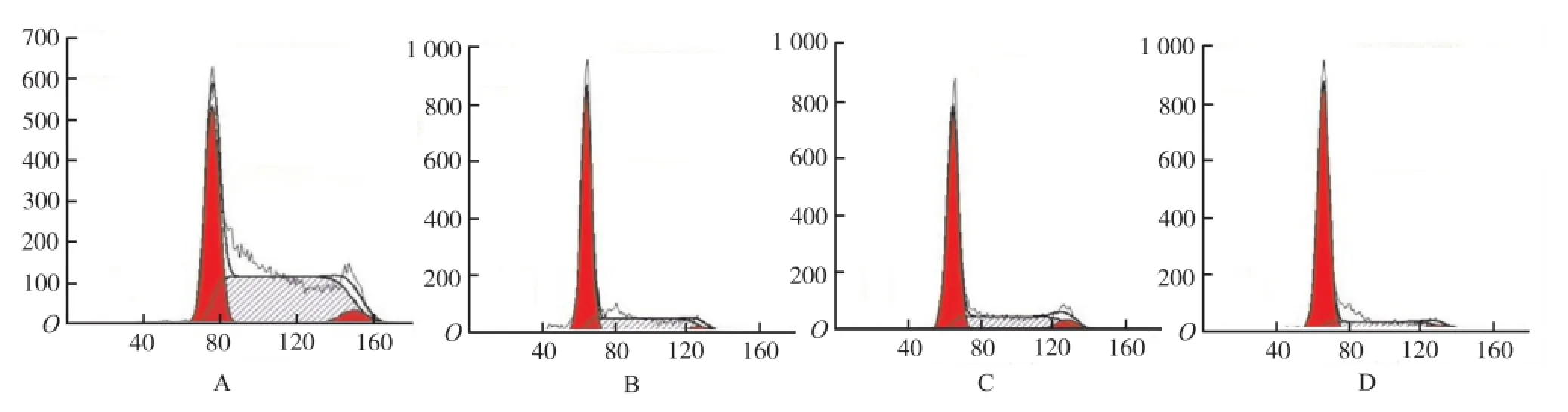
A.对照组;B.20 μg·mL-1鞣花酸组;C.40 μg·mL-1鞣花酸组;D.60 μg·mL-1鞣花酸组图4 流式细胞仪分析细胞周期A.control group;B.20 μg·mL-1ellagic acid group;C.40 μg·mL-1ellagic acid group;D.60 μg·mL-1ellagic acid groupFig.4 Cell Cycle detected by flow cytometry
2.5 鞣花酸处理后的SP2/0细胞COX-2基因表达情况 20,40和60 μg·mL-1鞣花酸孵育SP2/0细胞48 h后,COX-2的表达抑制情况呈梯度性增强。见图5。

A.对照组;B.20 μg·mL-1鞣花酸组;C.40 μg·mL-1鞣花酸组;D.60 μg·mL-1鞣花酸组图5 Western blotting印迹分析COX-2的表达情况A.control group;B.20 μg·mL-1ellagic acid group;C. 40 μg·mL-1ellagic acid group;D.60 μg·mL-1ellagic acid groupFig.5 COX-2 expression detected by western blotting
3 讨论
多发性骨髓瘤是一种克隆性浆细胞异常增生的恶性疾病,其中骨髓瘤骨病(myeloma bone disease,MBD)是其主要并发症,主要与肿瘤细胞破坏了骨的正常代谢有关,临床上表现为高钙血症、病理性骨折、骨痛以及颈、腰椎相关压迫症状。MBD发病隐匿,无特异性表现,临床误诊率较高,现阶段主要以双膦酸盐联合化疗、手术治疗为主,但很难治愈,患者死亡率较高[3]。因此,探索有效的防治骨髓瘤的药物和方法是广大医务工作者和研究人员面临的重要课题。
LESCA[4]研究植物酚类化合物阿魏酸、绿原酸和鞣花酸抗癌作用,发现鞣花酸对抗环芳烃化合物的致癌作用强,绿原酸次之,阿魏酸较弱,认为天然植物酚类物质一般对机体无害,再者,这类天然抗致癌物质广泛地存在于人类的食物之中,在食物中寻找抗癌药物是一种实用的途径。VADHANAM等[5]报道,鞣花酸的皮下注射或口服给药均能推迟雌激素诱导乳腺肿瘤晚2至3周发生,并且能降低肿瘤的发病率和抑制肿瘤生长。KIM等[7]研究发现,含有1%鞣花酸脱乙酰壳多糖凝胶显着降低脑瘤U87细胞和C6细胞的生存能力。向秋等[8]研究五倍子提取物鞣花酸对鼻咽癌5-8F细胞的生物学作用,鞣花酸对鼻咽癌细胞的增殖作用具有剂量依赖性。LI等[9]用鞣花酸孵育膀胱癌T24细胞能诱导细胞凋亡,细胞周期阻滞于G0/G1期。MALIK等[6]报道,鞣花酸通过caspase途径抑制前列腺癌PC3细胞,诱发细胞凋亡。杨洪亮等[10]将小鼠乳腺癌细胞EMT6用鞣花酸孵育48 h,细胞周期阻滞在G0/G1期。王建红等[11]报道五倍子提取物鞣花酸剂量依赖性抑制人乳腺癌MCF-7细胞细胞增殖,细胞被阻滞在G1期,随着药物浓度增加,G1期细胞百分率增高,凋亡细胞增多。本研究结果表明鞣花酸对骨髓瘤细胞SP2/0的增殖有较强的抑制作用,60 μg·mL-1鞣花酸孵育细胞48 h,细胞的增殖抑制率高达70.15%。流式细胞仪分析,细胞阻滞在G1期,随鞣花酸浓度增加,G1期细胞所占百分率增多,与有关文献报道一致,但其相关性的具体机制需进一步探讨。
COX-2属于诱导酶,正常细胞内表达较低甚至不表达,但在肿瘤细胞中表达活跃。关于COX-2的研究表明,COX-2可促进多种肿瘤的发生、发展,抑制其凋亡,增加肿瘤组织内新生血管生成,增强了肿瘤的侵袭性。COX-2对不同肿瘤细胞的作用可能存在不同的机制, KRYSAN等[12]报道非小细胞肺癌细胞中凋亡抑制蛋白(IAP)survivin的稳定性增强与COX-2的表达具有正相关性。而结肠癌HCA细胞中,COX-2可促进Bcl-2蛋白的表达,但对诱导肿瘤凋亡的Bax蛋白表达无影响[13],从而由更稳定的Bax-Bcl-2二聚体替代Bax-Bax同源二聚体,使Bax-Bax同源二聚体促进肿瘤细胞凋亡的能力减弱[14]。本实验表明,鞣花酸可下调骨髓瘤SP2/0细胞中COX-2的表达,从而促进其凋亡。
鞣花酸在肿瘤细胞膜上的聚集依赖于pH,最初形成的微球逐渐聚合转变成微纤维,在pH 6~8的范围内能生成最适长度微纤,能有效粘附到HeLa细胞膜上,有效抑制肿瘤细胞增殖[15]。鞣花酸等植物多酚在肿瘤细胞膜上的聚集特性,可以用于肿瘤细胞的直接给药,其抗肿瘤效果较好,可能为MM的防治提供新方法。
[1] 肖涵,张丽明.多发性骨髓瘤治疗进展[J].中国保健营养,2013,(4):1014-1015.
[2] 于美娥,杨玲,张祥东.多发性骨髓瘤误诊41例分析[J].吉林医学,2013,34(21):4139-4321.
[3] 洪娟,汪兴洪.多发性骨髓瘤骨病发病机制的研究及治疗进展[J].中国临床药理学与治疗学,2013,18(6): 705-709.
[4] LESCA P.Protective effects of ellagic acid and other plant phenols on benzo[a]pyrene-induced neoplasia in mice[J]. Carcinogenesis,1983,4(12):1651-1653.
[5] VADHANAM M V,RAVOORI S,AQIL F,et al.Chemopreventionofmammarycarcinogenesisbysustained systemic delivery of ellagic acid[J].J Cancer Prev,2011, 20(6):484-491.
[6] MALIK A,AFAQ S,SHAHID M,et al.Influence of ellagic acidonprostatecancercellproliferation:acaspasedependent pathway[J].Asian Pac J Trop Med,2011,4 (7):550-555.
[7] KIM S,NISHIMOTO S K,BUMGARDNER J D,et al.A chitosan/beta-glycerol-phosphate thermo-sensitive gel for the delivery of ellagic acid for the treatment of brain cancer [J].Biomaterials,2010,31(14):4157-4166.
[8] 向秋,范才文,肖胜军,等.五倍子提取物抗鼻咽癌5-8F细胞的作用及机制[J].中南大学学报:医学版,2012,37 (9):871-875.
[9] LI T M,CHEN G W,SU C C,et al.Ellagic acid induced p53/p21 expression,G1arrest and apoptosis in human bladder cancer T24 cells[J].Anticancer Res,2005,25 (2):971-979.
[10] 杨洪亮,张翼鷟,王晓芳,等.鞣花酸对肿瘤细胞增殖抑制和诱导凋亡作用的初步研究[J].赤峰学院学报:自然科学版,2010,26(10):49-51.
[11] 王建红,范才文,田晶,等.五倍子提取物鞣花酸抗乳腺癌MCF-7细胞[J].时珍国医国药,2012,23(8):1905-1906.
[12] KRYSAN K,DALWADI H,SHARMA S,et al.Cyclooxygenase-2-dependent expression of survivin is critical for apoptosis resistance in non-small cell lung cancer[J]. Cancer Res,2004,64(18):6359-6362.
[13] 李印杰,李世峰.COX-2与肿瘤发生中的作用机制研究进展[J].中国水电医学,2009,3:189-191.
[14] 陈春燕,卢泰祥,赵充,等.T3-T4N0-N3期鼻咽癌单纯放疗疗效分析[J].中华放射肿瘤学杂志,2006,15(2):77-80.
[15] BARNABY S N,YU S M,TSIOLA A,et al.pH dependent spontaneous growth of ellagic acid assemblies for targeting HeLa cells[J].J Nanosci Nanotechnol,2011,11(9): 7579-7586.
DOI 10.3870/yydb.2014.10.017
Effect of Ellagic Acid on Myeloma SP2/0 Cells
ZHAO Ning,HUANG Yong-ji,MA Guang-bin,YAN Dong-xue
(Department of Spine Surgery,Guilin Medical College Hospital,Guilin 541000,China)
ObjectiveTo investigate the effect of ellagic acid extracted from gallnut on multiple myeloma SP2/0 cell line and related mechanisms.MethodsMultiple myeloma SP2/0 cell line was treated for 48 h with different concentrations of ellagic acidin vitro.Cell morphology,proliferation,apoptosis and cell cycle were analyzed with microscope,MTT experiment and flow cytometry,respectively.Tumor cell proliferation and apoptosis-related gene expression of COX-2 were detected by Western blotting.ResultsCell cycle was arrested at the G1phase 48 h after treatment with ellagic acid,the cell in G1were(55.21± 3.01)%,(64.48±0.43)%,(75.10±2.46)%,respectively,with significant difference as compared with control group [(34.04±1.74)%,P<0.01].Cell suppression rate(21.18±5.92)%,(44.58±3.43)%and(70.15±2.90)%,respectively, in 20,40 and 60 μg·mL-1ellagic acid treatment groups.Compared with the control group,the differences were significant(P<0.01).Cell apoptosis rate was(9.60±0.56)%,(19.30±1.51)%and(35.10±5.26)%,respectively,in 20,40 and 60 μg·mL-1ellagic acid treatment groups,with significant differences as compared with the control group[(3.23±0.85)%,P<0.01].With the increase of drug concentration,COX-2 expression was decreased.ConclusionEllagic acid can inhibit myeloma SP2/0 cell proliferation and promote apoptosis.
Ellagic acid;Multiple myeloma;SP2/0 cell lines;Proliferation;Apoptosis
R965
A
1004-0781(2014)10-1321-05
2013-11-04
2014-02-12
赵宁(1987-),男,山东烟台人,在读硕士,从事脊柱骨病研究。电话:(0)13380901521,E-mail:1018644585@ qq.com。
严冬雪(1966-),男,副教授,硕士生导师,硕士,从事脊柱骨病研究。电话:(0)13517732038,E-mail:ydx562828@sina.com。
