芹菜素对血小板源生长因子诱导血管平滑肌细胞迁移的影响*
2014-05-15关红菁崔昌萍黄际友淑芬
关红菁,崔昌萍,黄际友,淑芬
(1.武汉大学人民医院心血管内科,武汉 430060;2.武汉大学心血管病研究所,武汉 430060;3.解放军75240部队卫生队,潮州 521000)
·药物研究·
芹菜素对血小板源生长因子诱导血管平滑肌细胞迁移的影响*
关红菁1,2,崔昌萍1,2,黄际友3,淑芬1,2
(1.武汉大学人民医院心血管内科,武汉 430060;2.武汉大学心血管病研究所,武汉 430060;3.解放军75240部队卫生队,潮州 521000)
目的 研究芹菜素在体外对血小板源生长因子(PDGF)诱导的血管平滑肌细胞(VSMC)迁移作用的影响及可能的分子机制。方法酶消化法获取大鼠胸主动脉原代血管平滑肌细胞,Transwell小室方法评价芹菜素对PDGFBB诱导的VSMC迁移作用,Western blot方法检测c-Jun N末端激酶(JNK)磷酸化水平。结果20 ng·mL-1PDGF-BB显著促进VSMC迁移,细胞数达到对照组的2.46倍,而12.5 μmol·L-1芹菜素预处理迁移细胞数仅为PDGF-BB组46.5%,不同剂量的芹菜素均能显著抑制PDGF-BB诱导的VSMC迁移,12.5 μmol·L-1芹菜素预处理显著抑制PDGF-BB对JNK磷酸化。结论芹菜素对PDGF-BB诱导的VSMC迁移有显著的抑制作用,其机制可能部分与抑制JNK活化有关。
芹菜素;血小板源生长因子;血管平滑肌细胞;细胞运动
动脉粥样硬化是多种心脑血管疾病的基础病变。经皮冠状动脉介入术(percutaneouscoronary intervention,PCI)的发展,极大改善动脉粥样硬化导致的血管阻塞,然而管腔内再狭窄是阻碍这项技术获得长期成功的主要因素,血管平滑肌细胞(vascular smooth muscle cell,VSMC)的异常迁移是再狭窄过程中新生内膜形成和管腔阻塞的重要因素之一[1-2]。血小板源生长因子(platelet derived growth factor,PDGF)通过活化细胞内信号转导启动多种生物效应从而促进平滑肌细胞迁移[3]。因此抑制PDGF诱导的VSMC迁移可能对抑制再狭窄的发生发挥重要作用。芹菜素属于类黄酮中的黄酮亚类,通常存在于水果、蔬菜和茶叶中。研究表明芹菜素具有抗炎、抗氧化和抗肿瘤特性[4-5],然而芹菜素对于VSMC活化的作用尚未完全明确。笔者在本研究探讨芹菜素对PDGF-BB诱导的VSMC迁移的作用以及可能的分子机制。
1 材料与方法
1.1 材料 芹菜素(批号:10798,纯度≥95%)购自Sigma公司;PDGF-BB(批号:Cyt-412)购自Prospec公司;蛋白酶抑制药Complete(批号:04693124001),磷酸酶抑制剂PhosSTOP(批号:04906837001),购自Roche公司;DMEM/F12,胎牛血清购自Gibco公司;抗总的和磷酸化的c-Jun N末端激酶(c-Jun N-terminalkinase,JNK)抗体(批号:4668),抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号:2118)购自cell signaling technology公司,抗平滑肌α-肌动蛋白(smooth muscle α-actin,SM αactin)抗体购自Abcam公司(批号:ab5694),Transwell系统购自Corning公司。
1.2 血管平滑肌细胞的培养与鉴定 采用酶消化法[6]分离血管平滑肌细胞。无菌条件下取斯泼累格·多雷(Sprague-Dawley,SD)大鼠(体质量100~150 g)胸主动脉,清除血凝块及周围脂肪组织,将Ⅰ型胶原酶,Ⅰ型弹性蛋白酶和大豆胰蛋白酶抑制剂配制成混合消化液,37℃预消化胸主动脉30 min,于体视显微镜下剥离血管外膜,将血管切成宽1 mm的血管环,再于37℃消化2 h,离心收集细胞,细胞培养于含10%胎牛血清的DMEM/F12中。待生长接近融合时传代,血管平滑肌细胞的纯度用细胞形态和VSMC SM α-actin染色鉴定。实验使用细胞为5~12代。
1.3 细胞迁移 VSMC的异常迁移对血管新生内膜增生具有重要作用。芹菜素已被证实为有效的抑制细胞生长的物质,然而芹菜素是否对VSMC的迁移有抑制作用仍有待研究。本研究用Transwell方法评价了芹菜素对VSMC迁移的作用。参考既往文献,选取两个浓度的芹菜素进行研究[7]。细胞分为4组,对照组,PDGF-BB组,12.5 μmol·L-1芹菜素组,25.0 μmol·L-1芹菜素组,芹菜素组分别用不同浓度的芹菜素预处理细胞1 h后,再用PDGF趋化细胞。VSMC 25 μmol·L-1以每孔5×104个(50 μL)的密度接种于上室,贴壁30 min,将25.0 μmol·L-1芹菜素50 μL加入上室,12.5 μmol·L-1芹菜素100 μL加入下室预处理细胞1 h,随后PDGF-BB 20 ng·mL-1加入下室作为趋化剂。细胞迁移6 h后,用棉签拭去膜上表面未迁移的细胞,迁移到下表面的细胞用多聚甲醛固定,随后用0.1%结晶紫/20%甲醇溶液染色并计数。迁移细胞数目定义为每高倍视野迁移细胞数量。
1.4 Western blot VSMC接种于6 cm培养皿,细胞生长至70%~80%融合后无血清饥饿24 h。12.5 μmol·L-1芹菜素预处理2 h后,予以PDGF-BB (20 ng·mL-1)刺激相应的时间。细胞用预冷的磷酸盐缓冲液(phosphate buffered solution,PBS)清洗3次,加入含有蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液裂解,14 500×g离心20 min,取上清液以BCA法测定蛋白质含量。每个样本取蛋白提取物20 μg用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,随后转印至Immobilon-FL(Millipore)膜上。含5%脱脂奶粉的洗膜缓冲液(TBST)封闭1 h,与不同的一抗4℃孵育过夜,之后与IRDye 800CW标记的二抗于室温下孵育1 h,Odyssey Imaging System获取荧光信号。
1.5 统计学方法 采用SPSS13.0版统计软件进行统计学分析。数据以均数±标准差(±s)表示,均经正态性及方差齐性检验,多组间均数比较采用One Way ANOVA,两组间均数比较采用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 VSMC的鉴定 倒置显微镜下观察细胞,可见单个VSMC为梭形,有多个细胞突起,细胞生长致密时排列成束,部分重叠,呈特征性的“峰”“谷”状生长。运用免疫荧光方法对VSMC行SM α-actin染色,荧光显微镜下可见细胞质中与长轴平行的条丝状绿色荧光,即为肌动蛋白,>95%细胞染色呈阳性(图1)。

绿色:特异性阳性染色;蓝色:DAPI染色的细胞核;阳性细胞超过95%图1 荧光显微镜下观察血管平滑肌细胞SM α-actin免疫荧光染色图(×200)Green:specific positive staining;Blue:nucleus stained by DAPI;positive cells were more than 95%Fig.1 SM α-actin staining on vascular smooth muscle cells detected by fluorescence microscopy(×200)
2.2 芹菜素对PDGF-BB诱导的VSMC迁移的影响结果显示,与对照组比较,PDGF-BB刺激6 h显著促进VSMC的迁移,迁移细胞数达到对照组的2.46倍,而12.5 μmol·L-1芹菜素预处理显著抑制这一效应,迁移细胞数仅为PDGF-BB组46.5%。芹菜素的抑制作用呈现出剂量依赖的关系,25.0 μmol·L-1芹菜素即几乎完全抑制PDGF促进VSMC的迁移(图2)。
2.3 芹菜素抑制VSMC迁移的分子机制 由于在细胞迁移实验中,12.5 μmol·L-1芹菜素预处理已经显示显著抑制VSMC迁移,因此,只选取12.5 μmol·L-1芹菜素进行分子机制的研究。PDGF-BB作用5 min后JNK即发生显著磷酸化,而12.5 μmol·L-1芹菜素处理显著抑制PDGF-BB对JNK的活化,PDGF-BB和芹菜素对JNK总蛋白水平均没有影响,见图3。

A.对照组;B.PDGF-BB组;C.12.5 μmol·L-1芹菜素组;D.25.0 μmol·L-1芹菜素组;与对照组比较,*1P<0.05;与PDGF-BB组比较,*2P<0.05图2 芹菜素抑制PDGF-BB诱导的VSMC的迁移A.control group;B.PDGF-BB group;C.12.5 μmol·L-1apigenin group;D.25.0 μmol·L-1apigenin group;compared with control group,*1P<0.05;compared with PDGF-BB group,*2P<0.05Fig.2 Inhibition of Apigenin on migration of VSMC induced by PDGF-BB
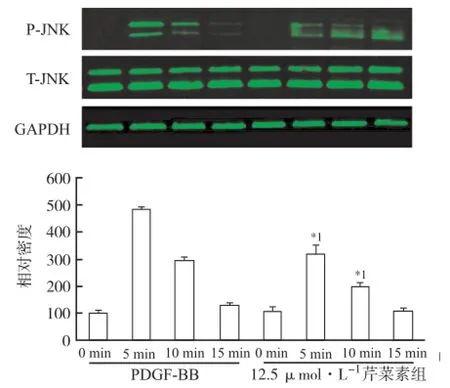
与PDGF-BB组比较,*1P<0.05图3 芹菜素抑制PDGF-BB诱导的JNK磷酸化Compared with PDGF-BB group,*1P<0.05Fig.3 Inhibition of Apigenin on JNK phosphorylation induced by PDGF-BB
3 讨论
平滑肌细胞的迁移对于再狭窄的发展发挥重要作用。平滑肌细胞是新生内膜主要的细胞成分,当迁移到内膜中,平滑肌细胞异常增殖并成为细胞外基质蛋白的主要来源。因此寻找能抑制平滑肌细胞迁移的物质有助于为再狭窄的治疗提供新的策略。流行病学研究发现增加摄入蔬菜和水果有助于降低肿瘤和心血管疾病引起的死亡[8]。芹菜素是广泛存在于蔬菜和水果中的植物化合物,研究发现,芹菜素通过抗氧化作用,抑制细胞周期,促进细胞凋亡等作用机制[9-10],对多种肿瘤细胞的生长及侵袭具有显著的抑制作用,但是芹菜素对于血管平滑肌细胞的作用目前尚未获得一致结论[11-13]。因此本研究运用Transwell细胞迁移检测探讨芹菜素对血管平滑肌细胞迁移的作用,发现预先用芹菜素处理显著减少PDGF-BB诱导的细胞迁移,结果提示芹菜素是VSMC迁移的抑制剂,这个结果与LAMY等[12]研究结果一致。
芹菜素抑制血管平滑肌细胞迁移的分子机制目前尚不十分清楚。既往研究证实JNK的活化在多种细胞中都与细胞迁移增强相关,因此在本研究中检测了芹菜素对PDGF-BB诱导的JNK活化的作用。与既往研究一致,PDGF-BB诱导JNK快速的磷酸化。更重要的是,芹菜素干预导致JNK的磷酸化显著减少,抑制血管平滑肌细胞JNK活化。ZHAN等[14]研究发现,在平滑肌细胞中转染突变失活的JNK导致PDGF-BB诱导的VSMC迁移减少约77%。与此同时,KAVURMA等[15]也发现VSMC的迁移可以被JNK抑制剂SP600125所阻断,这两项研究提示了JNK活化在血管平滑肌细胞迁移中发挥了重要作用,因此芹菜素对于血管平滑肌细胞JNK活化的抑制可能是其对细胞迁移的抑制作用的机制之一。已有多项研究探讨JNK参与细胞迁移调节的机制。研究显示,粘着斑激酶可将整合素刺激信号传导到JNK[16]。此外,细胞迁移的重要调节物Src也参与整合素到JNK的信号传导[17]。由此可知,对于调控细胞运动的多种信号通路来说,JNK是共同的下游靶点。除了调控信号通路外,JNK还作用于细胞迁移的关键分子。细胞迁移需要细胞骨架重组,这个过程涉及到细胞骨架相关酪氨酸激酶的磷酸化以及粘着斑复合物的形成。paxillin是粘着斑衔接分子,研究发现,paxillin的丝氨酸178位点可以被JNK磷酸化,当这一位点发生突变而不能磷酸化时,细胞运动显著受限,结果提示这一过程对于快速细胞迁移是必要的[18]。然而在平滑肌细胞中,芹菜素抑制JNK活化后是否影响到以上信号通路仍需进一步研究。
综上所述,本研究证实芹菜素抑制PDGF-BB诱导的VSMC迁移,这一作用可能部分与其抑制JNK活化有关。研究提示芹菜素可能对再狭窄发生有一定的抑制作用,但这一作用仍需要通过动物实验进一步证实。
[1] WEINTRAUB W S.The pathophysiology and burden of restenosis[J].Am J Cardiol,2007,100(5A):3-9.
[2] BAUTERS C,ISNER J M.The biology of restenosis[J]. Prog Cardiovasc D,1997,40(2):107-116.
[3] OWENS G K,KUMAR M S,WAMHOFF B R.Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J].Physiol Rev,2004,84(3): 767-801.
[4] SHANMUGAM K,HOLMQUIST L,STEELE M,et al.Plantderived polyphenols attenuate lipopolysaccharide-induced nitric oxide and tumour necrosis factor production in murine microglia and macrophages[J].Mol Nutr Food Res,2008, 52(4):427-438.
[5] SHUKLA S,GUPTA S.Apigenin:a promising molecule for cancer prevention[J].Pharm Res,2010,27(6):962-978.
[6] GEISTERFER A A,PEACH M J,OWENS G K.Angiotensin II induces hypertrophy,not hyperplasia,of cultured rat aortic smooth muscle cells[J].Circ Res,1988,62(4):749-756.
[7] ZHANG Y H,PARK Y S,KIM T J,et al.Endotheliumdependentvasorelaxantandantiproliferativeeffectsof apigenin[J].Gen Pharmacol,2000,35(6):341-347.
[8] GRAF B A,MILBURY P E,BLUNMBERG J B.Flavonols, flavones,flavanones,and human health:epidemiological evidence[J].J Med Food,2005,8(3):281-290.
[9] GUPTA S,AFAQ F,MUKHTAR H.Involvement of nuclear factor-kappa B,Bax and Bcl-2 in induction of cell cycle arrestandapoptosisbyapigenininhumanprostate carcinoma cells[J].Oncogene,2002,21(23):3727-3738.
[10] WAY T D,KAO M C,LIN J K.Degradation of HER2/neu by apigenin induces apoptosis through cytochrome c release andcaspase-3activationinHER2/neu-overexpressing breast cancer cells[J].FEBS Lett,2005,579(1):145-152.
[11] KIM T J,ZHANG Y H,KIM Y,et al.Effects of apigenin on the serum-and platelet derived growth factor-BB-induced proliferation of rat aortic vascular smooth muscle cells[J]. Planta Med,2002,68(7):605-609.
[12] LAMY S,BEDARD V,LABBE D,et al.The dietary flavones apigenin and luteolin impair smooth muscle cell migration and VEGF expression through inhibition of PDGFR-beta phosphorylation[J].Cancer Prev Res(Phila),2008,1(6): 452-459.
[13] TROCHON V,BLOT E,CYAMBALISTA F,et al.Apigenin inhibits endothelial-cell proliferation in G(2)/M phase whereas it stimulates smooth-muscle cells by inhibiting p21 and p27 expression[J].Int J Cancer,2000,85(5):691-696.
[14] ZHAN Y,KIM S,IZUMI Y,et al.Role of JNK,p38,and ERK in platelet-derived growth factor-induced vascular proliferation,migration,andgeneexpression[J]. Arterioscler Thromb Vasc Biol,2003,23(5):795-801.
[15] KAVURMA M M,KHACHIGIAN L M.ERK,JNK,and p38 MAPkinasesdifferentiallyregulateproliferationand migration of phenotypically distinct smooth muscle cell subtypes[J].J Cell Biochem,2003,89(2):289-300.
[16] ALMEIDA E A,ILIC D,HAN Q,et al.Matrix survival signaling:from fibronectin via focal adhesion kinase to c-Jun NH(2)-terminal kinase[J].J Cell Biol,2000,149(3): 741-754.
[17] LIU J,HUANG C,ZHAN X.Src is required for cell migration and shape changes induced by fibroblast growth factor 1[J].Oncogene,1999,18(48):6700-6706.
[18] HUANGC,RAIFURZ,BORCHERSC,etal.JNK phosphorylates paxillin and regulates cell migration[J]. Nature,2003,424(6945):219-223.
DOI 10.3870/yydb.2014.10.003
Effects of Apigenin on Platelet Derived Growth Factor-induced Migration of Vascular Smooth Muscle Cells
GUAN Hong-jing1,2,CUI Chang-ping1,2,HUANG Ji-you3,SHU Fen1,2
(1.Department of Cardiology,Renmin Hospital of Wuhan University,Wuhan 430060,China;2.Cardiovascular Research Institute of Wuhan University, Wuhan 430060,China;3.Medical Unit of 75240 PLA Troops,Chaozhou 521000,China)
ObjectiveTo investigate the effects of apigenin on the migration of vascular smooth muscle cells(VSMC) induced by platelet derived growth factor(PDGF)-BB and the possible molecular mechanism.MethodsVSMCs were isolated from thoracic aortas of male Sprague-Dawley rats using enzyme digestion method.Migration of VSMCs was determined by transwell assay.Western blotting was carried out to evaluate phosphorylation of c-junN-terminal kinase(JNK).ResultsTreatment with PDGF-BB(20 ng·mL-1)significantly promote VSMC migration,the number of migrated cells was 2.46 times than that of control group.However,after 12.5 μmol·L-1apigenin pretreatment,the number of migrated cells was 46.5%of the PDGF-BB group.Various dose of apigenin can significantly inhibit VSMC migration induced by PDGF-BB,12.5 μmol·L-1apigenin treatment significantly inhibited PDGF-BB phosphorylation of JNK.ConclusionApigenin can suppress the migration of VSMC induced by PDGF-BB.These beneficial effects on VSMC were at least partly mediated by the inhibition of activity of JNK.
Apigenin;Platelet derived growth factor;Vascular smooth muscle cell;Cell movement
R965
A
1004-0781(2014)10-1265-04
2013-09-17
2014-04-18
*国家自然科学基金资助项目(81070089)
关红菁(1973-),女,辽宁新宾人,副主任医师,博士,主要从事心脏与血管的重构研究。电话:027-88041911, E-mail:guanhj829@163.com。
