全球气候变暖对凋落物分解的影响
2014-05-14张乃莉马克平郭继勋
宋 飘,张乃莉,马克平,郭继勋
(1.中国科学院植物研究所植被与环境变化国家重点实验室,北京 100093;2.东北师范大学,长春 130024)
土地利用变化和化石燃料燃烧等人类活动引起大气温室气体的富集,由此导致地球表面平均温度上升[1-2]。政府间气候变化专门委员会预测全球地表温度到2100年将上升1.1—6.4℃[2],这种全球尺度的气候变迁给整个陆地生态系统带来深远影响。全球气候变暖所带来的诸如气候带转移、生态系统地理分布格局变化等极大地改变了生态系统中原有的植被层-凋落物层-土壤各个碳库间的动态平衡[3]。全球气候变暖通过环境因素、凋落物数量和质量以及分解者3个方面,直接或间接地作用于凋落物分解过程,并进一步影响土壤养分周转和碳库动态(图1)。全球气候变暖通过对温度、水分等环境因子的短期作用直接影响凋落物的分解速率;同时也可对植物群落结构和植物表型的长期作用影响凋落物数量和质量,从而间接地改变凋落物分解速率[4];此外,气候变暖也可通过直接影响土壤微环境或是间接影响地上植物及养分输入,作用于土壤中微生物量、微生物活动以及群落结构进而影响凋落物分解过程及其反馈结果。本文针对陆地生态系统凋落物分解这一关键生态学过程,从凋落物分解的3个主要影响因素入手,剖析全球变暖背景下的凋落物分解过程的响应和反馈的研究现状和进展。
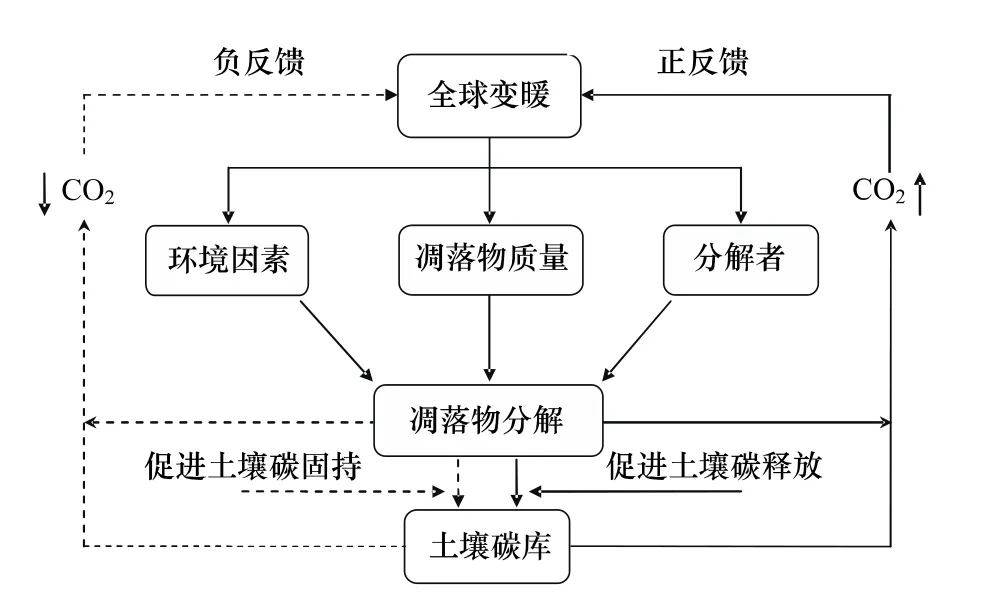
图1 陆地生态系统凋落物分解对气候变暖的响应Fig.1 Responses of litter decomposition to climate warming in terrestrial ecosystems
1 凋落物分解研究历史
凋落物从广义上可分为森林叶凋落物、死亡根系和倒木3部分[5]。在凋落物分解这一研究课题上,叶凋落物分解的研究已有100多年的历史。早在1876年德国生物学家Ebermayer就凋落物在养分循环中的作用开展了大量研究[6]。此后国外许多学者陆续对生态系统内凋落物的动态分解过程以及养分释放等方面开展了大量的野外实验研究[4]。而中国有关凋落物的研究起步较晚,直到20世纪80年代,我国学者才开始对凋落物分解进行研究,主要涉及不同物种以及区域差异对凋落物分解的影响,以及分解过程中养分动态变化研究[7-8]。随着对全球气候变化的广泛关注,20世纪90年代针对气候变暖背景下叶凋落物分解的研究也得到广泛开展,其中包括凋落物分解与生态系统碳收支平衡的问题,全球气候变暖下凋落物分解动态研究以及土壤微生物活性与凋落物分解的关系等方面的研究[9-12]。近10年来,国内外科学家也逐渐认识到地下凋落物输入对整个生态系统过程的重要性,及其在陆地生态系统中应对全球气候变暖的反馈机制研究中的重要角色。而对于分解过程的各影响因子之间对调控凋落物分解的交互作用机制、凋落物分解过程与地上植物群落的互作机制以及凋落物分解对全球变化的响应与反馈机制等一系列科学问题仍需深入研究。
2 气候变暖对凋落物分解的影响
2.1 环境因素
由于全球气候变暖所引起的全球平均气温上升、降雨格局的改变,这些环境因子的变化均以不同程度不同方式影响着地上植物群落结构、物侯变化以及地表和土壤微环境。一般来说,气候变暖所引起的直接作用主要是通过改变不同生态系统中水热条件,加强地上植物的蒸腾作用、降低土壤含水量,进而影响凋落物的分解[13]。就间接作用而言,气候变暖可通过长期的作用影响地上植物群落的结构组成、特别是优势物种的功能型以及延长植物生长周期从而可能引起凋落物质量和分解能力的改变[14]。
2.1.1 温度升高
大量增温模拟实验表明,在不同生态系统下采用不同模拟增温的实验方法可在不同程度上加速凋落物分解[15-16](表1)。Moore等发现年平均气温是陆地生态系统凋落物分解速率最密切相关的控制因子,可使凋落物分解率增加4%—7%[17]。我国草原生态系统,随着温度升高凋落物分解速率也有加快的趋势[18],短期小尺度上增温使凋落物分解速率增加,这可能是由于土壤氮有效性的提高[19]间接地通过提高植物凋落物质量从而促进凋落物分解[20-21];而在长期大尺度上其可能受到增温以及相应的植物群落生长过程中群落组成改变的共同影响[3]。对于湿地生态系统,增温能够增加水体温度从而直接通过促进淋溶[22]进而加速凋落物分解,并通过促进无脊椎动物的物理破碎间接提高凋落物分解速率[23]。Kang等认为不同纬度下由于温度的差异而导致的凋落物分解速率不同与相应的酶活性差异有关[24]。然而,在不同森林生态系统,增温对凋落物分解的作用并不一致[25-26]。Cheng等认为温度升高1℃所引起的气候变暖可能不会引起凋落物分解速率的显著变化,这可能是由于在干旱季节土壤湿度变化产生的补偿机制对温度升高导致的凋落物的分解速率增加产生了抑制效应[15,27]。在温带森林生态系统实验发现凋落物分解率会在增温处理下明显降低[26]。

表1 主要陆地生态系统增温对凋落物分解的影响Table 1 Effects of warming on litter decomposition in forest,grassland and wetland ecosystems
2.1.2 湿度改变
气候变暖引起的温湿度变化对凋落物分解速率的影响在已有的大量研究中得到验证[17,35-36]。全球变暖将改变森林生态系统的水热条件,导致地面蒸散增加而使土壤含水量降低进而不利于凋落物的淋溶和分解。在全球尺度上实际蒸散通常作为气候因子影响凋落物分解的另一个重要指标[37]。Aerts将来自44个冷温带地区和潮湿热带地区进行的为期一年的叶凋落物分解实验数据与实际蒸散进行了相关分析发现,凋落物分解与实际蒸散呈指数关系,其中热带地区凋落物分解受实际蒸散影响最为显著[4]。Robinson 等[32]在年降雨量为 330 mm 的亚北极石楠灌丛区域发现增温降低了凋落物的分解速率而水分的增加却显著增加其分解速率。此外有些研究结果表明气候变暖对凋落物分解的影响源于温湿度变化对土壤有机质新陈代谢的间接作用[35-36]。在没有湿度限制的长期增温下,全球气候变化可能会增加凋落物分解速率,但对于自然条件下多种环境因子交互作用对其分解率的研究则很少[38]。因此对于未来如何更加精确地预测气候变化对凋落物分解速率的影响更多地要结合降雨、蒸腾等多方面信息[4]。
2.2 地上植物群落
气候变暖已经引起了北半球极寒生物带以及高山冻原生物带植被丰富度和组成的剧烈变化[39-40]。通过模型,研究者们也预测出在寒冷生物群区内长时期的气候变暖会导致地上植物生物量和植被生产力的剧烈增加[41]。植被生产力的增加将会提高凋落物的输入量,从而使枯枝落叶成为地上年凋落物产量的主要来源,进而促进地上不同质量不同分解力植物群落的演替。Johances等证明了在寒冷北方生物带灌木叶凋落物积累的增加同时会潜在降低增温对凋落物分解速率的正效应[3]。总而言之,凋落物质量和数量的变化受控于地上植物群落生产力和群落组成的改变[42]。气候变暖对凋落物输入量、凋落物物理特征和化学组分的影响均可能作用于陆地生态系统凋落物分解过程。
2.2.1 凋落物输入量
一般而言,气候变暖往往会促进植物生长、增加初级生产力,进而增加凋落物的输入量,同时气候变暖也可导致植物群落组成和结构的变化从而改变凋落物积累速率及分解速率,进而影响生态系统水平中碳库的动态变化[3]。Wu等通过荟萃分析综合了生态系统水平上凋落物分解对增温的响应,发现增温普遍刺激了植物的生长以及生态系统碳库的周转,同时增温也可显著增加植物总净光合生产力[43],这可能是由于温度升高提高了土壤养分的矿化能力进而增加了地上生物量[44-45]。而植物生物量随温度增加而升高的这一现象也可能表现在某一特定生态系统类型中的某一优势物种。例如Biasi等研究表明,在地衣丰富的矮灌木的冻原生态系统中,地上植物生物量对增温的响应比北极严寒生态系统内地上植物生物量差异显著[46]。Natali在北方极地寒冷系统中对冬夏两季进行的开顶式增温实验表明,增温使这两个季节中初级生产力增加20%,并同时增加凋落物的分解速率[47]。然而,一些研究证明植物的生长和地上生物量同时在干旱和湿润的土壤中对增温处理没产生显著性响应[48],甚至会降低某个物种的生物量[49-51],这可能是由于增温减低了土壤含水量从而影响了地上植物对水分的吸收进而影响其生长。
2.2.2 凋落物质量
气候变暖对凋落物化学组分的影响同样会引起凋落物分解速率的特异性响应。凋落物的化学性质称之为“基质质量”,定义为凋落物的相对可分解性,其中包括诸如含有C、N、P养分元素的易分解组分和木质素、纤维素等难分解有机组分[52]。气候变暖对凋落物质量的影响主要侧重在两个方面:植物群落原有物种短期内化学性质的改变和群落中物种组成的长期变化[4]。Fierer发现温度变化会引起凋落物碳含量的变化,并由此影响凋落物分解过程[53]。Day等在南极半岛的冻原带对维管植物南极漆姑草(Colobanthus quitensis)和发草(Deschampsia antarctica)进行了4个生长季节的紫外线增温处理,发现与对照处理相比,增温使漆姑草地上生物量明显增加,同时两种维管植物中碳含量也同时增多,而氮浓度相对降低。这就导致了漆姑草凋落物层的数量以及C/N含量也同时增加,进而导致其分解速率降低[54]。此外,还有研究发现木质素浓度以及初始木质素与N的比值会限制凋落物分解,降低其分解速率[6]。Berg等发现叶中N含量高会抑制生物量损失,因为其会对木质素分解酶产生抑制,从而抑制木质素分解、降低凋落物分解速率[55-56]。然而,一些研究表明,在凋落物质量和分解速率之间没有明显的关系[57],尽管一些模型已经对此进行了描述,但至今仍无令人普遍接受的凋落物组分变异对凋落物分解进行预测。
2.2.3 凋落物分解阶段
凋落物分解对气候变暖的响应存在阶段上的分异。Berg等将凋落物分解在形成腐殖质之前划分为3个阶段,其中每个阶段呈现不同养分释放规律。在分解的早期阶段,凋落物主要分解的是可溶性物质,以及未被保护的纤维素和半纤维素等物质,而这一过程可能受到水热等环境因子的影响。一般认为,水热因子和N、P、S等可溶性物质对分解早期分解速率的影响是正向的[55],而在分解的中后期,气候对分解的影响逐渐减低[55]。在分解后期,凋落物自身的养分元素的限制,如N素限制可能成为调控分解速率的主要因子,此时凋落物分解对于周围水热因子的直接作用并不十分敏感。在分解的最后阶段,即接近形成腐殖质阶段,分解会达到一个极限值[55]。范萍 萍[58]对 落 叶 松(Larix gmelinii)、云 杉 (Picea koraiensis)和黄波罗(Phellodendron amurense)叶凋落物进行的分解实验发现,77%的生物量损失来自前期易分解凋落物组分,20%的生物量损失来自后期的难分解凋落物组分。然而,气候变暖的影响不仅源于对分解环境中水热因子的直接调控,往往还通过影响凋落物的化学组分控制分解速率。就这一点而言不论凋落物分解的早期还是后期,都会受到气候变暖的影响,只不过前期更多地表现在气候变暖的直接作用,后期则更多的是间接影响。因此,了解气候变暖对凋落物不同分解阶段的影响,将会更好地了解凋落物分解过程及其对全球气候变暖的响应。
2.3 分解者的影响
分解者主要包括节肢动物、蚯蚓、白蚁、昆虫等大型土壤动物以及细菌、放线菌、真菌等微生物,他们是分解凋落物的主要执行者。各种土壤分解者彼此相互作用、相互协调共同参与凋落物的分解过程。地上凋落物经过土壤动物的物理破碎后则由大量的土壤微生物进行生物化学分解作用[59],将其进一步分解成为简单无机分子或转化为腐殖质。而大型节肢动物、蚯蚓和小型土壤动物不仅在粉碎凋落物上发挥着重要作用,它们在与土壤微生物相互作用过程中形成的营养级间的级联效应同样在调节凋落物分解中具有重要作用。
2.3.1 土壤动物活动及其丰富度
在凋落物分解过程中土壤动物(例如,节肢动物)的活动受到温度[60-61],湿度以及凋落物质量的影响[6],而任何由于土壤动物的变化所引起的对凋落物分解速率的影响都会受到环境因子的直接影响,或者受地上植物群落组成变化的间接影响。Bokhorst等在南极陆地生态系统上进行了为期两年的野外开顶式增温实验发现,增温1—2℃对土壤动物丰富度的影响可能源于不同纬度以及在同一纬度上不同植物群落组成的差异[62]。在不同纬度上,本地节肢动物群落多样性随着纬度升高而降低。而在同一纬度上,弹尾目的丰富度在矮小灌木植被中却增多,这可能是由于水分因子是当地一个重要的限制因子[63],因此高丰富度和高多样性的节肢动物会在环境更加湿润且地上植物群落密度更大的地区生活。增温处理对低、高纬度地区蜱螨亚纲和弹尾目的物种丰富度和多样性没有影响;而使中纬度地区上地衣群落内弹尾目的物种丰富度降低,表明中纬度区域土壤动物,至少是弹尾目的物种对增温处理响应敏感,这可能是由于增温引起了植物群落内相对湿度降低[64-65],从而限制了该类土壤动物的生长与活动。同样的结论也在Coulson等的研究中得到验证,3a的增温使弹尾目物种丰富度显著降低[66],但前气门亚目的总数量在南极地区却显著增加,这可能是由于其捕食者受环境湿度的限制数量减少从而增加其生存的机会[67]。Webb等人提出,甲螨亚目在快速应对短期环境变化(增温处理)的能力是很有限的,但是持续的环境温度升高很可能会影响其种群增长速率[68]。综上可见,增温不仅会影响土壤动物物种丰富度,对不同物种的差异性影响也会进一步地改变土壤动物的物种组成。土壤动物对气候变暖的这些特异性响应又会如何影响凋落物分解速率呢?研究表明土壤动物丰富度的改变对凋落物分解的影响可能存在生态系统特异性,例如,在温带或者湿润的热带森林生态系统,土壤动物丰富度的增加往往会提高凋落物的分解速率,而在其他条件寒冷、干旱的生态系统中却与此不同[69]。Grizelle等在干旱和湿润的两种不同环境下的亚热带生态系统以及温带亚高山森林生态系统区域内进行的研究同样发现土壤动物对凋落物分解速率的影响在不同生态系统中的表现不同[70]。在热带湿润气候环境下土壤动物的丰富度高于温带亚高山森林生态系统以及热带干旱区域,对凋落物的分解影响也显著高于处于干旱区域以及温带亚高山森林生态系统下的土壤动物[70]。这一自然温度梯度下的研究结果间接地表明了土壤动物对温度变化的响应及其对凋落物分解的影响可能受到所在生态系统特定条件(尤其是水分条件)的限制。
2.3.2 微生物活动
气候变暖对微生物活动会产生直接或间接的影响,从而调控凋落物分解。一方面气候变暖直接作用于地表和土壤理化环境,另一方面通过改变微生物生长活动所需的碳源和能量间接地影响土壤微生物活动及其所介导的凋落物分解等生态过程[71]。微生物分泌的胞外酶是微生物分解作用的主要载体,也是微生物群落活性的体现。气候变暖可以通过对温湿度变化直接影响酶的活性[72]、影响分解酶的总量和种类[73],同时影响微生物量和群落组成。微生物酶直接作用于有机质底物、参与凋落物分解过程。气候变暖对分解底物数量和质量的改变同样会影响微生物酶活性及其分解作用[74]。那么气候变暖打破某些特殊生境的低温限制是否能够加速凋落物分解?Kang等发现在某些特殊生态系统中,例如湿地生态系统,由于高纬度温度条件和凋落物质量相对低,因此往往伴有较低的土壤酶活性,从而限制凋落物的分解;而低纬度地区由于环境温度相对较高则往往会打破这种限制而促进凋落物分解[24]。Suvendu对4种理化性质不同的热带水稻生长的土壤条件进行了增温和升高CO2浓度处理,发现增温至45℃时土壤微生物碳含量平均升高41.4%,同时微生物活性也显著升高,这都表明增温和增加CO2浓度等气候变化可以改变土壤微生物活性[75]。另外,气候变暖和CO2浓度升高的交互作用也可增加β葡萄糖甘酶的活性。这也说明土壤中不稳定碳的输入在响应增温和CO2浓度升高的交互作用上会反过来刺激微生物活性从而增加相应的酶活性,进而影响凋落物的分解过程[75]。
2.3.3 微生物生物量
在全球气候变暖背景下,微生物群落可以通过驯化来适应这种环境变化。一些短期研究表明,微生物量会随温度上升而增加[76-77],但在长期增温实验中发现微生物生物量可能会保持不变甚至降低[78-79]。这可能是由于长期的升温环境下微生物形成适应性生长[80-81],因此改变了特定微生物类群的生理适应功能,也可能是由于长期的环境波动改变了微生物群落组成。Van[76]在荷兰进行的连续两年增温控制实验发现,微生物量C、N、P含量显著增加并提高了凋落物初始分解速率,这可能是由于增温使微生物净矿化速率提高,从而导致微生物量含量增加,并提高了植物对于有效养分的吸收,进而增加了凋落物中易分解养分含量[82]。同样,对于亚北极石楠灌丛土壤的室内增温培养研究发现,不同温度以及有无凋落物存在的土壤环境下,微生物N含量会随着温度升高以及凋落物输入的增加而增多[83]。Gutknecht分析了8a的野外增温实验发现周围环境年际间和季节性的温度变化对于微生物群落的影响比增温处理的作用更显著,同时微生物量对增温处理的响应并不显著[78]。Rinnan也指出增温处理会导致亚北极石楠灌丛的群落土壤微生物量C、N含量降低[79,84]。这些研究结果说明土壤微生物量对长期增温处理可能确实存在一定的适应性。
2.3.4 微生物群落结构
温度升高可能对生态系统水热动态及微环境产生显著影响[85],改变土壤和凋落物中生物群落结构和组成[30,86],使高寒地区土壤冻结时间和强度降低,进而影响凋落物分解过程。Julie等通过两年的野外增温实验发现,微生物群落结构受到增温的强烈影响,同时细菌数量随温度升高显著下降而真菌群落数量显著增长,特别是外生菌根真菌,同时其相应的地上灌木树种也显著增加[87],这可能是由于微生物类群在应对外界环境变化时选择了不同的生活对策[88]。Rinnan等在亚北极石楠灌丛地带进行的连续7a和17a的增温实验表明,增温使细菌的增长分别降低了28% 和73%[89]。Christian等通过不同时间段不同程度的室内增温培养实验发现,增温5℃和9℃分别使凋落物分解速率增加了18%与31%,同时通过模型拟合发现其土壤真菌分解者所支持的优势物种在响应温度变化时更为显著,这可能是由于大多数真菌的温度敏感性较低所致[90]。尽管很多研究都发现温度的变化土壤微生物会导致群落的改变,但是这种微生物分解者群落结构变化在植物-土壤反馈过程中的作用却常常被忽视,同时如何通过调节凋落物分解过程而控制土壤养分循环过程尚不清楚[91]。
2.3.5 分解者亚系统营养级间的交互作用
土壤中细菌和真菌可以形成90%的土壤微生物量,它们是凋落物的主要分解者[92],但其活动强烈受到与其伴随生活的其他土壤生物的影响[93]。诸如蚯蚓(Pheretima)等主要的土壤动物在凋落物分解过程中所扮演的重要角色[94],它可通过粉碎有机质增加微生物与待分解物质的接触表面,促进微生物在凋落物分解过程中的作用[95]。蚯蚓作为凋落物的居住者以及转移者,生活在有机质层及其凋落物表层并以粗糙的微粒有机质为食,摄取大量的未分解的凋落物并通过作用于土壤中其他生物组分进而对微生物群落结构和功能产生影响[96]。MarÍa等研究表明蚯蚓的活动减少了土壤中细菌和真菌的丰富度,在不同植物培养材料中,蚯蚓的活动强烈改变着土壤微生物群落结构[97]。此外,在热带和温带地区,土壤节肢动物的丰富度会随环境温度升高和分解底物增多而增加,进而加速凋落物的分解[98-99],有研究表明小型节肢动物的存在可增加高达50%的分解率[100]。然而,只有很少实验证明在亚热带地区也有同样的结论。在凋落物分解过程中,各型级土壤动物与微生物是相互协同的,多级土壤动物与微生物共存对分解的促进作用要高于单级土壤动物与微生物共存和只有微生物存在的情况[101]。Wang等[102]发现土壤动物丰富度沿着纬度梯度变化(8%—15%),而且这些土壤动物的活动与凋落物分解速率存在很高的相关性。高纬度地区相对适宜的温湿度环境能够促进真菌的生长从而增加食真菌土壤动物的数量进而加速凋落物分解[103]。由此可见,研究土壤动物对微生物的影响及其之间的交互作用有助于更好地理解凋落物分解对气候变暖的响应。
3 凋落物分解对全球变暖的反馈
凋落物经过分解作用一部分转化为有效养分供给植物生长,一部分以有机质的形式存在土壤中,而更多地会以CO2的形式释放到大气中。因此,凋落物对气候做出的反馈取决于积累与分解之间的平衡。在北方寒冷生物带上影响凋落物分解的因素对于增温处理会同时产生正反馈和负反馈效应。正反馈效应来自于温度对凋落物分解产生的直接影响,即增温将提高凋落物分解速率,因此在面对长期的温度升高影响下,会有大量来自于凋落物分解释放的碳输入到大气[104]。Salinas等在热带安第斯山和临近的亚马逊低地大尺度凋落物交互移植实验中发现,地区温度增加0.9℃提高了凋落物分解速率以及养分矿化率,同时土壤碳库含量增加了10%[105]。然而,凋落物所产生的负反馈效应会由于增温所诱导的植物生长型的改变而间接影响凋落物分解,即含有高质量、分解快的禾本植物和非禾本植物的凋落物被低质量、分解慢的灌木叶凋落物而取代,这样就减少了凋落物向大气输入的碳量以及土壤中支持植物生产养分的碳含量的释放,从而影响土壤碳库发生改变[106]。而这种负反馈效应可能会被正反馈效应部分抵消,因此在长期大尺度上对气候变暖和碳循环模型的建立上应将这些反馈效应考虑在内[107]。
全球气候变暖的长期作用使植物群落组成发生改变从而导致凋落物质量的变化,这一影响会通过土壤养分循环过程对气候变暖作出反馈。然而,目前已有的针对这一反馈环节的研究更多地是在植物-土壤系统层面上,通常忽略了微生物分解者对养分库大小的控制作用。Takeshi等[3]经模型研究发现,微生物群落会削弱地上植物群落变化控制土壤养分循环这一反馈过程。这是由于在一个封闭的环境下,存在着两类主要微生物类群,它们分别支持具有高分解力(易分解养分含量增多时)的凋落物与低分解力(难分解养分含量多时)的凋落物。那么微生物类群对于两种不同有机养分类型就会产生竞争,当遇到具有高分解力的凋落物时,由于其分解速率快,可以供给对其分解的微生物类群更多的养分,进而增加该种微生物类群的相对丰富度。而微生物群落组成的这一适应性变化在某种程度上改变了易分解有机养分和难分解有机养分的积累模式,从而削弱了凋落物分解力与养分库大小之间的反馈关系。由此可见,陆地生态系统对气候变暖的反馈研究建立在植物-微生物-土壤系统层面上则会更为有效地探明其内在机制。
4 问题与展望
4.1 重视多因子交互作用
由于控制和影响凋落物分解的生物因子和非生物因子众多。因此,单独研究每一个因子的作用往往忽略因子间的互作效应,不能综合全面地分析凋落物分解过程。自然条件下,凋落物分解过程受多因子的综合作用,探索多因素的分解模型可更为准确地预测凋落物分解速率及其对气候变化的反馈。比如,受水分限制的生态系统,增温处理对分解作用的影响可能是正向的,但是水分的限制却抵消了增温对分解作用的正效应[4]。
4.2 加强凋落物质量研究
经过已往的大量研究,人们已经认识到凋落物质量在影响分解速率和气候反馈上的重要性,但是对其影响机制众说纷纭。该方面的进一步研究需要侧重在诸多方面:(1)不同化学组分的特异性响应。比如,N组分、木质素以及木质化的纤维素含量和动态变化对在凋落物分解过程的调控;(2)凋落物物理特性。凋落物的物理特性对凋落物分解速率的影响同样很重要,但以往的相关研究不多;(3)化学组分的交互效应。C、N养分的交互作用是如何控制凋落物分解的,特别是要注重作为无机N源和C的有效性在凋落物分解中的作用。其他诸如P、Mn等元素对于分解过程也是不容忽视的;(4)重视不同分解阶段的研究。凋落物分解是一个较长时期的过程,分解速率随分解阶段而变化,不同分解阶段可能存在不同的分解机制,而人们对这些机制尚不清楚,这将限制凋落物分解对气候反馈机制的认知。
4.3 重视地下凋落物分解过程研究及其与地上凋落物分解过程的整合
地下凋落物分解是供给植物生长推动生态系统碳素循环的主要地下生态过程,也是土壤碳库的主要来源之一。然而,以往研究工作更多地侧重在地上凋落物分解过程,对地下凋落物分解作用相关知识的欠缺限制了地上与地下凋落分解过程研究的有效整合,以及对于二者对气候反馈机制的系统认知。
4.4 加强土壤分解者作用的研究
土壤生物(土壤动物和土壤微生物)是生态系统功能研究中最不确定的因素[19,108]。全球气候变化如何影响土壤生物群落,进而作用于凋落物分解过程,将是今后研究的重要方面之一。作者认为对凋落物分解气候反馈机制的研究,应将分解者纳入到传统的植物-土壤研究框架,在植物-分解者-土壤框架进行综合考虑,这将有助于更为准确地评估和预测分解过程对气候变化的响应和反馈。
4.5 重视分解者亚系统各营养级在影响凋落物分解过程的级联效应
不同营养级分解者在凋落物分解过程中相互关联,它们作为一个有机的整体对改善土壤条件,作用于凋落物分解各个环节。由于研究方法等方面的限制,即使人们已经认识其重要性,但已有的相关研究并不多,对气候变暖背景下凋落物分解的分解者营养级间的内在作用机制更少。因此,加强分解者亚系统各营养级在影响凋落物分解过程的级联效应研究有利于更好地估测凋落物分解对气候变化的响应和反馈机制。
4.6 大尺度跨区域分解实验和长期实验的重要性
长期以来,研究者们对于凋落物分解实验多开展于一定的气候带内,对于不同生态系统内不同气候带上的大尺度跨区分解试验研究相对较少[109-110],仍存在诸如实验规模小、凋落物分解持续时间短等问题。因此,未来应多重视在纬向热量梯度带内进行大尺度凋落物交互分解实验以及中高纬度地区凋落物分解过程的调控机理研究。
此外,开展长期的凋落物分解实验也是必要的。陆地生态系统组分,包括植物、土壤、土壤生物,对气候变暖的响应均存在长期效应。短期的凋落物分解实验结果很难应用于较长时间尺度上凋落物分解对气候变暖响应的认知。同时,已有的短期相关研究过于分散,方法难以统一,导致实验结果的差异性较大,很难进行横向比较。因此,开展长期大尺度跨区定位分解实验,采用统一的研究方法,对于分析全球陆地生态系统凋落物分解对气候变暖的特异性响应和反馈机制尤为重要。
[1]Intergovernmental Panel on Climate Change.Climate Change:Report of IPCC Scientific Group.Cambridge:IPCC,2001.
[2]Intergovernmental Panel on Climate Change.Climate Change:Report of IPCC Scientific Group.Canada:IPCC,2007.
[3]Cornelissen J H C,van Callaghan P M,Aerts R,Callaghan T V,van Logtestijn R S P,Alatalo J,Chapin F S,Gerdol R,Gudmundsson J,Gwynn-Jones D,Hartley A E,Hik D S,Hofgaard A,Jónsdóttir I S,Karlsson S,Klein J A,Laundre J,Magnusson,B,Michelsen,A,Molau U,Onipchenko V G,Quested H M,Sandvik S M,Schmidt I K,Shaver G R,Solheim,B,Soudzilovskaia N A,Stenström A,Tolvanen A,Totland Ø,Wada N,Welker J M,Zhao X Q,Team M O L.Global negative vegetation feedback to climate warming responses of leaf litter decomposition rates in cold biomes.Ecology Letters,2007,10(7):619-627.
[4]Aerts R.Climate,leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems:a triangular relationship.Oikos,1997,79,439-449.
[5]Zhao P W,Song C L,Su R N,Hai L,Zhou M,Wei J S,Wang S S.Review in the research of litter fall in forest ecosystems.Journal of Inner Mongolia Agricultural University:Natural Science Edition,2009,30(2):292-298.
[6]Ebermayer E.Die Gesammte Lehre der Waldstreu mit Rücksicht auf die Chemische Statik des Waldbaues.Berlin:Springer,1876.
[7]Xu Q F,Qian X B,Gui Z Y.Effects of litter decomposition of different stands on soil properties.Journal of Zhejiang Forestry College,1998,15(1):27-31.
[8]Yan E R,Wang X H,Zhou W.Characteristics of litter fall in relation to soil nutrients in mature and degraded evergreen broadleaved forests of Tiantong,East China.Journal of Plant Ecology,2008,32(1):1-12.
[9]Chen J L,Wu C L,Jiang Z L,Xu X J.Litter decomposition and phosphorus release in an oak forest ecosystem.Journal of Zhejiang Forestry College,2002,19(4):367-371.
[10]Mo J M,Xue J H,Fang Y T.Litter Decomposition and its responses to simulated N deposition for the major plants of Dinghushan forests in subtropical China.Acta Ecological Sinica,2004,24(7):1413-1420.
[11]Zhang D L,Mao Z J,Zhang L,Zhu S Y.Advances of enzyme activities in theprocessoflitterdecomposition.SCIENTIA SILVAE SINICAE,2006,42(1):105-109.
[12]Yang W Q,Deng R J,Zhang J.Forest litter decomposition and its responses to global climate change.Chinese Journal of Applied Ecology,2007,18(12):2889-2895.
[13]Chen H,Mark E H,Tian H Q.Effects of global change on litter decomposition in terrestrial ecosystems.Acta Ecologica Sinica,2001,21(9):1549-1563.
[14]Quested H M,Cornelissen J H C,Press M C,Callaghan T V,Aerts R,Trosien F,Riemann P,Gwynn-Jones D,Kondratchuk A,Jonasson S E.Litter Decomposition of sub-arctic plants with differing nitrogen economies:a functional role for hemiparasites?Ecology,2003,84(12):3209-3221.
[15]Cheng X L,Luo Y Q,Su B,Zhou X H,Niu S L,Sherry R,Weng E S,Zhang Q F.Experimental warming and clipping altered litter carbon and nitrogen dynamicsin a tallgrassprairie.Agriculture Ecosystems and Environment,2010,138(3/4):206-213.
[16]Ferreira V,Chauvet E.Future increase in temperature more than decrease in litter quality can affect microbial litter decomposition in streams.Oecologia,2011,167(1):279-291.
[17]Moore B,Braswell B H.Planetary metabolism:understanding the carbon cycle.AMBIO:A Journal of the Human Environment,1994,23(1):4-12.
[18]Wang Q B,Li L H,Bai Y F,Xing.X R.Effects of simulated climate change on the decomposition of mixed litter in three steppe communities.ActaPhytoecologicaSinica, 2000, 24(6):674-679.
[19]Rustad L E,Campbell J L,Marion G M,Norby R J,Mitchell M J,Hartley A E,Cornelissen J H C,Gurevitch J.A meta-analysis of the response of soil respiration,net nitrogen mineralization,and aboveground plant growth to experimental ecosystem warming.Oecologia,2001,126(4):543-562.
[20]Melillo J M,Aber J D,Muratore J F.Nitrogen and lignin control of hardwood leaf litter decomposition dynamics.Ecology,1982,63(3):621-626.
[21]Song C L,Yang D,Song G,Mao Y.Effect of nitrogen addition on decomposition of Calamagrostis angustifolia litters from freshwater marshes of Northeast China.Ecological Engineering,2011,37(10):1578-1582.
[22]Chergui H,Pattee E.The influence of season on the breakdown of submerged leaves.Archiv für Hydrobiologie,1990,120:1-12.
[23]González J M,Graça M A S.Conversion of leaf litter to secondary production by a shredding caddis-fly.Freshwater Biology,2003,48(9):1578-1592.
[24]Kang H, Freeman C.Soilenzyme analysisforleaflitter decomposition in GlobalWetlands.Communicationsin Soil Science and Plant Analysis,2009,40(21/22):3323-3334.
[25]Sjögersten S,Wookey PA.Decomposition of mountain birch leaf litter at the forest-tundra ecotone in the Fennoscandian mountains in relation to climate and soil conditions.Plant and Soil,2004,262(1/2):215-227.
[26]Verburg P S J,Van Loon W K P,Lükewille A.The CLIMEX soil-heating experiment:soil response after 2 years of treatment.Biology and Fertility of Soils,1999,28(3):271-276.
[27]O’Neill E G,Johnson D W,Ledford J,Todd D E.Acute seasonal drought does not permanently alter mass loss and nitrogen dynamics during decomposition of red maple(Acer rubrum L.)litter.Global Change Biology,2003,9(1):117-123.
[28]McHale P J,Mitchell M J,Bowles F P.Soil warming in a northern hardwood forest:trace gasfluxesand leaflitter decomposition.Canadian Journal of Forest Research,1998,28(9):1365-1372.
[29]Luxmoore R J,Hanson P J,Beauchamp J J,Joslin J D.Passive nighttime warming facility for forest ecosystems research.Tree Physiology,1998,18(8/9):615-623.
[30]Wang S J,Ruan H H,Wang B.Effects of soil microarthropods on plant litter decomposition across an elevation gradient in the Wuyi Mountains.Soil Biology& Biochemistry,2009,41(5):891-897.
[31]Hobbie S E.Temperature and plant species control over litter decomposition in Alaskan tundra.Ecological Monographs,1996,66(4):503-522.
[32]Robinson C H,Wookey P A,Parsons A N,Potter J A,Callaghan T V,Lee J A,Press M C,Welker J M.Responses of plant litter decomposition and nitrogen mineralisation to simulated environmental change in a high arctic polar semi-desert and a subarctic dwarf shrub heath.Oikos,1995,74(3):503-512.
[33]Shaw M R,Harte J.Control of litter decomposition in a subalpine meadow-sagebrush steppe ecotone under climate change.Ecological Applications,2001,11(4):1206-1223.
[34]Lin X W,Zhang Z H,Wang S P,Hu Y G,Xu G P,Luo C Y,Chang X F,Duan J C,Lin Q Y,Xu B Y,Wang Y F,Zhao X Q,Xie Z B.Response of ecosystem respiration to warming and grazing during the growing seasons in the alpine meadow on the Tibetan plateau.Agricultural and Forest Meteorology,2011,151(7):792-802.
[35]Austin A T.Differential effects of precipitation on production and decomposition along a rainfall gradient in Hawaii.Ecology,2002,83(2):328-338.
[36]Liski J,Nissinen A,Erhard M,Taskinen O.Climatic effects on litter decomposition from arctic tundra to tropical rainforest.Global Change Biology,2003,9(4):575-584.
[37]MeentemeyerV.Macroclimate and lignin controloflitter decomposition rates.Ecology,1978,59(3):465-472.
[38]Gholz H L,Wedin D A,Smitherma S M,Harmon M E,PartonW J.Long-term dynamics of pine and hardwood litter in contrasting environments:toward a global model of decomposition.Global Change Biology,2000,6(7):751-765.
[39]Sturm M,Schimel J,Michaelson G,Welker J M,Oberbauer S F,Liston G E,Fahnestock J,Romanovsky V E.Winter biological processes could help convertarctic tundra to shrubland.Bioscience,2005,55(1):17-26.
[40]Tape K,Sturm M,Racine C.The evidence for shrub expansion in Northern Alaska and the Pan-Arctic.Global Change Biology,2006,12(4):686-702.
[41]Callaghan T V,Bjorn L O,Chernov Y,Chapin T,Christensen T R,Huntley B,Ims R A,Johansson M,Jolly D,Jonasson S,Matveyeva N,Panikov N,Oechel W,Shaver G,Schaphoff S,Sitch S.Effects of changes in climate on landscape and regional processes,and feedbacks to the climate system.AMBIO:A Journal of the Human Environment,2004,33(7):459-468.
[42]Dorrepaal E,Cornelissen J H C,Aerts R,Wallen B,Van Logtestijn R S P.Are growth forms consistent predictors of leaf litter quality and decomposability acrosspeatlandsalong a latitudinal gradient?The Journal of Ecology,2005,93(4):817-828.
[43]Wu Z T,Dijkstra P,Koch GW,Peñuelas J,Hungate B A.Responses of terrestrial ecosystems to temperature and precipitation change:a meta-analysis of experimental manipulation.Global Change Biology,2010,17(2):927-942.
[44]Sullivan P F,Arens S J T,Chimner R A,Welker J M.Temperature and microtopography interact to control carbon cycling in a high arctic fen.Ecosystems,2008,11(1):61-76.
[45]Melillo J M,Steudler P A,Aber J D,Newkirk K,Lux H,Bowles F P,Catricala C,Magill A,Ahrens T,Morrisseau S.Soil warming and carbon-cycle feedbacks to the climate system.Science,2002,298(5601):2173-2176.
[46]Biasi C,Meyer H,Rusalimova O.Initial effects of experimental warming on carbon exchange rates,plant growth and microbial dynamics of a lichen-rich dwarf shrub tundra in Siberia.Plant and Soil,2008,307(1/2):191-205.
[47]American Geophysical Union.Increased Carbon Loss from Upland Tundra with Experimental Warming and Permafrost Degradation.Washington:AGU,2011.
[48]Kuster T M,Arend M,Bleuler P,Günthardt-Goerg M S,Schulin R.Water regime and growth of young oak stands subjected to airwarming and drought on two different forest soils in a model ecosystem experiment.Plant Biology,2013,15(S1):138-147.
[49]Hollister R D,Webber P J,Tweedie C E.The response of Alaskan arctictundrato experimentalwarming:differences between short-and long-term responses.Global Change Biology,2005,11(4):525-536.
[50]Walker M D,Wahren C H,Hollister R D,Henry G H R,Ahlquist L E,Alatalo J M,Bret-Harte M S,Calef M P,Callaghan T V,Carroll A B,Epstein H E,Jonsdottir I S,Klein J A,Magnusson B,Molau U,Oberbauer S F,Rewa S P,Robinson C H,Shaver G R,Suding K N.Plant community responses to experimental warming across the tundra biome.Proceedings of the National Academy of Sciences of the United States of America,2006,103(5):1342-1346.
[51]Yang H J,Wu M Y,Liu W X,Zhang Z,Zhang N L,Wan S Q.Community structure and composition in response to climate change in a temperate steppe.Global Change Biology,2011,17(1):452-465.
[52]Thomas R J,Asakawa N M.Decomposition of leaf litter from tropical forage grasses and legumes. Soil Biology and Biochemistry,1993,25(10):1351-1361.
[53]Fierer N,Craine J M,McLauchlan K,Schimel J P.Litter quality and the temperature sensitivity of decomposition.Ecology,2005,86(2):320-326.
[54]Day T A, Ruhland C T, Xiong F S.Warming increases aboveground plant biomass and C stocks in vascular-plantdominated Antarctic tundra.Global Change Biology,2008,14(8):1827-1843.
[55]Berg B,McClaugherty C.Plant Litter:Decomposition,Humus Formation,Carbon Sequestration.New York:Springer-Verlag,2008:286-286.
[56]Waldrop M P,Zak D R.Response of oxidative enzyme activities to nitrogen deposition affects soil concentrations of dissolved organic carbon.Ecosystems,2006,9(1):921-933.
[57]McCLAUGHERTY C A,PASTOR J,ABER J D & MELILLO J M.Forest litter decomposition in relation to soil nitrogen dynamics and litter quality.Ecology,1985,66:266-275.
[58]Fan P P.A New View on Decomposition Mechanisms and Derivation of Soil Organic Matter:Litter Decomposition of Chinese Forest[D].Beijing:Beijing University,2010.
[59]Ayres E,Dromph K M,Bardgett R D.Do plant species encourage soil biota that specialise in the rapid decomposition of their litter?Soil Biology and Biochemistry,2006,38(1):183-186.
[60]Smith V R.Moisture,carbon and inorganic nutrient controls of soil respiration at a sub-Antarctic island.Soil Biology& Biochemistry,2005,37(1):81-91.
[61]Bokhorst S,Huiskes A,Convey P,Aerts R.Climate change effects on organic matter decomposition rates in ecosystems from the Maritime Antarctic and Falkland Islands.Global Change Biology,2007,13(12):2642-2653.
[62]Bokhorst S,Huiskes A,Convey P,Van Bodegom P M,Aerts R.Climate change effects on soil arthropod communities from the Falkland Islands and the Maritime Antarctic.Soil Biology&Biochemistry,2008,40(7):1547-1556.
[63]Kennedy A D.Water as a limiting factor in the Antarctic terrestrial environment:a biogeographical synthesis.Arctic and Alpine Research,1993,25(4):308-315.
[64]Convey P,Pugh P J A,Jackson C,Murray A W,Ruhland C T,Xiong F S,Day T A.Response ofAntarctic terrestrial microarthropods to long-term climate manipulations.Ecology,2002,83(11):3130-3140.
[65]McGeoch M A,Le Roux P C,Hugo E A,Chown S L.Species and community responses to short-term climate manipulation:microarthropods in the sub-Antarctic.Austral Ecology,2006,31(6):719-731.
[66]Coulson S J,Hodkinson I D,Webb N R,Block W,Bale J S,Strathdee A T,Worland M R,Wooley C.Effects of experimental temperature elevation on high-arctic soil microarthropod populations.Polar Biology,1996,16(2):147-153.
[67]Usher M B,Bowring M F B.Laboratory studies of predation by the Antarctic miteGamasellus racovitzai(Acarina,Mesostigmata).Oecologia,1984,62(2):245-249.
[68]Webb N R,Coulson S J,Hodkinson I D,Block W,Bale JS,Strathdee A T.The effects of experimental temperature elevation on populations of cryptos-tigmatic mites in high Arctic soils.Pedobiologia,1998,42(4):298-308.
[69]Wall D H,Bradford M A,St John M G,Trofymow J A,Behan-Pelletier V,Bignell D E,Dangerfield M,Parton W J,Josef Rusek J,Voigt W,Wolters V,Gardel H Z,Ayuke F O,Bashford R,Beljakova O I,Bohlen P J,Brauman A,Flemming S,Henschel J R, JohnsonD L, Jones T H, KovarovaM,Kranabetter J M,Kutny L,Lin K C,Maryati M,Masse D,Pokarzhevskii A,Rahman H,Sabará M G,Salamon J A,Swift M J,Varela A,Vasconcelos H L,White D,Zou X M.Global decomposition experiment shows soil animal impacts on decomposition are climate-dependent.Global Change Biology,2008,14(11):2661-2677.
[70]GonzálezG, SeastedtT R.Soilfauna and plantlitter decomposition in tropical and subalpine forests.Ecology,2001,82(4):955-964.
[71]Bardgett R D,Freeman C,Ostle N J.Microbial contributions to climate change through carbon cycle feedbacks.International Society for Microbial Ecology,2008,2(8):805-814.
[72]Sardans J,Peñuuelas J,Estiarte M,Prieto P.Warming and drought alter C and N concentration,allocation and accumulation in a Mediterranean shrubland.Global Change Biology,2008,14(10):2304-2316.
[73]Deslippe J R,Ehher K N,Henry G H R.Impacts of warming and fertilization on nitrogen fixing microbial communities in the Canadian High Arctic.FEMS Microbiology Ecology,2005,53(1):41-50.
[74]Sinsabaugh R L.Enzymic analysis of microbial pattern and process.Biology and Fertility of Soils,1994,17(1):69-74.
[75]Das S,Bhattacharyya P,Adhya T K.Interaction effects of elevated CO2and temperature on microbial biomass and enzyme activities in tropical rice soils.Environmental Monitoring and Assessment,2011,182(1/4):555-569.
[76]Van Meeteren M J M,Tietema A,van Loon E E,Verstraten J M.Microbial dynamics and litter decomposition under a changed climate in a Dutch heathland.Applied Soil Ecology,2008,38(2):119-127.
[77]Inubushi K,Cheng W,Mizunoa T,Lou Y,Hasegawa T,Sakai H,Kobayashi K.Microbial biomass carbon and methane oxidation influenced by rice cultivars and elevated CO2in a Japanese paddy soil.European Journal of Soil Science,2011,62(1):69-73.
[78]Gutknecht J L M.Exploring Long-Term Microbial Responses to Simulated GlobalChange [D].Madison:University of Wisconsin,2007.
[79]Rinnan R,Sari S,Tolvanen A.Responses of vegetation and soil microbial communities to warming and simulated herbivory in a subarctic heath.Journal of Ecology,2009,97(4):788-800.
[80]Schimel J,Balser T C,Wallenstein M.Microbial stress-response physiology and its implications for ecosystem function.Ecology,2007,88(6):1386-1394.
[81]Hyvonen R,Agren G I,Dalias P.Analysing temperature response of decomposition of organic matter.Global Change Biology,2005,11(5):770-778.
[82]Schmidt I K,Jonasson S,Shaver G R,Michelsen A,Nordin A.Mineralization and distribution of nutrients in plants and microbes in four arctic ecosystems:responses to warming.Plant and Soil,2002,242(1):93-106.
[83]Jonasson S,Castro J,Michelsen A.Litter,warming and plants affect respiration and allocation of soil microbial and plant C,N and P in arctic mesocosms.Soil Biology and Biochemistry,2004,36(7):1129-1139.
[84]Bardgett R D,Bowman W D,Kaufmann R,Schmidt S K.Atemporal approach to linking aboveground and belowground.Ecology Trends in Ecology and Evolution,2005,20(11):634-641.
[85]Qiu E F,Chen Z M,Zhen Y S,Hong W,Huang B L.Dynamics of litterfall and its decomposition and nutrient return of shoot-used Dendrocalamus latiflorus in Mountainous areas of Fujian Province.Chinese Journal of Applied Ecology,2005,16(5):811-814.
[86]Peng S L,Liu Q.The dynamics of forest litter and its responses to global warming.ActaEcologicaSinica, 2002, 22 (9):1534-1544.
[87]Deslippe J R,Hartmann M,Simard S W,Mohn W W.Long-term warming alters the composition of Arctic soul microbial communities.FemsMicrobiologyEcology, 2012, 82(2):303-315.
[88]Shaver G R,Giblin A E,Nadelhoffer K J,Thieler K K,Downs M R,Laundre J A,Rastetter E B.Carbon turnover in Alaskan tundra soils:effects of organic matter quality, temperature,moisture and fertilizer.Journal of Ecology,2006,94(4):740-753.
[89]Rinnan R,Michelsen A,Bååth E.Long-term warming of a subarctic heath decreases soil bacterial community growth but has no effects on its temperature adaptation.Applied Soil Ecology,2011,47(3):217-220.
[90]Dang CK,Schindler M,Chauvet E,Gessner M O.Temperature oscillation coupled with fungal community shifts can modulate warming effects on litter decomposition.Ecology,2009,90(1):122-131.
[91]Takeshi M,Masayuki U,Shin F,Michio K.Functional diversity of microbial decomposers facilitates plant coexistence in a plantmicrobe-soil feedback model.Proceedings of the National Academy of Sciences of the United States of America,2010,107(2):14251-14256.
[92]Berg B,Laskowski R.Decomposers:soil microorganisms and animals.Advances in Ecological Research,2005,38:73-100.
[93]Wardle D A.The influenceofbioticinteractionson soil biodiversity.Ecology Letters,2006,9(7):870-886.
[94]Ernst G,Henseler I,Felten D,Emmerling C.Decomposition and mineralization of energy crop residues governed by earthworms.Soil Biology and Biochemistry,2009,41(7):1548-1554.
[95]Seeber J,Seeber G U H,Langel R,Scheu S,Meyer E.The effect of macro-invertebrates and plant litter of different quality on the release of N from litter to plant on alpine pastureland.Biology and Fertility of Soils,2008,44(5):783-790.
[96]Lavelle P,Spain A V.Soil Ecology.Amsterdam:Kluwer Scientific Publications,2001:149-153.
[97]Postma-Blaauw M B,de Goede R G M,Bloem J,Faber J H,Brussaard L.Soil biota community structure and abundance under agricultural intensification and extensification.Ecology,2010,91(2):460-473.
[98]Ruan H H,Li Y Q,Zou X M.Soil communities and plant litter decomposition as influenced by forest debris:variation across tropical riparian and upland sites.Pedobiologia,2005,49(6):529-538.
[99]González G,Ley R E,Schmidt S K,Zou X M,Seastedt T R.Soil ecological interactions:comparisons between tropical and subalpine forests.Oecologia,2001,123(4):549-556.
[100]Sayer E J, Tanner E V J, Lacey A L.Effects of litter manipulation on early-stage decomposition and meso-arthropod abundance in atropicalmoistforest.ForestEcologyand Management,2006,229(1/3):285-293.
[101]Yin X Q,Zhong W Y,Wang H X,Chen P.Decomposition of forest defoliation and role of soil animals in XiaoHinggan Mountains.Geographical Research,2002,21(6):689-699.
[102]Ke X,Zhao L J,Yin W Y.Succession in communities of soil animals during leaf litter decomposition in Cyclobalanopsis glauca forest.Zoological Research,1999,20(3):207-213.
[103]Levings S C,Windsor D M.Seasonal and annual variation in litter arthropod populations//Leigh E G Jr,Rand A S,Windsor D M,eds.The Ecology of a Tropical Forest.Oxford:Oxford University Press,1996:355-387.
[104]Hobbie S E,Schimel J P,Trumbore S E,Randerson J R.Controls over carbon storage and turnover in high latitude soils.Global Change Biology,2001,6(S1):196-210.
[105]Salinas N,Malhi Y,Meir P,Silman M,Roman Cuesta R,Huaman J,Salinas D,Huaman V,Gibaja A,Mamani M,Farfan F.The sensitivity of tropical leaf litter decomposition to temperature:results from a large-scale leaftranslocation experiment along an elevation gradient in Peruvian forests.New Phytologist,2011,189(4):967-977.
[106]Shaver G R,Canadell J,Chapin F S,Gurevitch J,Harte J,Henry G,Ineson P,Jonasson S,Melillo J,Pitelka L,Rustad L.Globalwarming and terrestrialecosystems:a conceptual framework for analysis.Bioscience,2000,50(10):871-882.
[107]Sitch S,Smith B,Prentice I C,Arneth A,Bondeau A,Cramer W,Kaplan J O,Levis S,Lucht W,Sykes M T,Thonicke K,Venevsky S.Evaluation of ecosystem dynamics,plant geography and terrestrialcarbon cyclingin the LPJdynamicglobal vegetation model.Global Change Biology, 2003, 9(2):161-185.
[108]He J S,Wang Z Q,Fang J Y.Issues and prospects of belowground ecology with special reference to global climate change.Chinese Science Bulletin,2004,49(18):1891-1899.
[109]Bryant D M,Holland E A,Seastedt T R,Walker M D.Analysis of litter decomposition in an alpine tundra.Canadian Journal of Botany,1998,76(7):1295-1304.
[110]Xu G L,Mo J M,Zhou G Y,Xue J H.Litter decomposition under N deposition in Dinghushan forests and its relationship with soil fauna.Ecology and Environment,2005,14(6):901-907.
参考文献:
[5]赵鹏武,宋彩玲,苏日娜,海龙,周梅,魏江生,王树森.森林生态系统凋落物研究综述.内蒙古农业大学学报:自然科学版,2009,30(2):292-298.
[7]徐秋芳,钱新标,桂祖云.不同林木凋落物分解对土壤性质的影响.浙江林学院学报,1998,15(1):27-31.
[8]阎恩荣,王希华,周武.天童常绿阔叶林不同退化群落的凋落物特征及与土壤养分动态的关系.植物生态学报,2008,32(1):1-12.
[10]莫江明,薛碌花,方运霆.鼎湖山主要森林植物凋落物分解及其对N沉降的响应.生态学报,2004,24(7):1413-1420.
[11]张东来,毛子军,张玲,朱胜英.森林凋落物分解过程中酶活性研究进展.林业科学,2006,42(1):105-109.
[12]杨万勤,邓仁菊,张健.森林凋落物分解及其对全球气候变化的响应.应用生态学报,2007,18(12):2889-2895.
[58]范萍萍.分解机制和土壤有机质形成的新认识——中国森林根叶分解研究[D].北京:北京大学,2010.
[85]邱尔发,陈卓梅,郑郁善,洪伟,黄宝龙.麻竹山地笋用林凋落物发生、分解及养分归还动态.应用生态学报,2005,16(5):811-814.
[86]彭少麟,刘强.森林凋落物动态及其对全球变暖的响应.生态学报,2002,22(9):1534-1544.
[108]贺金生,王政权,方静云.全球变化下的地下生态学:问题与展望.科学通报,2004,49(13):1226-1233.
[101]殷秀琴,仲伟彦,王海霞,陈鹏.小兴安岭森林落叶分解与土壤动物的作用.地理研究,2002,21(6):689-699.
