不同氮源对骨条藻光合活性、生长和中性脂积累的影响
2014-05-08付宝龙潘光华朱大玲才金玲张宝玉
付宝龙,潘光华,朱大玲,才金玲,张宝玉
(1. 天津科技大学海洋科学与工程学院,天津 300457;2. 中国科学院海洋研究所,青岛 266071)
中国拥有近 300万平方千米海域,海岸线长达32,000千米,海洋藻类资源丰富,尤其是海洋微藻资源.这些微藻是海洋初级生产力,为其他海洋生物提供食物来源,维持近海生态系统.然而,一旦近海发生富营养化,某些微藻会出现短时间内的爆发性增长,形成赤潮,造成严重的生态灾难.因此,研究赤潮微藻的生物学特性、揭示其快速增殖的机制、解释赤潮产生的原因是目前研究的热点.如果从另外的视角来看赤潮微藻,是否可以利用赤潮微藻的快速增殖,为人类解决能源问题,则是一个值得高度关注的研究课题.
赤潮微藻主要集中在甲藻、硅藻、针胞藻和定鞭藻等门类中,其中以甲藻类和硅藻类所占的种类最多[1].一般微藻的细胞中均含有油脂,但不同微藻的油脂含量有明显差异,甚至同一种的不同品系也存在着很大差别,油脂含量较高的微藻主要集中于绿藻、硅藻、金藻等真核微藻中[2].目前,微藻生物能源的研究主要集中在绿藻和硅藻上[3],其中骨条藻属的中肋骨条藻是一种常见的硅藻属赤潮藻,具有很高的油脂含量(14%~51%)[4],同时作为海产动物养殖中虾蟹的饵料,其培养技术已经相当成熟,有一定的培养规模;但是,以骨条藻作为生产生物能源的原料,关注其油脂积累过程和油脂含量提高的研究还不多见.因此,本实验研究了培养液中以不同浓度的硝酸钠、氯化铵和尿素作为氮源对骨条藻的光合活性、生长和中性脂积累的影响,希望能够为生产生物能源的大规模培养提供经验.
1 材料与方法
1.1 实验材料与培养方法
骨条藻采集自天津塘沽河口水域,经本实验室分离纯化并进行形态学和分子生物学鉴定.
微藻在实验室的光照培养箱中进行培养,培养温度为(20±1)℃,光照度为 5,000,lx,光/暗周期为12,h/12,h,每个150,mL三角瓶中培养100,mL藻液,所用培养基为人工海水配制的 f/2培养基[5],单藻种静置培养,培养周期为 8,d.实验采用 3种氮源分别为硝酸钠、氯化铵和尿素,以 f/2培养基的标准氮源浓度 8.8×10-4,mol/L 为基准,按照 1/100、1/50、1/20、1/10、1/5、1/2和标准f/2设定氮源浓度由低到高依次为 8.8×10-6、1.8×10-5、4.4×10-5、8.8×10-5、1.8×10-4、4.4×10-4、8.8×10-4,mol/L.
1.2 分析方法
1.2.1 光合活性的测定
本实验使用IMAGING–PAM型调制脉冲荧光仪(德国 Heinz Walz GmbH 公司),利用调制叶绿素荧光技术(pulse amplitude modulation,PAM),测量样品的叶绿素荧光参数来反映藻细胞的光合活性[6].具体方法为:每瓶藻液各取250,µL分别加到96孔板的3个孔内,使用 IMAGING–PAM 型调制脉冲荧光仪测量样品的潜在最大光合效率 Fv/Fm和实际光合效率Y(Ⅱ).每个样品在测定前暗适应 15,min.设定光合有效辐射(photosynthetically active radiation,PAR)为24,µmol/(m2·s).
1.2.2 生长测定
对处于指数生长末期的骨条藻的藻液进行500~750,nm 的吸光度光谱扫描,发现在 655,nm 处有1个吸光度低峰,680,nm处有1个吸光度高峰(叶绿素 a的吸收峰).由于不同氮源浓度会对骨条藻的叶绿素a的含量产生影响,而 655,nm处的吸光度是整个吸收光谱的最低点,该点处光吸收值受色素含量影响最小,可以看作仅与藻体细胞密度相关,因此选择 655,nm处的吸光度来测量骨条藻的生长.测定藻液在 655,nm 下的吸光度,藻细胞数用血球计数板计数,根据多次实验得到的回归方程 Y=22.94×A655+0.032,3(R2=0.999,9)计算细胞密度 Y(106,mL–1).
1.2.3 油脂测定
前人的研究结果[7]表明,经尼罗红染色后的微藻在 480,nm光激发下,位于 580,nm左右的荧光峰的相对荧光强度与称质量法测定的油脂含量呈线性正相关.因此,对处于指数生长末期的骨条藻的藻液使用 Hitachi F–4500型荧光分光光度计(日本日立公司)进行 500~750,nm 扫描,确定骨条藻尼罗红染色的荧光峰在575,nm.
对不同浓度下藻细胞在该荧光峰的相对荧光强度进行测定,同时用称质量法测定各个样品的油脂含量,可以得出该荧光峰的相对荧光强度与藻细胞的油脂含量的关系式.具体方法为:1,mL藻液加 0.01,mL尼罗红染料(丙酮溶解,质量浓度为 0.1,g/L)染色20,min后,使用 Hitachi F-4500型荧光分光光度计,以 480,nm 光激发,测定 500~750,nm 荧光发射光谱,以确定特殊荧光峰,再以该荧光峰的荧光强度减去藻细胞在该波长处的自身荧光强度和尼罗红在该波长处的荧光强度,得到相对荧光强度.通过该荧光峰的相对荧光强度与藻细胞的油脂含量的关系式可得到细胞中油脂的含量.
1.2.4 数据处理
用SPSS 17.0软件对数据进行单因素方差分析.使用Origin 8.0软件计算平均值和标准偏差.
2 结果与分析
2.1 不同浓度的3种氮源对骨条藻光合活性的影响
图 1—图 6是 3种氮源对骨条藻 Fv/Fm和Y(Ⅱ)的影响.从图中可以看出,各组的 Fv/Fm 和Y(Ⅱ)在接种后第 1天都有所升高,同时能正常生长的氮源种类相同的各组之间的差距不大,表明此时培养基中的营养盐充足,骨条藻的光合活性正常.随着培养的进行,各组的Fv/Fm和Y(Ⅱ)都出现了下降,氮源浓度越低下降的速度越快.在第 7天时,3种氮源都只有浓度为 4.4×10-4,mol/L和 8.8×10-4,mol/L的两组的 Fv/Fm 和 Y(Ⅱ)能被测出,表明随着氮源的消耗,各组的光合活性都受到了抑制.在第 6、7天,氯化铵组后两组的 Fv/Fm 和 Y(Ⅱ)都高于硝酸钠组和尿素组后两组的Fv/Fm和Y(Ⅱ).在第8天时,硝酸钠组和尿素组后两组的 Fv/Fm 和 Y(Ⅱ)都出现了上升,而氯化铵组后两组的 Fv/Fm 和 Y(Ⅱ)则持续下降,表明硝酸钠组和尿素组中开始有部分藻细胞死亡,释放了一些氮源,而氯化铵组则能继续保持生长.因此,氯化铵是比较适合骨条藻生长的氮源.
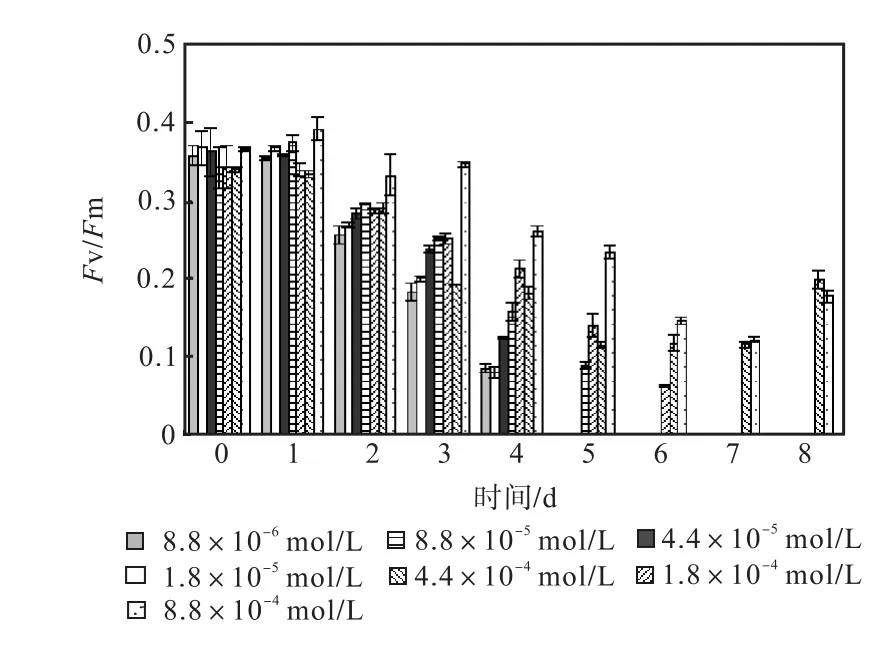
图1 硝酸钠对骨条藻Fv/Fm的影响Fig.1 Effect of NaNO3 on Fv/Fm of Skeletonema
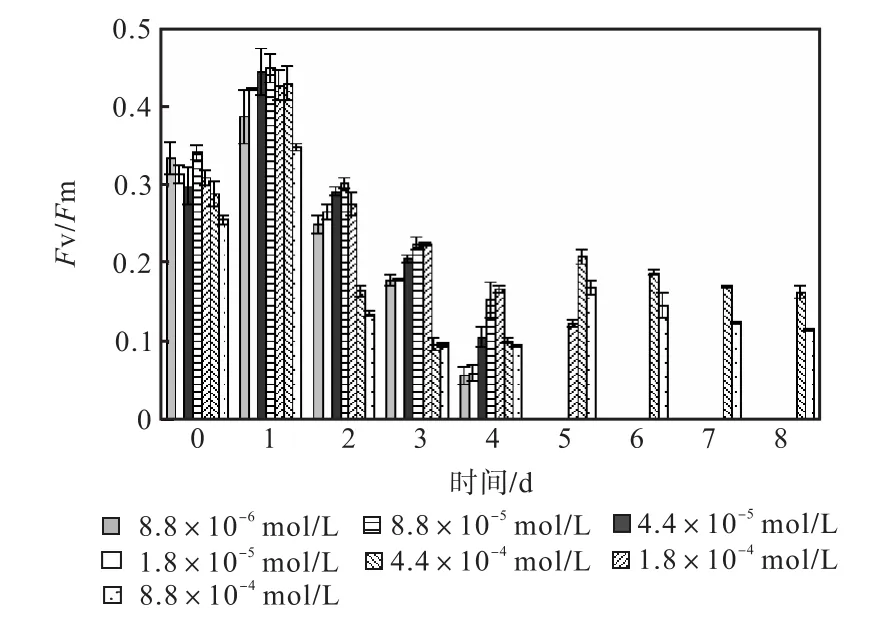
图3 氯化铵对骨条藻Fv/Fm的影响Fig.3 Effect of NH4Cl on Fv/Fm of Skeletonema

图5 尿素对骨条藻Fv/Fm的影响Fig.5 Effect of urea on Fv/Fm of Skeletonema
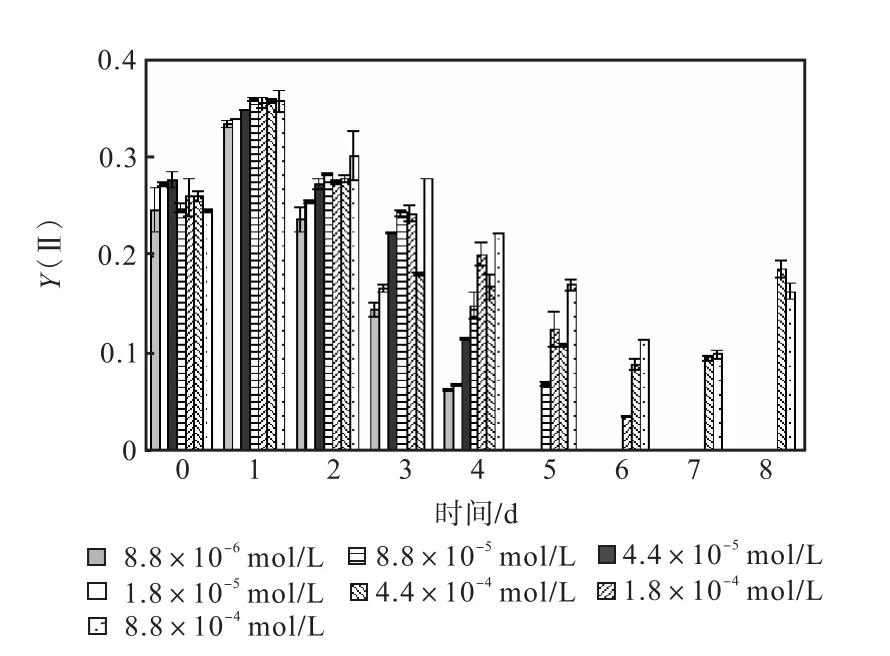
图2 硝酸钠对骨条藻Y(Ⅱ)的影响Fig.2 Effect of NaNO3 on Y(Ⅱ)of Skeletonema
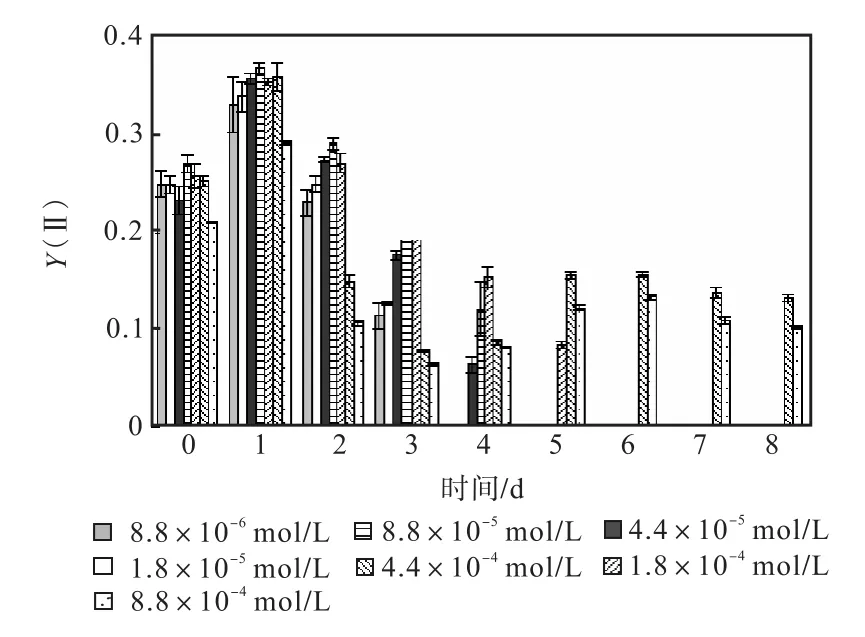
图4 氯化铵对骨条藻Y(Ⅱ)的影响Fig.4 Effect of NH4Cl on Y(Ⅱ)of Skeletonema
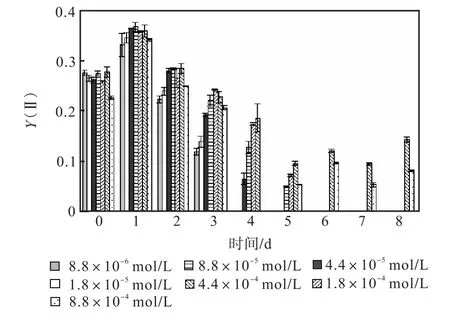
图6 尿素对骨条藻Y(Ⅱ)的影响Fig.6 Effect of urea on Y(Ⅱ)of Skeletonema
2.2 不同氮源最适合骨条藻生长的浓度确定
各组的骨条藻在第1天的生长速度最快,除了氮浓度最高的 8.8×10-4,mol/L的氯化铵和尿素外,其他各组生物量的增长都超过110%.这与藻细胞的光合活性在第1天的升高表现一致,表明此时培养基中的营养充足,适合骨条藻的生长.而骨条藻在氮浓度为8.8×10-4,mol/L 尿素中的生长好于氮浓度为 8.8×10-4mol/L氯化铵,则表明高浓度的氯化铵对骨条藻生长的抑制比高浓度的尿素强.能正常生长的各组氮源浓度的最大生物量基本都出现在第8天,其中氯化铵组的生长是最好的,其次是尿素组,最后的是硝酸钠组,3种氮源中生长最好的都是氮浓度为 4.4×10-4,mol/L,这与整个培养过程中藻细胞的光合活性的表现是一致的.
3种氮源的最大生物量的比较如图7所示,硝酸钠组和尿素组的最大生物量与氯化铵组都有极显著差异(P<0.01),硝酸钠组的最大生物量与尿素组有显著差异(P<0.05).因此,可以确定最适合骨条藻生长的氮源是氯化铵,其次是尿素,最后的是硝酸钠,3种氮源的最适氮浓度都是4.4×10-4,mol/L.
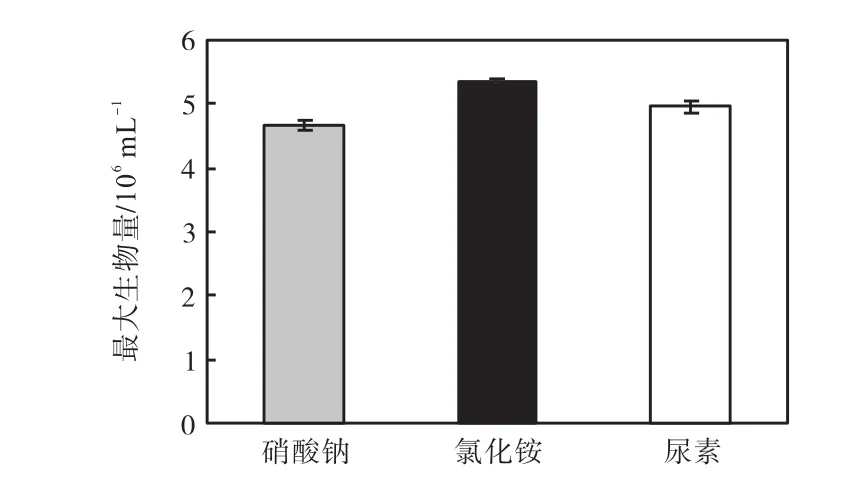
图7 不同氮源最适合骨条藻生长的浓度下的最大生物量Fig.7 Maximum biomass of Skeletonema at the optimum concentration of different nitrogen sources for its growth
2.3 不同浓度的3种氮源对骨条藻中性脂积累的影响
2.3.1 不同浓度硝酸钠对骨条藻中性脂积累的影响
图 8和图 9是培养过程硝酸钠组各组的中性脂积累的过程.前 4,d各组每 106个细胞的尼罗红染色相对荧光强度基本保持稳定,在第 5天,氮浓度较低的前5组的荧光强度开始出现增长,基本表现为氮源浓度越低的荧光强度越强.在第 7天各组的荧光强度都出现了大幅度的增长,在第 8天即出现了下降.其中 1,mL藻液的尼罗红染色相对荧光强度是藻细胞中油脂总量的指标,而 106个细胞的尼罗红染色相对荧光强度则是藻细胞中油脂百分含量的指标,两者的最高值都出现在第 7天起始氮浓度为 1.8×10-4,mol/L的藻液,按照 106个细胞的尼罗红染色相对荧光强度与藻细胞的油脂含量关系式得出其油脂含量为28.46%.

图8 硝酸钠对骨条藻 1,mL藻液尼罗红染色相对荧光强度的影响Fig.8 Effect of NaNO3 on the relative fluorescence values of 1,mL Skeletonema solution stained with Nile red

图9 硝酸钠对骨条藻 106个细胞尼罗红染色相对荧光强度的影响Fig.9 Effect of NaNO3 on the relative fluorescence values of 106 algae cells of Skeletonema stained with Nile red
2.3.2 不同浓度的氯化铵对骨条藻中性脂积累的影响
图 10和图 11是培养过程氯化铵组各组的中性脂积累的过程.前 4,d各组106个细胞的尼罗红染色相对荧光强度基本保持稳定,在第 5天,氮浓度较低的前5组的荧光强度同样开始出现增长,荧光强度与氮源浓度的负相关关系比硝酸钠组更明显.同样在第7天各组的荧光强度都出现了大幅度的增长,在第8天即出现了下降.其中 1,mL藻液和 106个细胞的尼罗红染色相对荧光强度最高的都是起始氮浓度为8.8×10-6,mol/L的藻液第 7天的值,按照 106个细胞的尼罗红染色相对荧光强度与藻细胞的油脂含量关系式得出其油脂含量为31.07%.

图10 氯化铵对骨条藻 1,mL藻液尼罗红染色相对荧光强度的影响Fig.,10 Effect of NH4Cl on the relative fluorescence values of 1,mL Skeletonema solution stained with Nile red
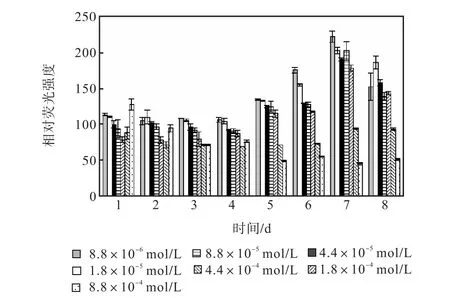
图11 氯化铵对骨条藻 106个细胞尼罗红染色相对荧光强度的影响Fig.,11 Effect of NH4Cl on the relative fluorescence values of 106 algae cells of Skeletonema stained with Nile red
2.3.3 不同浓度的尿素对骨条藻中性脂积累的影响
图 12和图 13是培养过程中尿素组各组的中性脂积累的过程.前 5,d各组 106个细胞的尼罗红染色相对荧光强度基本保持稳定,在第 6天,氮浓度较低的前5组的荧光强度开始出现增长,荧光强度与氮源浓度同样呈负相关关系.在第 7天各组的荧光强度都出现了大幅度的增长,在第 8天即出现了下降.其中1,mL藻液和106个细胞的尼罗红染色相对荧光强度最高的都是起始氮浓度为1.8×10-5,mol/L的藻液第7天的值,按照 106个细胞的尼罗红染色相对荧光强度与藻细胞的油脂含量关系式得出其油脂含量为27.99%.
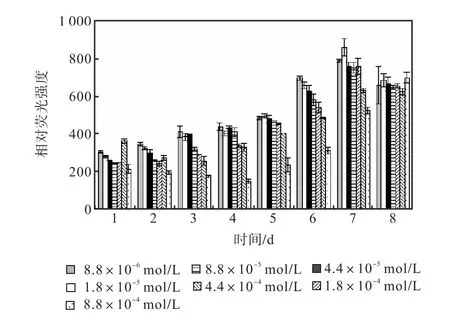
图12 尿素对骨条藻1,mL藻液尼罗红染色相对荧光强度的影响Fig.,12 Effect of urea on the relative fluorescence values of 1,mL Skeletonema solution stained with Nile red
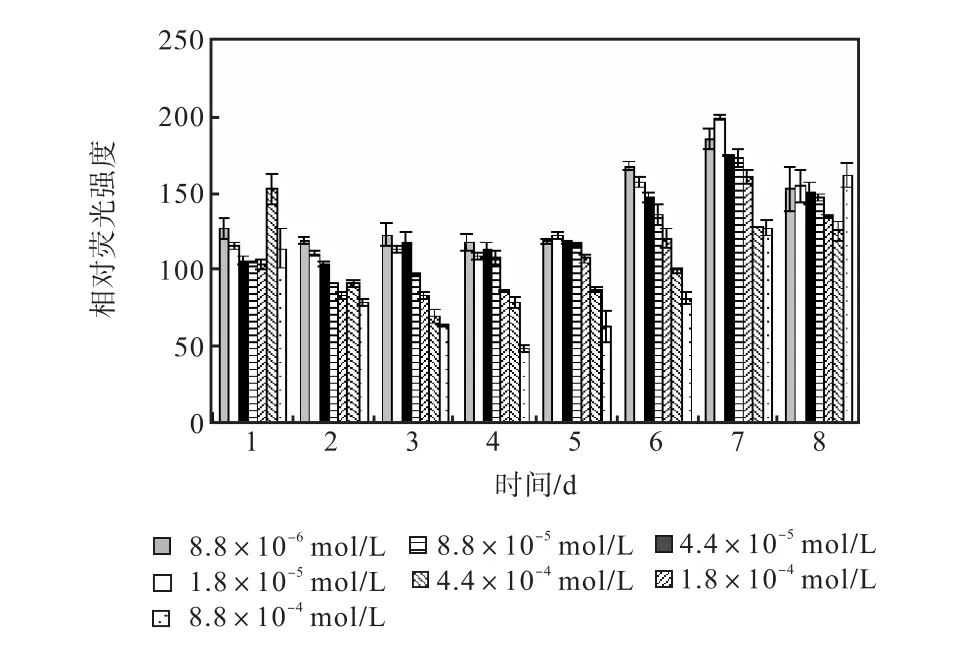
图13 尿素对骨条藻 106个细胞尼罗红染色相对荧光强度的影响Fig.,13 Effect of urea on the relative fluorescence values of 106 algae cells of Skeletonema stained with Nile red
2.3.4 综合分析
3种氮源组中出现的1,mL藻液和 106个细胞尼罗红染色相对荧光强度如图14所示.
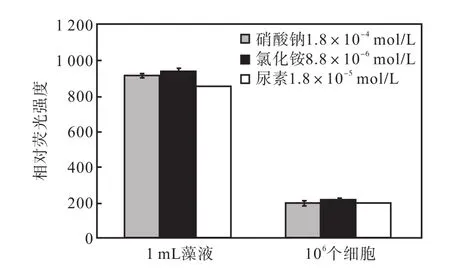
图14 最适合油脂积累的氮浓度下3种氮源1,mL藻液和106个细胞尼罗红染色相对荧光强度Fig.,14 Effect of three nitrogen sources at the optimum concentration on the relative fluorescence values of 1,mL algae solution and 106 algae cells staoned with Nile red
1,mL藻液的尼罗红染色相对荧光强度表示油脂总量,106个细胞尼罗红染色相对荧光强度可以计算出油脂的含量.可以看出,氯化铵的两项值都是最高的,同时,所用的氮源量也是最低的,因此氯化铵是最适合骨条藻中性脂积累的氮源.
3 讨 论
氮是浮游植物细胞内蛋白质、核酸、磷脂和叶绿素等的基本元素,在浮游植物生命活动中占有重要的地位.海水中的无机氮主要包括-N和-N,它们是能被海洋浮游植物直接利用的氮源,而尿素在有机氮源中是研究比较广泛的一种[8–9].通常认为浮游植物最先吸收-N,与细胞内碳水化合物衍生的酮酸通过转氨基作用直接合成氨基酸;而-N和-N则必须经过相应的硝酸还原酶和亚硝酸还原酶还原成-N[10].在大多数情况下,甚至当氧化态氮源(如-N 和-N)更充足的时候,浮游植物更倾向于利用还原态氮源(-N和尿素)[11],藻细胞蛋白质中的氮呈还原态,利用或者有机态的氮源显然比利用硝酸钠中高氧化态的要经济.同时,对的吸收,能引起培养液中 pH 的下降,可以缓冲因光合作用而导致的藻液 pH上升,有利于藻类的生长[12].而尿素除了能为微藻的生长提供氮源外,还能够提供碳源.因此,在3种氮源中,氯化铵是最适合骨条藻生长的氮源,尿素次之,硝酸钠最后.
当营养盐总水平足以满足浮游植物生长时,海洋浮游植物的氮磷吸收比例基本上是遵循 Redfield比值N∶P=16∶1,因此常用此比值来判断浮游植物营养盐的相对受限情况[13].当N/P<16时,表明氮相对不足,N/P>16时,表明磷相对不足.3种氮源最适合骨条藻生长的氮起始浓度都是 4.4×10-4mol/L,这时培养液中的氮磷比是13.74∶1,稍低于Redfield比值N∶P=16∶1,表明处于缺氮状态,但能满足骨条藻生长的需要;当氮浓度达到 8.8×10-4,mol/L时,培养液中的氮磷比是27.48∶1,此时限制骨条藻生长的是磷元素.藻细胞利用-N作为氮源是不经济的,同时,过高浓度的和尿素对藻类是有毒的[12].因此,过高的3种氮源浓度对骨条藻的生长并无促进作用,甚至会抑制骨条藻的生长.
Spoehr和 Mihier[14]最早证明,氮缺乏可诱导Chiorella pyrenoidosa中脂类含量的增加,该现象后来在许多其他藻类中得到了证实.到目前为止,氮缺乏诱导脂类积累的相关机制还不清楚.微藻合成油脂大体上可以分为两个阶段,即细胞增殖期和油脂积累期,细胞增殖期是微藻消耗培养基中的氮源,合成蛋白质,以保证藻体细胞代谢旺盛;接着藻体细胞开始大量消耗碳、氮源,并合成积累大量的油脂[15].低氮培养基中的骨条藻基本都是在第 5天进入油脂积累期,随着培养时间的增加,氮源逐渐被消耗殆尽,细胞依次进入氮饥饿的状态,细胞内的蛋白质合成代谢受到抑制而降低,相对的细胞内油脂的合成得到了加强,在一定程度上也会提高微藻细胞的油脂含量[16].因此,骨条藻的中性脂大量积累出现在培养后期.但当培养到第 8天时,培养基中的各种营养元素均被大量消耗,无法为细胞的各种代谢过程提供充足的营养,使得细胞开始消耗自身的脂类维持生物量的稳定,导致了细胞内油脂含量的降低.骨条藻是一种赤潮藻,有增殖快、衰退也快的特点,因此要利用它的脂类,需要选择合适的采收时间.
4 结 论
最适合骨条藻的氮源是氯化铵,其次是尿素,最后是硝酸钠,3种氮源最适合骨条藻生长的氮浓度都是 4.4×10-4,mol/L.最适合骨条藻中性脂积累的氮源是氯化铵,其最适浓度为 8.8×10-6,mol/L,其次是尿素,其最适浓度为 1.8×10-5,mol/L,最后是硝酸钠,其最适浓度为 1.8×10-4,mol/L.在高接种量(106,mL-1)、使用 f/2培养基的条件下,不同浓度的氮源条件下骨条藻的最终生物量差距不大,通过调节氮源浓度可以使中性脂的积累量大幅度上升,油脂总量的高低与百分含量的高低基本一致.同时,氯化铵也是一种容易获得的肥料,因此,用骨条藻生产生物能源,以氯化铵作为氮源是最适合的.
[1] 邹景忠. 赤潮生物与赤潮灾害研究[M]//曾呈奎. 中国海洋科学研究与开发. 青岛:青岛出版社,1992:284-287.
[2] Hu Qiang,Sommerfeld M,Jarvis E,et al. Microalgal triacyl glycerols as feedstocks for biofuel production:Perspectives and advances[J]. The Plant Journal,2008,54(4):621-639.
[3] Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances,2007,25(3):294-306.
[4] Mata T M,Martins A A,Caetano N S. Microalgae for biodiesel production and other applications:A review[J].Renewable and Sustainable Energy Reviews,2010,14(1):217-232.
[5] Guillard R R L,Ryther J H. Studies of marine planktonic diatom. I. Cyclotella nana Hustedt,and Detonula confervacea(cleve)Gran[J]. Canadian Journal of Microbiology,1962,8(2):229-239.
[6] Krause G H,Weis E. Chlorophyll fluorescence and photosysthesis:The basis[J]. Annual Review Plant Physiology and Plant Molecular Biology,1991,42:313-349.
[7] Cooksey K E,Guckert J B,Williams S A,et al. Fluorometric determination of the neutral lipid content of microalgal cell using Nile Red[J]. Journal of Microbiological Methods,1987,6(6):333-345.
[8] Storm S L,Bright K J. Inter-strain differences in nitrogen use by the coccolithophore Emiliania huxleyi,and consequences for predation by a planktonic ciliate[J]. Harmful Algae,2009,8(5):811-816.
[9] Glibert P M,Trice T M,Michael B,et al. Urea in the tributaries of the Chesapeake and Coastal Bays of Maryland[J]. Water,Air and Soil Pollution,2005,160(1/2/3/4):229-243.
[10]Berges J A,Mulholland M R. Enzymes and Nitrogen Cycling[M]// Capone D G,Bronk D A,Mulholland M R,et al. Nitrogen in the Marine Environment. Elsevier Press,2008:1385-1444.
[11]Fan C,Glibert P M,Alexander J,et al. Characterization of urease activity in three marine phytoplankton species,Aureococcus anophagefferens,Prorocentrum minimum,and Thalassiosira weissflogii[J]. Marine Biology,2003,142(5):949-958.
[12]滕亚娟. 不同氮源对骨条藻生长的影响[J]. 水利渔业,2006,26(4):55-57.
[13]Redfield A C. The biological control of chemical factors in the environment[J]. American Scientist,1958,46(3):205-222.
[14]Spoehr H A,Milner H W. The chemical composition of Chlorella;effect of environmental conditions[J]. Plant Physiology,1949,24(1):120-149.
[15]薛飞燕,张栩,谭天伟. 微生物油脂的研究进展及展望[J]. 生物加工过程,2005,3(1):23-28.
[16]缪晓玲. 藻类可再生能源的利用及藻细胞抗环境胁迫的研究[D]. 北京:清华大学,2004.
