VEGF111b的表达载体构建及抗体制备
2014-05-05李秀丽谷芳姚元庆刘忠宇
李秀丽,谷芳,姚元庆,刘忠宇
(1.中国人民解放军总医院海南分院妇产科,海南三亚 572014;2.中国人民解放军总医院妇产科,北京 100853)
·论著·
VEGF111b的表达载体构建及抗体制备
李秀丽1,谷芳2,姚元庆2,刘忠宇2
(1.中国人民解放军总医院海南分院妇产科,海南三亚 572014;2.中国人民解放军总医院妇产科,北京 100853)
目的克隆VEGF111b基因,构建真核表达载体pcDNA3.1-VEGF111b,并进行测序,制备VEGF111b多克隆抗体。方法丝裂霉素C诱导处理卵巢癌SKOV3细胞24 h,设计VEGF111b酶切引物,以SKOV3细胞的cDNA为模板,通过PCR得到VEGF111b特异性基因产物,克隆入真核表达载体pcDNA3.1中,获得重组真核表达载体pcDNA3.1-VEGF111b,测序验证。用KLH耦联VEGF111b特异性短肽,制备多克隆抗体,Western blot检测其特异性。结果成功扩增了VEGF111b基因,双酶切、测序鉴定证实目的基因成功克隆到真核表达载体pcDNA3.1中,测序结果与预测完全一致,成功制备了VEGF111b多克隆抗体,使用其多克隆抗体,Western blot能够检测到VEGF111b对应分子量的蛋白条带。结论本研究鉴定了pcDNA3.1-VEGF111b真核表达载体,并验证了VEGF111b多克隆抗体的特异性,为进一步研究VEGF111b蛋白的功能奠定了基础。
VEGF111b;pcDNA3.1;真核表达;多克隆抗体
卵巢癌是常见的妇科恶性肿瘤之一,其发病率和病死率逐年升高。随着对卵巢肿瘤病因学和化疗抵抗发生机制研究的逐渐深入,人们将治愈卵巢癌的希望寄予分子靶向治疗,其中抗血管生成治疗因其疗效显著而格外引人注目[1-2]。人VEGF-A基因位于染色体6p21.3,目前证实的VEGF剪接变异体包括:①表达8a外显子的VEGFxxx亚家族成员VEGF111、VEGF121、VEGF145、VEGF165、VEGF183、VEGF189和VEGF206,可以促进血管生成的活性;②表达8b外显子的VEGFxxxb亚家族成员VEGF121b、VEGF145b、VEGF165b、VEGF1 83b和VEGF189b,可以抑制血管生成的活性;③不表达第8外显子的VEGF148[3-5]。
2007年Mineur等6]报道了一种新的VEGFxxx亚家族成员VEGF111,VEGF111编码序列由外显子1、2、 3、4和8a剪接构成。根据在正常生理状态下,大部分组织细胞偏向表达VEGFxxxb,位于外显子8中的远端剪接位点(Distal splice site,DSS)与近端剪接位点(Proximal splice site,PSS)相比具有较强的剪接优势[7],也就是说每一个VEGFxxx亚家族成员均应该有相对应的VEGFxxxb亚家族成员。
在我们的前期研究中,利用RT-PCR技术从丝裂霉素C作用的人卵巢癌SKOV3细胞中扩增出VEGF111b基因,首次证明了VEGF111b在卵巢癌细胞中诱导性表达[8]。本研究中将构建VEGF111b真核表达载体进行双酶切鉴定并核酸测序,制备VEGF111b多克隆抗体并检测其特异性。这一结果为进一步全面和系统研究VEGF111b的功能奠定良好的基础。
1 材料与方法
1.1 材料人卵巢癌SKOV3细胞购自中国医学科学院肿瘤研究所,质粒pcDNA3.1由本实验室提供,Trizol试剂购自Invitrogen公司,TransScript First-Strand RT-PCR试剂盒购自北京全式金公司,DNA maker、XhoⅠ酶、BamHⅠ酶、T4DNA连接酶购自Fermentas公司,DNA纯化试剂盒购自Qiagen公司。弗氏完全佐剂和不完全佐剂为Sigma公司产品;ECL化学发光显色试剂盒和蛋白Marker购自Thermo Scientific公司;0.2 μm NC膜购自Millipore公司;HRP标记的羊抗兔IgG购自Santa Cruz公司;特异性抗原肽合成和DNA测序由北京诺赛基因公司完成。
1.2 方法
1.2.1 细胞培养在培养条件均为37℃、饱和湿度、5%CO2(V/V)条件下,用含10%胎牛血清、2 mmol/L谷氨酰胺、100 U/ml青霉素、100 μg/ml链霉素的RPMI1640培养液培养人卵巢癌SKOV3细胞。
1.2.2 实验动物新西兰长耳兔两只,体质量约2 kg,两耳光滑,明显可见耳静、动脉,健康,购自上海西普尔-必凯实验动物有限公司,购回后在北京大学医学部实验动物饲养中心单只分笼饲养,室温(20±2)℃,保证良好的光照和通风条件。
1.2.3 VEGF111b表达载体构建、双酶切鉴定及DNA测序人卵巢癌SKOV3细胞在100 μg/ml的丝裂霉素C的作用下处理24 h,参照Invitrogen公司Trizol使用说明书提取SKOV3细胞的总RNA,利用紫外分光光度计定量并计算A260/A280比值。依照TransScript First-Strand RT-PCR试剂盒标准步骤,以SKOV3细胞总RNA的反转录产物cDNA为模板,使用上游引物5'-AAA CTC GAG GCC GCC ACC ATG AAC TTT CTG CTG TCT TGG GTG C-3'(下划线为XhoⅠ酶切位点)和下游引物5'-AAA GGA TCC TCA GTC TTT CCT GGT GAG AGA TC TG-3'(下划线为BamHⅠ酶切位点)进行PCR扩增。50 μl PCR反应体系为:模板cDNA 2 μl,10 μmol/L上游引物1 μl,10 μmol/L下游引物1 μl,10×Buffer(Buffer含Mg2+) 5 μl,2.5 μM dNTPs 4 μl,Trans Taq HiFi DNA聚合酶0.5 μl,用无菌双蒸水调反应体系至50 μl。循环参数为:94℃30 s,55℃30 s,72℃1 min,共30个循环。反应结束后,检测扩增产物。按照DNA纯化试剂盒的操作说明回收DNA,以限制性内切酶XhoⅠ和BamHⅠ进行双酶切。50 μl酶切体系为:15 μl纯化PCR产物,15 μl pcDNA3.1载体,1.5 μl XhoⅠ,1.5 μl BamHⅠ,10×Buffer溶液5 μl,用无菌双蒸水调反应体系至50 μl,37℃反应16 h。用T4DNA连接酶将VEGF111b基因连接至质粒pcDNA3.1的相应酶切位点之间,获得真核表达载体pcDNA3.1-VEGF111b,由北京诺赛公司进行DNA测序。
1.2.4 兔抗VEGF111b蛋白多克隆抗体的制备VEGF111b特异性抗原肽CRSLTRKD(Lot:5001602-2)由北京诺赛基因公司合成,然后用生理盐水稀释,与相应的佐剂进行1:1混合形成稳定乳剂。雄性新西兰长耳兔两只,在免疫前3 d取耳缘静脉血作为阴性对照。初次免疫将100 μg VEGF111b特异性抗原肽溶液与等体积的完全弗氏佐剂混合(2 mg/ml),进行背部皮下多点注射,每只0.5 ml;每隔两周进行加强免疫,将50 μg抗原肽溶液与等体积的不完全佐剂按上述方法混合(1 mg/ml),背部皮下多点注射,每只0.5 ml,加强免疫两次;最后一次免疫一周后,取耳缘静脉血进行ELISA效价分析。用VEGF111b的特异性抗原肽0.4 μg/孔包被酶标板,VEGF111b抗兔血清作一抗,免疫前兔血清作为阴性对照,进行倍比稀释(1:1 000、1:2 000、1:4 000、1:8 000、1:16 000、1:32 000、1:64 000、1:128 000、1:256 000和1:512 000),以HRP标记的羊抗兔单抗IgG为二抗(1:1 000稀释),加入邻苯二胺(OPD)底物反应液,37℃避光显色5 min,加入反应终止液,测定各孔的吸光度OD570nm值。效价达到要求后取颈动脉血,收集血清,过滤后硫酸铵沉淀法纯化抗体。
1.2.5 Western blot检测多克隆抗体的特异性提取丝裂霉素C处理24 h和未处理的卵巢癌SKOV3细胞的蛋白,进行SDS-PAGE电泳,转移至0.2 μmNC膜,以5%脱脂牛奶封闭2 h,TBST冲洗3次,每次10 min,以制备的VEGF111b多克隆抗体作为一抗(1: 500稀释),4℃过夜孵育,HRP标记的羊抗兔单抗IgG为二抗(1:1 000稀释),室温孵育2 h,TBST冲洗3次,每次10 min,最后进行ECL发光检测。
2 结果
2.1 构建pcDNA3.1-VEGF111b表达载体、双酶切鉴定及测序结果以人卵巢癌SKOV3细胞总RNA的反转录产物cDNA为模板,使用VEGF111b含酶切位点的特异性引物,通过扩增、纯化、酶切、连接,将VEGF111b基因连接至pcDNA3.1载体。将重组质粒pcDNA3.1-VEGF111b用XhoⅠ和BamHⅠ进行双酶切后,2%琼脂糖电泳图谱显示切出一个410 bp左右的DNA条带,与预计插入片段大小相符,如图1所示。其克隆基因测序结果显示该基因大小为413 bp,并且与预测完全相符。经BLAST软件分析,与人VEGF165b基因序列同源性为78%,与VEGF111基因序列同源性为95%,在人基因组数据库中未找到与该序列完全一样的同源基因,故本实验诱导所得基因序列为新序列。
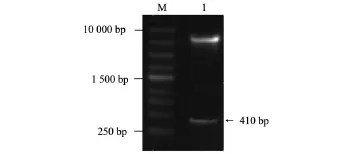
图1 pcDNA3.1-VEGF111b表达载体双酶切鉴定
2.2 VEGF111b多克隆抗体的制备用VEGF111b的特异性抗原肽CRSLTRKD作为抗原,免疫两只新西兰雄兔,ELISA法检测抗血清效价,IgG抗体滴度均已达到1.28×105,抗体效价已达到实验要求,如图2所示。取抗体滴度比较高的2号兔,收集血清后用硫酸铵沉淀法纯化抗血清,得到高纯度的VEGF111b多克隆抗体。
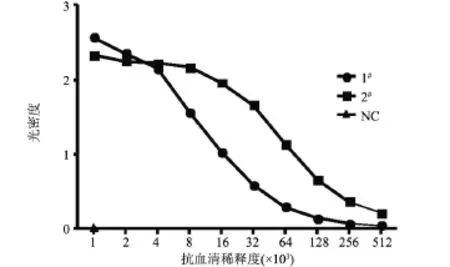
图2 VEGF111b抗血清稀释度(×103)
2.3 VEGF111b多克隆抗体特异性检测使用制备的VEGF111b多克隆抗体,经Western blot检测表明,能够特异性识别丝裂霉素C处理后的卵巢癌SKOV3细胞中的VEGF111b的表达,蛋白条带位置在10~15 kD之间,如图3所示,符合我们预测的VEGF111b蛋白分子量。图3中泳道1为丝裂霉素处理后SKOV3细胞,泳道2为未处理的SKOV3细胞,在未处理的卵巢癌中未检测到VEGF111b蛋白的表达,与我们前期的研究结果一致[8]。
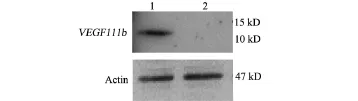
图3 VEGF111b多克隆抗体检测
3 讨论
自从VEGF165b发现[9]以来,研究者对其功能进行了广泛研究,并陆续发现了VEGFxxxb家族中其他成员,VEGF165b和VEGF121b均有强大的抗血管生成活性,极有可能作为抗血管制剂用于临床肿瘤治疗[5,10]。与现有的抗新血管生成制剂相比,VEGFxxxb具有明显的优越性。首先,VEGFxxxb存在于正常人体,不会因为诱导抗体产生而引发异常免疫反应[11];其次,VEGFxxxb不会因抑制VEGFxxx而引发肠道穿孔、高血压和蛋白尿等毒副作用[12]。在以前的研究中,我们使用RT-PCR技术在丝裂霉素C的作用下从卵巢癌SKOV3细胞成功克隆出VEGF111b基因序列,证实了VEGF111b在SKOV3细胞中诱导性表达[8]。与VEGF121b和VEGF165b相比,VEGF111b氨基酸序列中没有纤溶酶和MMP切割位点,不仅不会丧失了抑制血管生成活性所必须的SLTRKD序列,而且不会产生具有促血管活性的VEGF110片段和VEGF113片段,因此VEGF111b生物活性更稳定。此外,VEGF111b分子量较小,不含有肝素结合列,具有更好的扩散性能,易于到达肿瘤组织发挥其血管生成抑制作用[7]。因此,VEGF111b在VEGFxxxb家族中更具有优势。
目前尚未见任何有关VEGF111b的研究报道,更无可用的商品化检测试剂,从蛋白水平进一步研究VEGF111b的理化性质、分子结构及作用机制非常困难[13]。因此在本研究中,我们构建了pcDNA3.1-VEGF111b重组真核表达载体并进行了双酶切鉴定,测序结果分析为人基因组数据库中未找到的新序列,同时制备了VEGF111b多克隆抗体。成功构建的高质量的pcDNA3.1-VEGF111b重组载体及制备的多克隆抗体为后续转染卵巢癌细胞或纯化VEGF111b蛋白研究其对血管形成及肿瘤生长的作用奠定了实验基础。
综上所述,考虑到VEGF111b蛋白功能及抗原表位研究的重要性,本研究构建的pcDNA3.1-VEGF111b真核表达载体及制备的VEGF111b多克隆抗体,这些为利用基因工程和蛋白重组技术来制备和纯化有活性的VEGF111b重组蛋白创造了条件,为进一步研究VEGF111b的生物学功能奠定了基础。
[1]Liu J,Matulonis UA.New advances in ovarian cancer[J].Oncology(Williston Park),2010,24(8):721-728.
[2]Ledermann JA,Raja FA.Targeted trials in ovarian cancer[J].Gynecol Oncol,2010,119(1):151-156.
[3]Woolard J,Wang WY,Bevan HS,et al.VEGF165b,an inhibitory vascular endothelial growth factor splice variant:mechanism of action,in vivo effect on angiogenesis and endogenous protein expression[J].Cancer Res,2004,64(21):7822-7835.
[4]Rennel ES,Hamdollah-Zadeh MA,Wheatley ER,et al.Recombinant human VEGF165b protein is an effective anti-cancer agent in mice[J].Eur J Cancer,2008,44(13):1883-1894.
[5]Rennel ES,Varey AH,Churchill AJ,et al.VEGF(121)b,a new member of the VEGF(xxx)b family of VEGF-Asplice isoforms,inhibits neovascularisation and tumour growth in vivo[J].Br J Cancer,2009,101(7):1183-1193.
[6]Mineur P,Colige AC,Deroanne CF,et al.Newly identified biologically active and proteolysis-resistant VEGF-A isoformVEGF111 is induced by genotoxic agents[J].J Cell Sci,2007,179(6):1261-1273.
[7]Keskitalo S,Tammela T,Lyytikka J,et al.Enhanced capillary formation stimulated by a chimeric vascular endothelial growth factor/vascular endothelial growth factor-C silk domain fusion protein[J]. Circ Res,2007,100(10):1460-1467.
[8]Gu F,Li XL,Kong J,et al.VEGF111b,a new member of VEGFxxxb isoforms and induced by mitomycin C,inhibits angiogenesis [J].Biochem Biophys Res Commun,2013,441(1):18-24.
[9]Bates DO,Cui TG,Doughty JM,et al.VEGF165b,an inhibitory splice variant of vascular endothelial growth factor,is down-regulated in renal cell carcinoma[J].Cancer Res,2002,62(14):4123-4131.
[10]Nowak D,Amin EM,Rennel ES,et al.Regulation of vascular endothelial growth factor(VEGF)splicing from pro-angiogenic to anti-angiogenic isoforms:a novel therapeutic strategy for angiogenesis[J].J Biol Chem,2010,285(8):5532-5540.
[11]Qiu Y,Hoareau-Aveilla C,Oltean S,et al.The anti-angiogenic isoforms of VEGF in health and disease[J].Biochem Soc Trans,2009, 37(Pt 6):1207-1213.
[12]Nimeiri HS,OzaAM,Morgan RJ,et al.Efficacy and safety of bevacizumab plus erlotinib for patients with recurrent ovarian,primary peritoneal,and fallopian tube cancer:a trial of the Chicago,PMH,and California Phase IIConsortia[J].Gynecol Oncol,2008,110(1):49-55.
[13]Nussenbaum B,Teknos TN,Chepeha DB.Tissue engineering:the current status of this futuristic modality in head neck reconstruction [J].Curr Opin Otolaryngol Head Neck Surg,2004,12(4):311-315.
Construction of VEGF111b expression vector and preparation of VEGF111b antibody.
LI Xiu-li1,GU Fang2,YAO Yuan-qing2,LIU Zhong-yu2.
1.Department of Obstetrics and Gynecology,Hainan Branch of PLA General Hospital,Sanya 572014,Hainan,CHINA;2.Department of Obstetrics and Gynecology,PLA General Hospital,Beijing 100853,CHINA
ObjectiveTo clone the VEGF111b gene,construct eukaryotic expression system pcDNA3.1-VEGF111b,sequence VEGF111b gene,and prepare VEGF111b polyclonal antibody.MethodsWith VEGF111b-specific primers and RT-PCR,VEGF111b gene was amplified from ovarian cancer SKOV3 cells treated with mitomycin C for 24 h.PCR product was cloned into eukaryotic expression vector pcDNA3.1to construct pcDNA3.1-VEGF111b,and was then sequenced.VEGF111b-specific peptide was connected KLH to prepare the polyclonal antibody.Western blot was used to detect its specificity.ResultsVEGF111b gene was successfully amplified by RT-PCR and it was proved to be cloned into pcDNA3.1vector by double digestion with restriction endonuclease and sequencing analysis.We have prepared VEGF111b polyclonal antibody successfully,and detected protein band of the corresponding molecular weight using the polyclonal antibody by Western blotting.ConclusionThis study not only identified eukaryotic expression vector pcDNA3.1-VEGF111b,but also verified the specificity of VEGF111b polyclonal antibody,which provides a basis for further research on VEGF111b function.
VEGF111b;pcDNA3.1;Karyotic expression;Polyclonal antibody
R737.31
A
1003—6350(2014)22—3277—04
2014-06-02)
国家自然科学基金(编号:81250030)
李秀丽。E-mail:lixiuli17@163.com
