牡荆苷对骨髓间充质干细胞成脂分化的影响
2014-05-03周晨慧徐道华
周晨慧,张 雪,徐道华
(广东医学院,广东 东莞 523808)
骨髓间充质干细胞(MSCs)是一种易于扩增、具有多种分化潜能的细胞,在体内外特定的条件下,可分化为骨、软骨、脂肪和肌腱等多种组织细胞。近年来发现,MSCs与骨质疏松症的发生和发展密切相关,各种类型的骨质疏松症患者骨髓中的脂肪细胞与松质骨的骨量成反比,骨量的减少与骨髓腔内脂肪细胞增多总是相伴出现。MSCs向成脂细胞分化作用增强是导致骨质疏松症的原因之一[1-2]。因此,通过抑制MSCs向成脂方向分化已成为骨质疏松症防治的研究靶点之一。牡荆苷(vitexin)是自然界中最常见的黄酮碳苷,具有抗炎、抗氧化、抗肿瘤、降血糖和神经保护等作用[3-4]。通络生骨胶囊对股骨头坏死疗效极好,对骨质疏松症也有较好的防治作用,牡荆苷为其主要成分[5]。研究表明,牡荆苷可抑制脂肪细胞3T3-L1细胞株向脂肪细胞分化[6-7]。但牡荆苷是否对MSCs成脂分化具有抑制作用尚未见报道。
1 材料与方法
1.1 药物与试剂
牡荆苷(由本实验室自制,纯度大于98%),制备方法见文献[7];MTT及 DMSO、3-异丁基-1-甲基黄嘌呤、胰岛素、吲哚美辛和地塞米松(均购于美国Sigma公司);DMEM培养基、胎牛血清(均购自Gibco公司);所有引物由Invitrogen公司合成。
1.2 MSCs分离培养
1月龄SPF级SD大鼠,由广东医学院实验动物中心提供,体重(91.5 ± 5.7)g,动物合格证编号 SYXK(粤)2008-0007。饲料、饮水和垫料均符合实验动物质量控制标准。采用全骨髓法分离,无菌条件下取出双侧股骨,除去肌肉,切除股骨两端,冲出骨髓并悬浮于含10%胎牛血清的DMEM培养液中,置37℃及5%CO2孵箱内培养,首次24 h换液,以后每3 d换液1次,细胞达80%融合时,0.25% 胰蛋白酶消化传代培养。
1.3 试验分组
分为空白组及试验组。空白组为MSCs达80%融合,开始加入分化诱导液,其组成为内含0.5 mmol/L 3-异丁基 -1-甲基黄嘌呤、10 g/L 胰岛素、0.2 mmol/L 吲哚美辛、1 μmol/L 地塞米松和10%胎牛血清的DMEM培养基。试验组则为MSCs达80% 融合,开始加入分化诱导液及 10 μmol/L 或 50 μmol/L 的牡荆苷。
1.4 细胞生存率检测
MSCs细胞以5×103/孔接种于96孔培养板,采用MTT法检测细胞生存率。各组细胞培养3 d后,加入MTT使其最终质量浓度为0.5 g/L,继续 37℃培养箱内孵育 4 h,弃培养液,加入150 μL DMSO,振摇10 min,使甲瓒颗粒完全溶解,采用酶标仪在570 nm波长处测定吸光度值。
1.5 油红O染色检测细胞成脂分化
细胞诱导分化结束后,用PBS冲洗细胞1次,10%甲醛室温固定30 min,5 g/L的油红异丙醇溶液用去离子水按3∶2稀释后加入已固定好的细胞中,37℃孵育20 min,PBS清洗1次,倒置显微镜下观察并拍照。
1.6 实时荧光定量PCR检测过氧化物酶体增殖物激活受体(PPAR )和 CCAAT增强子结合蛋白 (C /EBP )mRNA 的表达[8]
收集各组细胞,提取细胞总RNA,取1 μg总 RNA逆转录合成cDNA。取1 μg cDNA产物,加入荧光混合物和各基因上、下游引物(引物序列 PPARγ:5′-GAGCATGGTGCCTTCGCTGA-3′和5′-AGCAAGGCACTTCTGAAACCGA-3′;C /EBPα:5′-AAGGCCAAGAAGTCGGTGGA-3′和 5′-CAGTTCGCGGCTCAGCTGTT-3′; β -actin:5′-CGTAAAGACCTCTATGCCAACA-3′和 5′-CGGACTCATCGTACTCCTGCT-3′,总体积 15 μL。PCR 扩增条件为 95℃ 5 min,以后 95℃ 15 s,60℃ 60 s循环 40次。以 βactin作为内参照,目的基因的表达用相对表达量表示。
1.7 统计学处理
2 结果
2.1 对细胞生存率的影响
牡荆苷浓度在 1~50 μmol/L范围内对 MSCs生存率无显著影响,表明在此浓度下牡荆苷对MSCs无显著毒性,见表1。
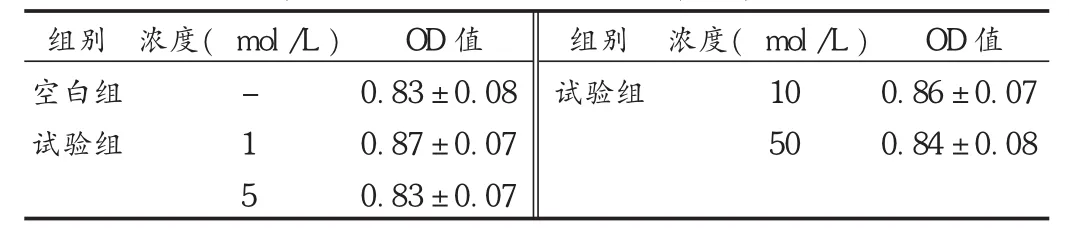
表1 牡荆苷对MSCs生存率的影响
2.2 对MSCs成脂分化的影响
采用油红O染色检测牡荆苷对MSCs成脂分化的作用,结果表明,牡荆苷抑制MSCs成脂分化,且具有剂量依赖性,见图1。
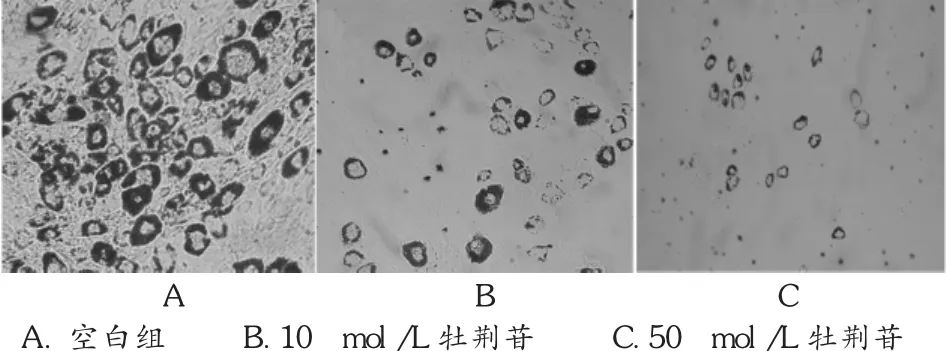
图1 牡荆苷对MSCs成脂分化的影响
2.3 对 PPAR 与 EBP mRNA表达的影响结果见表2。
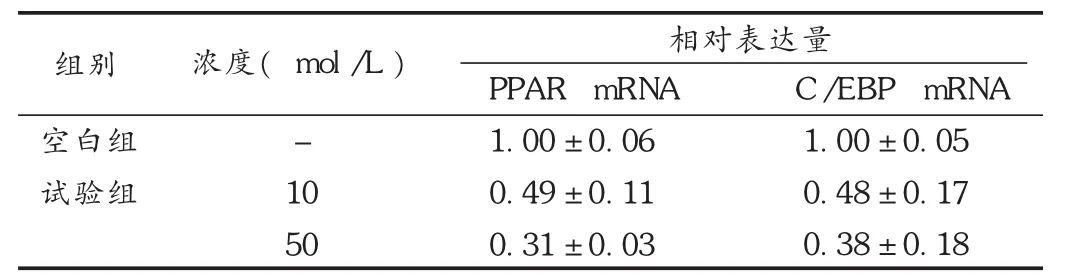
表2 牡荆苷对PPAR 与EBP mRNA表达的影响
3 讨论
骨质疏松症是一种以骨量减少、骨的微观结构退化为特征,致使骨的脆性增加易于发生骨折的全身性骨骼疾病。骨质疏松症及其所引起的骨折已成为严重危害人类健康的世界性公共卫生问题。研究表明,骨组织中成骨细胞和破骨细胞的功能失衡是导致骨质疏松症的主要病因,目前临床最常用的治疗骨质疏松症药物主要有双磷酸盐类等破骨细胞抑制药,这些药物虽然对骨质疏松症有一定疗效,但存在不良反应大、患者不能长期耐受等缺点[9-10]。
近年来发现,MSCs与骨质疏松症的发生和发展密切相关,MSCs成脂分化增强及成骨分化下降,是导致骨质疏松症的主要原因之一[1-2]。Dalle Carbonare等[2]的研究发现,骨质疏松症患者外周血中的MSCs成骨分化能力显著下降。Pino等[1]的研究也发现,绝经后骨质疏松症患者MSCs成脂分化作用增强,成骨分化作用下降[1]。因此,通过抑制MSCs向成脂方向分化而促进其向成骨方向分化将为骨质疏松症的防治提供新方向[11-13]。本试验首先观察了牡荆苷对MSCs毒性的影响,结果显示牡荆苷浓度在1~50 μmol/L范围内对 MSCs细胞无显著毒性。此外,本试验进一步观察了牡荆苷对MSCs成脂分化的作用,结果表明,牡荆苷可抑制MSCs成脂分化。
目前已鉴定出的对脂肪细胞分化有直接影响的转录因子主要有PPARγ和 C/EBPs[14]。C/EBPs主要有 3种同分异构体,即C /EBPα、C /EBPβ 和 C /EBPδ。C /EBPβ 和 C /EBPδ 在 分 化癥的早期被诱导表达,而C/EBPα是在分化的较晚期阶段才表达。C/EBPα一旦表达,随即有大量的脂肪细胞分化的特异基因开始表达,C/EBPα的过表达可加速3T3-L1前脂肪细胞向成熟脂肪细胞分化[15]。当 PPARγ 活化时,MSCs向成脂方向分化[16]。PPARγ的过表达可促使成纤维细胞系向成脂转化。PPARγ缺陷鼠的胚胎干细胞无成脂分化能力,同型PPARγ缺陷小鼠的骨量较野生型小鼠骨量增加[17]。本研究结果发现,牡荆苷显著抑制PPARγ和C/EBPα基因表达,说明牡荆苷抑制MSCs成脂分化的机制可能与其抑制PPARγ和C/EBPα基因表达有关。
参考文献:
[1]Pino AM,Rosen CJ,Rodriguez JP.In osteoporosis,differentiation of mesenchymal stem cells(MSCs)improves bone marrow adipogenesis[J].Biol Res,2012,45(3):279-287.
[2]Dalle Carbonare L,Valenti MT,Zanatta M,et al.Circulating mesenchymal stem cells with abnormal osteogenic differentiation in patients with osteoporosis[J].Arthritis Rheum,2009,60(11):3 356-3 365.
[3]Dong LY,Chen ZW,Guo Y,et al.Mechanisms of vitexin preconditioning effects on cultured neonatal rat cardiomyocytes with anoxia and reoxygenation[J].Am J Chin Med,2008,36(2):385-397.
[4]Lee CY,Chien YS,Chiu TH,et al.Apoptosis triggered by vitexin in U937 human leukemia cells via a mitochondrial signaling pathway[J].Oncol Rep,2012,28(5):1 883-1 888.
[5]刘少军,陈小俊,冯丽敏,等.通络生骨胶囊对大鼠应力缺失性骨质疏松的防治作用[J].中国实验方剂学杂志,2011,17(6):170-173.
[6]Kim J, Lee I, Seo J, et al.Vitexin, orientin and other flavonoids from Spirodela polyrhiza inhibit adipogenesis in 3T3-L1 cells[J].Phytother Res,2010,24(10):1 543-1 548.
[7]闫 冲,林 励,刘红菊,等.檀香叶黄酮类化学成分研究[J].中国中药杂志,2011,36(22):3 130-3 133.
[8]Xu L,Song C,Ni M,et al.Cellular retinol-binding protein 1(CRBP-1)regulates osteogenenesis and adipogenesis of mesenchymal stem cells through inhibiting RXR -induced -catenin degradation[J].Int J Biochem Cell Biol,2012,44(4):612-619.
[9]Sandhu SK,Hampson G.The pathogenesis,diagnosis,investigation and management of osteoporosis[J].J Clin Pathol,2011,64(12):1042-1050.
[10]尹 月,邱新野,高振梅,等.医院抗骨质疏松药物用药趋势分析与合理应用评价[J].中国药业,2012,21(7):26-29.
[11]Wagegg M,Gaber T,Lohanatha FL,et al.Hypoxia promotes osteogenesis but suppresses adipogenesis of human mesenchymal stromal cells in a hypoxia-inducible factor-1 dependent manner[J].PLoS One, 2012, 7(9):e46 483.
[12]Nuttall ME,Gimble JM.Controlling the balance between osteoblastogenesis and adipogenesis and the consequent therapeutic implications[J].Curr Opin Pharmacol,2004,4(3):290-294.
[13]Itakada I,Suzawa M,Kato S.Nuclear receptors as targets for drug development:crosstalk between peroxisome proliferator-activated receptor and cytokines in bone marrow-derived mesenchymal stem cells[J].J Pharmacol Sci,2005,97(2):184-189.
[14]Siersbếk R,Nielsen R,Mandrup S.Transcriptional networks and chromatin remodeling adipogenesis[J].Trends Endocrinol Metab,2012,23(2):56-64.
[15]Rusty D,Park BH,Davis KE,et al.Activation of MEK /ERK signaling promotes adipogenesis by enhancing peroxisome proliferator 2 activated receptor gamma(PPAR )and C/EBP gene expression during the differentiation of 3T3-L1 preadipocytes[J].J Biol Chem,2002,277(48):46 226-46 232.
[16]Cristancho AG,Lazar MA.Forming functional fat:a growing understanding of adipocyte differentiation[J].Nat Rev Mol Cell Biol,2011, 12(11):722-734.
[17]Akune T,Ohba S,kamekura S,et al.PPAR insufficiency enhances osteogenesis through osteoblast formation from bone marrow progenitors[J].J Clin Invest,2004,113(6):846-855.
