枯草芽孢杆菌BJ3-2精氨酸脱羧酶基因speA的克隆与序列分析
2014-04-24刘艳敏沈玺龙吴拥军
刘艳敏,卢 彪,沈玺龙,王 涛,吴拥军*
(贵州大学 生命科学学院,贵州 贵阳 550025)
精氨酸脱羧酶(arginine decarboxylase,ADC)广泛分布于细菌、真菌、古生菌和植物体内,在多胺生物合成过程中扮演重要的角色[1],是多胺合成途径中关键酶[2-3]。在枯草芽孢杆菌(Bacillus subtilis)中多胺生物合成只有一条途径:始于精氨酸(arginine)[4],由精氨酸脱羧酶作用脱羧生成的胍基丁胺(agmatine),经过胍基丁胺酶(agmatinase)水解生成腐胺(putrescine,Put)和尿素(urea)[1,5];腐胺与脱羧S-腺苷甲硫氨酸(dAdoMet,dSAM)[6]提供的氨丙基在亚精胺合成酶(spermidine synthase)或精胺合成酶(spermine synthase)的催化作用下合成亚精胺(spermidine,Spd)或精胺(spermine,Spm)[2,7-9]。适量的生物胺在人和动物活细胞中发挥着重要的生理作用,但当体内生物胺含量过高或超过一定范围则会引起身体不适等不良症状,还具有潜在的致癌性[10]。生物胺存在于食品中也会影响甚至改变其风味成分[11-12];同时精胺和亚精胺的存在会影响食品的风味和品质,产生难闻的气味,还可能与亚硝酸盐结合形成致癌的亚硝胺[10]。多聚胺如腐胺、尸胺、精胺和亚精胺等对人体没有直接毒性,但会加强组胺和酪胺对人体解毒系统的影响。
目前贵州地区水豆豉生产主要以自然发酵为主,其中发酵的主要微生物枯草芽孢杆菌,拥有悠久的酶生产和食品发酵历史,是细菌型水豆豉生产的主要食品安全发酵菌株。发酵食品中的生物胺主要由微生物通过分泌脱羧酶而生成,据报道芽孢杆菌具有氨基酸脱羧酶活性,张建华等[13]报道了纳豆发酵过程中产生的生物胺主要以亚精胺为主。纳豆和水豆豉都属于发酵大豆食品,为控制水豆豉生产过程产生过量的亚精胺和精胺及其副产物,以实验室前期已获得豆豉生产菌株Bacillus subtilisBJ3-2[14-15]为目标菌株,根据GenBank中枯草芽孢杆菌168菌株的精氨酸脱羧酶基因序列设计特异性引物,以Bacillus subtilisBJ3-2基因组DNA为模板进行PCR扩增,克隆精氨酸脱羧酶基因speA,并与其他枯草芽孢杆菌的speA序列进行同源性比对分析,推测ADC酶活性结构域和酶活性位点,从而为产亚精胺和精胺的枯草芽孢杆菌的检测提供理论依据,也为ADC活性影响因素的进一步研究奠定基础,为水豆豉的安全生产提供一定的指导意义。
1 材料与方法
1.1 材料与试剂
Bacillus subtilisBJ3-2和E.coliDH5α:本实验室保存。
pGEM-T载体:美国Promega公司;基因组DNA提取试剂盒、溶菌酶:美国Promega公司;Taq(聚合)酶、T4 DNA连接酶、DNAMarker、dNTPs、10×PCRBuffer等:大连TaKaRa公司;其他试剂均为国产分析纯。E.Z.N.A.TMGel Extraction Kit(200)胶回收试剂盒、E.Z.N.A.TMPlasmid Mini KitⅠ(200)质粒提取试剂盒:美国Omega公司。
1.2 仪器与设备
MyCycler PCR仪、Universal Hood Ⅱ凝胶成像分析仪、PowerPac HC电泳仪:美国Bio-Rad公司。
1.3 引物设计与合成
参考GenBank中枯草芽孢杆菌168菌株(登录号为AL009126.3)的精氨酸脱羧酶基因序列,应用DNAStar软件设计一对精氨酸脱羧酶基因的特异性引物,引物序列:上游引物P1:5′-TTGTCGCAACATGAAACAC-3′;下游引物P2:5′-TTATTGAATTGCTTTTTGTTC-3′;预计扩增片段长度为1 473bp,由北京诺赛基因组研究中心有限公司合成。
1.4 方法
1.4.1Bacillus subtilisBJ3-2基因组DNA的提取
挑取B.subtilisBJ3-2单菌落,接种到5mL LB培养基中,37℃条件下振荡培养过夜,参考Promega公司的革兰氏阳性细菌中提取基因组的试剂盒说明书提取全基因组。
1.4.2 PCR扩增
以提取的B.subtilisBJ3-2的基因组DNA为模板,用合成的引物进行PCR扩增,PCR反应体系:DNA模板1μL、dNTPs 1.6μL、10×PCR Buffer 2μL、上下游引物各0.5μL、Taq酶0.1μL、ddH2O 14.3μL。总体系:20μL。反应程序:94℃预热5min,94℃变性40s,50℃退火40s,72℃延伸90s,进行30个循环后,72℃延伸10min,扩增产物经1%琼脂糖凝胶电泳检测。
1.4.3 精氨酸脱羧酶基因(speA)的克隆与鉴定
将回收纯化的PCR产物与pGEM-T载体按常规方法[16]进行连接并转化感受态细胞E.coliDH5α。将菌落PCR和质粒PCR验证正确的克隆质粒送北京诺赛基因组研究中心有限公司测序。
1.4.4speA序列分析
用DNAStar和MEGA5生物学软件对speA基因的核苷酸序列及推导的氨基酸序列进行编辑,与GenBank中已发表的其他speA基因序列进行同源性分析并绘制ADC遗传进化树。
2 结果与分析
2.1 Bacillus subtilis BJ3-2基因组DNA的提取
用基因组提取试剂盒,对B.subtilisBJ3-2基因组DNA进行提取,DNA样品经0.7%琼脂糖凝胶电泳检测。图1显示所提取的B.subtilisBJ3-2基因组DNA较完整,无显著降解,可用作模板进行下一步目的基因的PCR扩增。

图1 枯草芽孢杆菌BJ3-2基因组Fig.1 Genome of Bacillus subtilis BJ3-2
2.2 speA基因的PCR扩增
以B.subtilisBJ3-2基因组DNA为模板,PCR扩增speA基因,1%的琼脂糖凝胶电泳,扩增出一条约与预期片段大小1 473bp相符的条带,结果见图2。

图2 PCR扩增speA基因Fig.2 PCR amplification of speA
2.3 重组克隆质粒的菌落PCR鉴定
PCR产物纯化后与pGEM-T 载体连接过夜,转化E.coliDH5α。通过菌落PCR检测,从图3可以看出,约在1 473bp处出现了特异性扩增条带,与基因组PCR扩增speA的目的条带大小相吻合,获得了阳性的重组菌落。
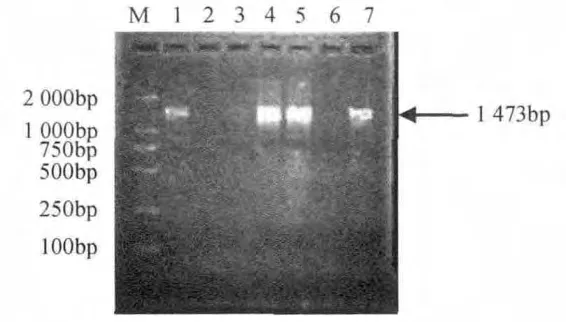
图3 菌落PCR鉴定重组子Fig.3 PCR rapid identification of speA gene from recombinant clones
2.4 重组质粒PCR鉴定
将鉴定的阳性重组菌落进行增菌培养,提取质粒DNA,进行质粒PCR扩增,结果表明,约在1 473bp处出现一特异性条带,所获得的基因片段大小均与PCR扩增产物大小相吻合(见图4),说明目的基因已正确克隆至pGEM-T载体中,并将提取的重组质粒送生物公司测序,并命名为pGEM-speA。
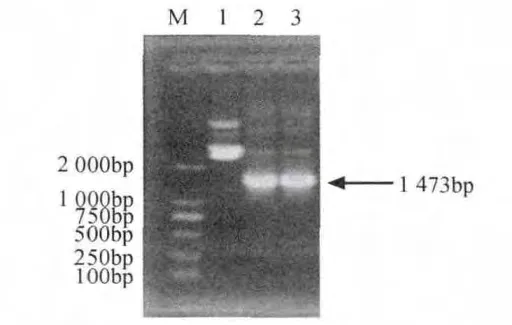
图4 质粒PCR鉴定Fig.4 PCR identification of speA from recombinant plasmid pGEM-speA
2.5 Bacillus subtilis BJ3-2精氨酸脱羧酶基因speA的同源性分析及系统进化树
测序结果经DNAStar 软件编辑处理,结果表明,B.subtilisBJ3-2精氨酸脱羧酶基因speA开放阅读框大小为1 473bp,编码490个氨基酸,推测蛋白质分子质量为53.53ku,G+C含量为44%,等电点为5.29,酸性氨基酸19.6%,碱性氨基酸12.2%。将序列提交至GenBank中,获得基因登录号为KJ561348。
将所克隆的基因序列和推导的蛋白序列与GenBank数据库进行序列同源性比对,分析结果表明,B.subtilisBJ3-2的speA基因序列与已报道枯草芽孢杆菌的speA基因序列和蛋白序列高度同源,分别达到93%和95%以上,核苷酸序列与Bacillussp.JS(speA)的同源性最高,达99%;与其他枯草芽孢杆菌(speA)的核苷酸序列也在93%及其以上;与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和萎缩芽孢杆菌(Bacillus atrophaeus)的同源性为79%,表明克隆的基因为编码精氨酸脱羧酶的基因。
B.subtilisBJ3-2精氨酸脱羧酶氨基酸序列与芽孢杆菌JS(Bacillussp.JS)、枯草芽孢杆菌168菌株(Bacillus subtilis168)、枯草芽孢杆菌纳豆亚种BEST195菌株(Bacillus subtilis subsp.natto BEST195)、枯草芽孢杆菌BEST7613(Bacillus subtilisBEST7613)最高,为99%;与其他枯草芽孢杆菌精氨酸脱羧酶氨基酸序列在≥97%;与芽孢杆菌属其他菌种的精氨酸脱羧酶氨基酸序列同源性在97%~72%之间。
乳酸菌(Lactobacillussp.30a)的鸟氨酸脱羧酶家族(ornithine decarboxylase family)作为大多数细菌磷酸吡哆醛(pyridoxal 5'-phosphate,PLP)依赖型脱羧酶代表,具有Ⅲ型PLP型脱羧酶的活性位点和PLP结合位点以及二级结构特征[17],选择Lactobacillussp.30a的ODC氨基酸序列作比对,推测B.subtilisBJ3-2的ADC底物结合位点和酶活性位点。研究发现,Ⅲ型PLP型脱羧酶和厚壁菌门细菌的PLP依赖型脱羧酶与大肠杆菌的保守结构区域不同[17-18],嗜热厌氧解木聚糖杆菌(Thermoanaerobacterium xylanolyticumLX-11)和梭状芽孢杆菌(Clostridium stercorariumsubsp.stercorariumDSM 8532)都属于厚壁菌门细菌,选择二者的ADC序列作比对,增加推测B.subtilisBJ3-2的底物结合位点和酶活性位点的可靠性;并根据大肠杆菌E.coliATCC 8739 ADC 和Lactobacillussp.30a ODC、B.subtilis168 ADC 和T.xylanolyticumLX-11 ADC、C.stercorariumDSM 8532 ADC的氨基酸序列以及同源性较高的枯草芽孢杆菌ADC序列构建系统进化树,进一步分析其间的进化关系。
ClustalW多序列比对,GeneDoc输出,结果显示B.subtilisBJ3-2的ADC基因包括有PLP依赖型脱羧酶家族的氨基酸保守结构域:即PLP结合位点:[FDSAW]、[RNNHKSVYNSA]、[S-X-H-K];[S-X-H-K]序列中Lys(K)是PLP依赖型脱羧酶的活性位点,PLP通过与Lys氨基酸残基形成醛亚胺键(席夫碱),使酶具有催化活性[17],如图5所示。
从图6可以看出,枯草芽孢杆菌的ADC位于遗传距离较近的同一进化分支,彼此亲缘关系较近,B.subtilisBJ3-2的与B.subtilis168的ADC遗传距离最近,与T.xylanolyticumLX-11和C.stercorariumDSM8532的遗传距离次之。B.subtilisBJ3-2的ADC与Lactobacillussp.30a的ODC位于遗传距离稍远的同一进化分支,与E.coliATCC 8739的ADC遗传距离最远。以上分析显示B.subtilisBJ3-2与乳酸菌和其他厚壁菌门细菌的遗传距离较近,具有Lactobacillus.30a鸟氨酸脱羧酶家族(ornithine decarboxylase family)相似的保守结构域,属于典型的III型磷酸吡哆醛(pyridoxal phosphate,PLP)依赖型鸟氨酸/赖氨酸/精氨酸脱羧酶家族(Orn/Lys/Arg decarboxylase family)成员[17-18]。

图5 B.subtilis BJ3-2和其他细菌ADC/ODC的氨基酸多序列比对Fig.5 ADC/ODC amino acid multiple sequence alignments between B.subtilis BJ3-2 and other bacteria

图6 不同细菌的ADC/ODC氨基酸序列遗传进化树Fig.6 Genetic evolutionary tree of ADC/ODC amino acid sequences of different bacteria
3 结论与讨论
Bacillus subtilisBJ3-2的ADC基因编码的脱羧酶属于丙氨酸消旋酶(alanine racemase)家族,其的功能依赖于PLP位点,属于典型的III型PLP依赖型鸟氨酸/赖氨酸/精氨酸脱羧酶家族成员。在[FDSAW]结构域中,天冬氨酸Asp(D)与丙氨酸Ala(A)高度保守,Asp在酶催化过程中能稳定电荷,Ala的甲基侧链处在酶辅助因子的后面,对于酶的空间构象具有重要作用。[S-X-H-K]序列高度保守,组氨酸His(H)在PLP底物结合去质子化过程中提供质子,稳定电荷,该位点的定点突变对酶活性会产生影响[19]。[RNNHKSVYNSA]中His存在所有的PLP依赖型脱羧酶中,代表了转氨酶向脱羧酶进化的一个最重大的特征,His残基在特定的组胺酰基试剂修饰后会使酶失活[17,20]。在不同细菌ADC的序列比对中还存在[GTS]、[STSPFY]、[YPPG]、[PGE]高度保守序列,这可能其他辅助因子相关。PLP型辅助因子通过氢键、π-堆积以及范德华力相互作用,以确保ADC酶活性,保守结构域和活性位点的分析对于酶活性调控具有重要作用。
在枯草芽孢杆菌中,以ATG为起始密码子的基因的占78%,以TTG为起始密码子的占13%,以GTG的占9%。大肠杆菌中的起始tRNA分子可以同时识别AUG、GUG和UUG这3种起始密码子,但识别频率并不相同,通常GUG为AUG的50%,而UUG只及AUG的25%[21]。以实验目的菌株B.subtilisBJ3-2克隆得到的speA基因的起始密码子为TTG,是枯草芽孢杆菌中特有的遗传起始密码子,在精氨酸脱羧酶基因的表达后续试验中需要选择合适的表达载体和宿主菌,或在大肠杆菌中表达宿主细胞中进行密码子优化,增强精氨酸脱羧酶基因的表达效率。
在革兰氏阳性菌枯草芽孢杆菌中生物多胺合成只有一条途径,起始于精氨酸,由精氨酸脱羧酶、胍基丁胺酶、S-腺苷甲硫氨酸脱羧酶以及亚精胺合酶、精胺合酶共同参与作用。实验应该同时研究这几个基因,以进一步了解枯草芽孢杆菌生物多胺的合成途径,speA基因的克隆与ADC酶保守结构域和酶活性位点的推测,为有效控制水豆豉产品中生物胺的含量和农业生产以及植物抗性关于精氨酸脱羧酶[6,22]的相关研究提供一定的理论依据。
[1]FOROUHAR F,LEW S,SEETHARAMAN J,et al.Structures of bacterial biosynthetic arginine decarboxylases[J].Acta Crystallogr F,2010,66(12):1562-1566.
[2]TIBURCIO A F,MASDEU M A,GALSTON A W.Polyamine metabolism and osmotic stress[J].J Plant physiol,1986,82(2):369-374.
[3]汪 天,孟艳琼,谷 凤,等.多胺代谢及其与农产品贮藏保鲜关系的研究[C].合肥:2005 安徽食品安全博士论坛,2005.
[4]SEKOWSKA A,BERTIN P,DANCHIN A.Characterization of polyamine synthesis pathway inBacillus subtilis168[J].Mol Microbiol,1998,29(3):851-858.
[5]曹学武,高钰琪.精氨酸-胍基丁胺代谢的研究进展[J].生命科学,2004,16(3):170-172.
[6]张庆福.枳精氨酸脱羧酶基因(PtADC)转化烟草提高抗脱水研究[D].武汉:华中农业大学硕士论文,2010.
[7]SEKOWSKA A,COPPEE J Y,LE CAER J P,et al.S-adenosylmethionine decarboxylase ofBacillus subtilisis closely related toarchaebacterial counterparts[J].Mol Microbiol,2000,36(5):1135-1147.
[8]EVANS P T,MALMBERG R L.Do polyamines have roles in plant development[J].Annu Rev Plant Physiol Plant Mol Biol,1989,40:235-269.
[9]马 瑛,刘 静.植物体中多胺代谢及其功能研究进展[J].陕西理工学院学报:自然科学版,2010,26(2):47-54.
[10]HERNANDEZ-JOVER T,IZQUIERDO-PULIDO M,VECIANA-NOGUES M T,et al.Biogenic amines and polyamine contents in meat and meat products[J].J Agr Food Chem,1997,45(6):2098-2102.
[11]SHALABY A R.Significance of biogenic amines to food safety and human health[J].Food Res Int,1996,29(7):675-690.
[12]ONAL A.A review:current analytical methods for the determination of biogenic amines in foods[J].Food Chem,2007,103(7):1475-1486.
[13]张建华,沈 翔,于湘莉.纳豆发酵过程中的生物胺[J].上海交通大学学报:农业科学版,2007,25(1):1-5.
[14]吴拥军,孟望霓,李耀中.纯种强化发酵细菌型豆豉研究[J].中国酿造,2011,30(9):56-60.
[15]贾东旭,吴拥军,李耀中,等.细菌型豆豉发酵芽孢杆菌的筛选与鉴定[J].食品科学,2009,30(5):217-221.
[16]J.萨姆布鲁克D.W 拉塞尔.黄培堂,等译.分子克隆实验指南(第三版)[M].北京:科学出版社,2002.
[17]MOMANY C,GHOSH R,HACKERT M L.Structural motifs for pyridoxal-5'-phosphate binding in decarboxylases:an analysis based on the crystal structure of theLactobacillus30a ornithine decarboxylase[J].Protein Sci,1995,4(5):849-854.
[18]BURRELL M,HANFREY C C,MURRAY E J,et al.Evolution and multiplicity of arginine decarboxylases in polyamine biosynthesis and essential role inBacillus subtilisbiofilm formation[J].J Biol Chem,2010,285(50):39224-39238.
[19]GANI D.A structural and mechanistic comparison of pyridoxal 5'-phosphate dependent decarboxylase and transaminase enzymes[J].Philos T Roy Soc B,1991,332(1263):131-139.
[20]MISHIN A A,SUKHAREVA B S.Glutamate decarboxylase fromEscherichia coli:catalytic role of the histidine residue[J].Dokl Akad Nauk SSSR,1986,290(5):1268-1271.
[21]白俊琴.枯草芽孢杆菌lipA 基因表达的研究[D].天津:天津大学硕士论文,2009.
[22]郭玉兰.精氨酸脱羧酶活性与冬小麦抗旱性关系的研究初报[J].河北师范大学学报,1990(1):77-78.
