前列腺癌干细胞的研究进展
2014-04-22欣刘丽丽曹靖晨陆志平综述晓江明审校
刘 欣刘丽丽曹靖晨陆志平综述 顾 晓江 明审校
1. 江苏省靖江市人民医院泌尿外科(靖江 214500);
2. 南通大学医学院基础医学研究室核受体与肿瘤研究实验室; 3. 江苏省苏北人民医院泌尿外科
·综 述·
前列腺癌干细胞的研究进展
刘 欣1刘丽丽2曹靖晨2陆志平1综述 顾 晓3江 明2审校
1. 江苏省靖江市人民医院泌尿外科(靖江 214500);
2. 南通大学医学院基础医学研究室核受体与肿瘤研究实验室; 3. 江苏省苏北人民医院泌尿外科
前列腺癌是欧美国家最常见的上皮性恶性肿瘤,占所有恶性肿瘤的29%,致死率在美国仅次于肺癌。中国前列腺癌的发病率远低于欧美国家,但研究表明,近年来,我国尤其是上海等经济发达区域前列腺癌的发病率有逐年升高的趋势[1]。目前,前列腺癌的发病原因及发病机制尚不清楚,但前列腺癌的高发人群集中于老年人,年龄越大发病率越高。有研究发现,睾丸不发育或没有睾丸的人不发生前列腺肥大,也不发生前列腺癌,说明前列腺癌的发生与男性睾丸和雄激素(androgens)有着密切的关系。各国特别是欧美国家每年投入巨额经费进行前列腺癌基础研究及临床治疗,但至今尚未获得实质性进展。“癌干细胞学说”为探讨前列腺癌发生发展机制及治疗开拓了思路,本文就“癌干细胞学说”、前列腺癌干细胞的起源、表面标志物、信号通路和临床意义等方面做一综述。
一、“癌干细胞学说”
二十世纪九十年代,Lapidot 等[2]首次发现在白血病肿瘤细胞中只有少数细胞表型为CD34+CD38-,且这些细胞接种在非肥胖糖尿病/严重联合免疫缺陷小鼠体内后可导致癌症形成,随后被证实这些细胞属于肿瘤干细胞。肿瘤干细胞(tumor stem cell, TSC或 tumor-initiating cell, TIC)又称为癌干细胞(cancer stem cells,CSC)是一类具有自我更新能力、无限增殖能力和多分化潜能的细胞[3],它们数目稀少、有端粒酶活性、异质化特性和高致瘤性[4]。大量研究表明,实体肿瘤的边缘细胞具有间充质细胞特点,而且表达肿瘤干细胞标记物[3],如乳腺癌[1]、颅内肿瘤[5]、肺癌[6]、结肠癌[7]、卵巢癌[8]、胰腺癌[9]、前列腺癌[10]和甲状腺肿瘤[11]等。且随着Ponti等[12]从乳腺癌、Singh等[5]从脑肿瘤等实体瘤中成功分离出相应的癌干细胞,证实了癌干细胞的存在。
二、前列腺癌及前列腺癌干细胞的起源
人类及鼠前列腺都包含3种不同的、分化的上皮细胞:基底细胞(Basal Cells, BC)、管腔上皮细胞(Luminal Cells, LC)及神经内分泌细胞(neuroendocrine, NE)。基底细胞位于基底膜上面的基底层,高表达CK5、CK14、CD44、CD133、p63和Bcl-2等分子标记,且有较低表达雄激素受体(AR)。而管腔上皮细胞则位于基底层上面,分泌前列腺蛋白,高表达CK8、CK18、CK19、前列腺特异性抗原(PSA)、前列腺酸性磷酸酶(PAP)、CD57和AR等分子标记。神经内分泌细胞则较为罕见,仅对突触素及嗜铬粒蛋白A表达阳性[13]。最新研究表明,表观遗传修饰可能参与了前列腺组织分化过程,如:5-羟甲基胞嘧啶在正常的人类前列腺管腔细胞中的表达更为丰富,而在基底细胞中表达较低,由此证实,应用合适的表观遗传修饰作为分子标记,可区分前列腺管腔细胞的分化过程。
雄激素去势治疗后正常成年小鼠前列腺萎缩,90%以上的管腔细胞及少量基底细胞发生凋亡。然而,雄激素恢复后,前列腺则恢复至正常大小[14],且这种萎缩-恢复过程可重复30次以上,间接证明前列腺干细胞可能对雄激素撤退具有一定的耐受性。
目前,前列腺癌的起源尚存在一些争议。最初认为终末分化的管腔细胞是所有致瘤细胞的来源[15],因为>95%的未治疗原发前列腺癌表现为腺泡癌,管腔样细胞高表达AR和PSA,而基底样细胞则较少表达这两种蛋白[13]。此外,Zhou等[16]发现将雄激素去势耐受Nkx3-1表达细胞(castration-resistant Nkx3-1-expressing cells, CARNs)肾包膜下种植后,可形成前列腺管状结构,且CARNs中人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN)肿瘤抑制基因缺失及予以雄激素处理后,可导致高等级PIN及肿瘤形成,说明CARNs可能作为前列腺癌的起源细胞。Choi等[17]运用谱系跟踪方法,重组基底细胞特异诱导Cre重组酶系统(K14-CreERTg/Tg; mTmGTg/Tg)及管腔上皮细胞特异诱导Cre重组酶系统(K8-CreERTg/Tg; mTmGTg/Tg),发现管腔上皮细胞在Pten基因敲除后,更容易直接向恶性肿瘤转变,而基底细胞似乎需要先分化成具有转化功能的管腔上皮细胞,进而再转化为肿瘤细胞。总之,这些模型研究可证实小鼠前列腺管腔上皮细胞可以作为前列腺癌的起源细胞。
然而,经组织重组/移植实验证明前列腺基底细胞更容易向恶性转变。转录因子ERG1及融合基因TMPRSS2过表达后,小鼠前列腺基底细胞/干细胞会导致发育障碍和前列腺上皮内瘤变(PIN),而在管腔上皮细胞或基质细胞中未见相似表型[18]。并且,将小鼠基底细胞/干细胞中的AKT 和 AR过表达后,可见形成恶性程度较高的低分化癌[19]。值得注意的是,当在良性前列腺基底细胞 (CD49fhiTrop2hi)和管腔上皮细胞(CD49floTrop2hi)过表达时,只有基底细胞易向恶性转化,且在免疫缺陷老鼠体内可形成前列腺癌,发现为类似于前列腺癌患者的肿瘤组织学特点[20]。Goldstein等[20]从人类的良性前列腺增生组织中可以分离出基底细胞和管腔上皮细胞,将肿瘤基因导入上述细胞后,移植至小鼠体内,证实了是基底细胞而非管腔细胞产生了类似于人体内前列腺癌的肿瘤组织。这项研究结果表明,基底细胞可能是PCSC的主要来源。总之,不论是人类前列腺还是小鼠前列腺中,基底细胞都可以作为前列腺癌的起源细胞。
无论前列腺癌的起源细胞为何种细胞,都需要注意前列腺癌的起源细胞不同于前列腺癌干细胞的起源。前列腺癌干细胞(prostate cancer stem cells,PCSC)类似于正常前列腺干细胞,寿命较长,一直处于静息或慢周期状态,保持低分化状态,具有胚胎干细胞特性[21],低表达PSA[22]和CK18/CK19(HLA)等[23]分化标志物。研究证实,低分化PCSCs越多,肿瘤侵袭性越强[24],具有肿瘤干细胞特性[25]。有证据表明前列腺癌干细胞来自于前列腺干细胞。干细胞和癌干细胞(cancer stem cells,CSC)具有许多相似的特征:如自我更新能力无限增殖能力、多分化潜能、永生性及具有相同的细胞表面标志(如CD133、角蛋白CK5、CK14等)和相同信号传导通路(如Notch、Wnt、Hedgehog)等,且它们都不表达雄激素受体。前列腺干细胞的转化是在雄激素存在的情况下大部分上皮干细胞分化为雄激素依赖的上皮癌细胞。
早在上世纪80年代,Barrandon等[26]已对人表皮角质细胞进行克隆形成实验,研究发现单个角质细胞贴壁培养所形成的克隆具有不同的形态和侵袭能力,根据形态可将其分为3类,即全克隆(holoclone)、部分克隆(meroclone)和副克隆(paraclone)。其中,全克隆最大,可达10~30 mm2, 呈规则的类圆形, 且边缘光滑,由小体积的细胞紧密贴合而成,具有最强的再生能力;副克隆是由较大的细胞疏松组合形成,再生及传代能力较低,一般不能传代超过15代;而部分克隆大小介于前两者之间,形态不规则,是全克隆或副克隆的过渡阶段[27]。类似于原代角化细胞,长期培养的鳞状细胞癌,以及许多其他的上皮癌细胞,也可以形成不同类型的克隆。Li等[27]已证实前列腺癌细胞与人表皮角质细胞一样,可形成明显的克隆形态(如图1),且具有不同的增殖和自我更新能力,全克隆中包含有干细胞样肿瘤细胞,表达干祖细胞表面标记物CD44,α1β2整合素及β-连环蛋白,可加快肿瘤进展转移情况。
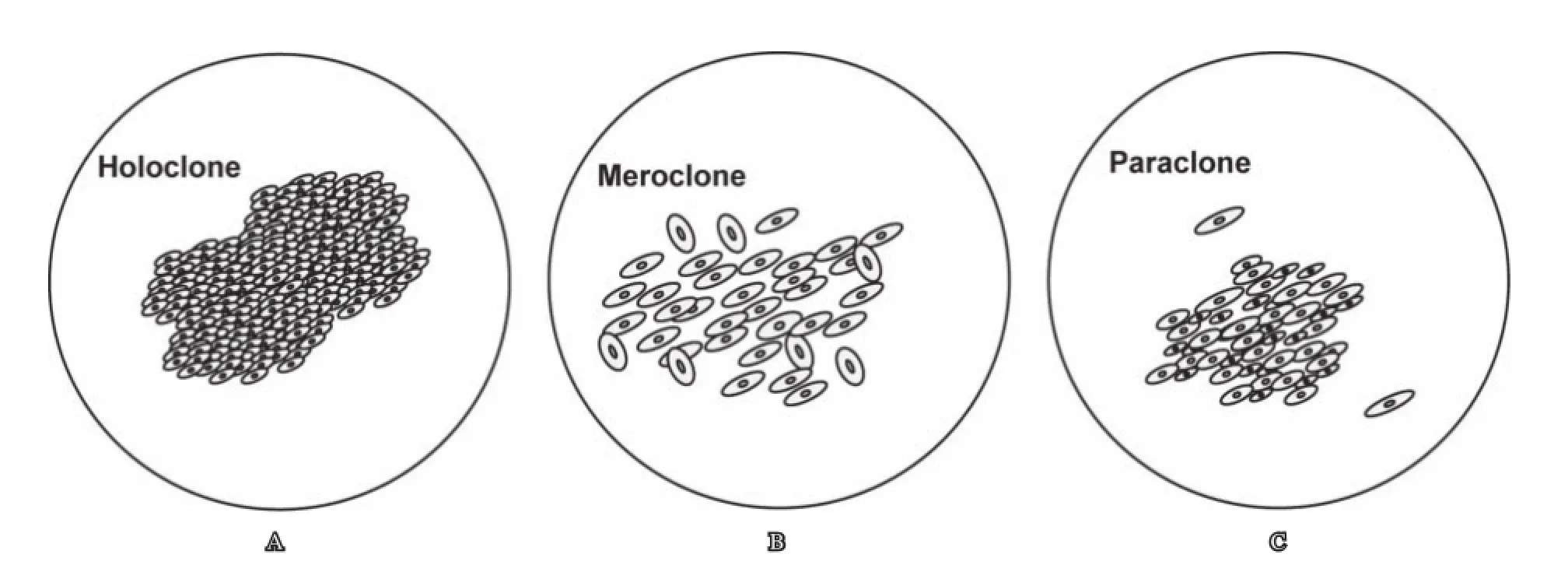
图1 PC-3细胞的克隆形态
三、前列腺癌干细胞的表面标志物
常见前列腺癌干细胞的表面标志物包括CD44、Sca-1、CD133+/α1β2hi和ABCG2等。
(一)黏附分子CD44
CD44是一种透明质酸结合的细胞表面糖蛋白,分布极为广泛,在内皮细胞等多种细胞表面均有表达。CD44通常用于FACS癌干细胞的分选。因其没有特异性,当需要分选PCSCs时,CD44通常辅以多种其他标记。已有文献证实,在前列腺癌细胞株形成的干细胞球中,CD44的表达显著[28]。CD44+/CD24的DU145[29]和LNCaP[30]细胞所形成的干细胞球具有分化潜能。
(二)干细胞抗原1(Stem cell antigen-1,Sca1)
Sca1是一种18KD的磷脂酰肌醇锚定蛋白,属于Ly26抗原家族成员之一,在某些组织的干/祖细胞中表达阳性,如造血细胞、心肌组织、乳腺、皮肤、肌肉和睾丸等。Sca-1细胞在前列腺癌中可表现出干细胞特性,具有多向分化及增殖能力。60%以上的Sca1+细胞可协同表达整合素α6/CD49f和Bcl-2。Sca1+细胞表现出激素非依赖性,当雄激素去势后Sca1+细胞增多[31]。研究表明,Sca1+鼠前列腺细胞在慢病毒介导的AKT1过表达后,可表现为PIN[31],进而可进展为前列腺癌,证明AKT高表达活性的Sca1+细胞可作为前列腺癌病变的起源。
(三)CD133+/α2β1hi(高表达)
CD133是一种分子量为120kD具有5个跨膜区的糖蛋白,是一种早期抗原,已成为多种肿瘤干细胞的标记分子。Collins等[32]已成功从原代培养的前列腺癌细胞中分离高纯度的CD44+/整合素α2β1+/CD133+细胞(共表达此3种分子的细胞),并利用体外克隆形成实验、FACS和免疫荧光技术等,证实这些细胞具有多向分化、克隆形成、自我更新和较强的增殖潜能,即干细胞特性(干性)。
(四)ATP结合膜转运体(ABCG2)
ABCG2与前列腺癌多重耐药相关,被认为是分选化疗耐药性肿瘤干细胞样细胞的分子基础[16]。ABCG2+的细胞被证实是具有多向分化潜质的祖细胞,而ABCG2-的细胞为肿瘤干细胞。说明ABCG2可能并不是肿瘤干细胞分选的理想标记分子,但是却是识别肿瘤耐药性的重要标志。
四、前列腺癌干细胞的信号通路
常见前列腺癌干细胞研究的信号通路包括Notch、Wnt/β-Catenin、PTEN/PI3K/Akt和Sonic hedgehog(Shh)等。
(一)Notch通路
Notch是由四分之一Notch基因(Notch1-4)编码的异二聚体Ⅰ型跨膜受体蛋白,Notch受体和其配体结合后使其被激活,从而产生细胞内结合域(ICN),已有研究表明,ICN1在干细胞和CSCs中的表达上调[33]。最新研究表明,PCSCs中的ICN1活化蛋白水平显著提高,且PCSCs比非前列腺癌干细胞的化疗耐受性高得多[19],说明Notch通路参与前列腺癌的发生发展过程。
(二)Wnt/β-Catenin通路
Wnt信号通路是一条与配体、受体、辅助受体及下游分子协同作用的复杂的信号通路,在有丝分裂中可以影响同源染色体的定位,且其突变将导致染色质异常高表达或干扰Wnt信号通路以促进前列腺癌的发生。同时,Bisson等[34]发现Wnt信号通路不依赖于AR,推测其可能是雄激素耐受性相关的主要信号通路。
(三)PTEN/PI3K/Akt信号通路
研究证实,在前列腺癌中,肿瘤抑制基因PTEN发生了突变,而且,PTEN基因功能的丧失及AKT信号的激活同时也参与人前列腺癌的发生。小鼠PTEN基因敲除以后,前列腺组织可形成原位癌,并进一步发展成转移性癌肿瘤。Dubrowska等[35]研究亦发现PTEN/PI3K/Akt信号通路在维持前列腺癌干细胞样细胞的自我更新与分化中具有重要作用。
(四)Sonic hedgehog(Shh)通路
hedgehog(Hh)和其受体Patched(PTCH)和Smoothened(SMO)在胚胎发育和成年干细胞自我更新及再生和肿瘤的维持等方面起着至关重要的作用。Chang等[22]研究表明Hedgehog 信号通路在正常前列腺基底细胞/干细胞向PCSCs转化过程中起着重要作用,并且影响着PCSCs向转移性肿瘤的转变过程。
五、研究前列腺癌干细胞的临床意义
(一)针对前列腺癌干细胞高表达ABCG2和端粒酶的治疗
前列腺癌干细胞中ABC膜转运蛋白ABCG2呈高表达、端粒酶的水平明显升高, 通过抑制ABCG2及端粒酶活性可以抑制前列腺癌干细胞的生长[36]。且根据ABCG2+的细胞是具有多向分化潜质的祖细胞,而ABCG2-的细胞为肿瘤干细胞特点,设计抑制剂结合化疗药物使用亦能改善临床治疗的效果及预后。
(二)针对前列腺癌干细胞微环境的治疗
可能会抑制前列腺癌干细胞的恶性转化及分化过程。通过抑制血管内皮细胞因子的表达,可以显著抑制肿瘤的生长、浸润和复发。目前研究证明,常规前列腺癌的治疗会导致肿瘤微环境的变化,进而产生WNT16B蛋白,可能会提高肿瘤耐药性,致使肿瘤增殖或侵袭[37]。因此,同时针对前列腺癌干细胞及其分化细胞和微环境可以设计很好的前列腺癌的靶向治疗策略。
(三)针对前列腺癌干细胞信号通路的治疗
针对前列腺癌干细胞Notch和PTEN/PI3K/Akt信号通路的靶向治疗,可以阻止前列腺癌的发展和复发。如Hedgehog通路抑制剂环王巴明可导致异种移植到裸鼠体内的低分化、高致瘤性人前列腺癌细胞株PC3发生凋亡。且最新研究表明,粗糠柴毒素可通过PI3K/Akt/mTOR 信号通路诱导前列腺癌干细胞发生自噬与凋亡,从而抑制前列腺癌的进展[23]。
六、展望
前列腺“癌干细胞学说”的提出令我们对前列腺癌的分子机制有了更深入的认识,近年来在前列腺癌干细胞的研究方面取得了一些进展,如关于前列腺干细胞的成功分离和鉴别、表面标志物和信号通路的认识等。但目前对前列腺癌干细胞的研究仍然处于初级阶段,还有许多问题亟需解决,譬如如何更好地分离鉴定前列腺癌干细胞及其表型,其分化不同阶段表达的表面标志物是否相同,它在雄激素非依赖性前列腺癌(androgen independent prostate cancer,AIPC)形成中的具体机制,还有如何将癌干细胞发生和发展的分子机制转化为临床应用等。目前, 各种前列腺癌的治疗方法效果均不尽人意,特别是当患者在接受早期治疗后,很大一部分到中后期都发展成为致死性的AIPC,这可能因为我们抗雄激素治疗会杀死瞬时扩增和增殖的癌细胞,而作为前列腺癌发生根源的前列腺癌干细胞却存活下来,从而导致前列腺癌的复发和发展。因此深入地了解前列腺癌干细胞将有利于人类更好地针对前列腺癌干细胞进行治疗, 更有效地治疗前列腺癌患者。
致谢:本课题受国家自然科学基金面上项目(编号:81372772)和江苏特聘教授科研基金[苏教师(2012)34]资助
前列腺肿瘤; 肿瘤干细胞
1 孙颖浩. 前列腺癌研究进展. 上海医学 2013; 34(7): 487-488
2 Lapidot T, Sirard C, Vormoor J,et al. Nature1994; 367(6464): 645-648
3 Rosen JM, Jordan CT.Science2009; 324(5935): 1670-1673
4 Li S, Li Q.Int J Oncol2014; 44(6): 1806-1812
5 Singh SK, Clarke ID, Terasaki M,et al. Cancer Res2003; 63(18): 5821-5828
6 O'Flaherty JD, Barr M, Fennell D,et al. J Thorac Oncol2012; 7(12): 1880-1890
7 Dhawan P, Ahmad R, Srivastava AS,et al. Curr Top Med Chem2011; 11(13): 1592-1598
8 Ahmed N, Abubaker K, Findlay JK.Mol Aspects Med2013; 39: 110-125
9 Hamada S, Masamune A, Takikawa T,et al. Biochem Biophys Res Commun2012; 421(2): 349-354
10 Lang SH, Frame FM, Collins AT.J Pathol2009; 217(2): 299-306
11 Malaguarnera R, Frasca F, Garozzo A,et al. J Clin Endocrinol Metab2011; 96(3): 766-774
12 Ponti D, Costa A, Zaffaroni N, et al.Cancer Res2005; 65(13): 5506-5511
13 Shen MM, Abate-Shen C.Genes Dev2010; 24(18): 1967-2000
14 Wang ZA, Shen MM.Oncogene2011; 30(11): 1261-1271
15 Kurita T, Medina RT, Mills AA,et al. Development2004; 131(20): 4955-4964
16 Zhou S, Schuetz JD, Bunting KD,et al. Nat Med2001; 7(9): 1028-1034
17 Choi N, Zhang B, Zhang L,et al. Cancer Cell2012; 21(2): 253-265
18 Lawson DA, Zong Y, Memarzadeh S,et al. Proc Natl Acad Sci U S A2010; 107(6): 2610-2615
19 Zhang L, Liu C, Meng XM,et al. Mol Cell Biochem2015; 400(1-2): 17-28
20 Goldstein AS, Huang J, Guo C,et al. Science2010; 329(5991): 568-571
21 Kerr CL, Hussain A.Curr Opin Oncol2014; 26(3): 328-333
22 Chang HH, Chen BY, Wu CY,et al. J Biomed Sci2011; 18: 6
23 Kumar D, Shankar S, Srivastava RK.Cancer Lett2014; 343(2): 179-189
24 Domingo-Domenech J, Vidal SJ, Rodriguez-Bravo V,et al. Cancer Cell2012; 22(3): 373-388
25 Zhou BB, Zhang H, Damelin M,et al. Nat Rev Drug Discov2009; 8(10): 806-823
26 Barrandon Y, Green H.Proc Natl Acad Sci U S A1987; 84(8): 2302-2306
27 Li H, Chen X, Calhoun-Davis T,et al. Cancer Res2008; 68(6): 1820-1825
28 Zhang L, Jiao M, Li L,et al. J Cancer Res Clin Oncol2012; 138(4): 675-686
29 Salvatori L, Caporuscio F, Verdina A,et al. PLoS One2012; 7(2): e31467
30 Hurt EM, Kawasaki BT, Klarmann GJ,et al. Br J Cancer2008; 98(4): 756-765
31 Xin L, Lawson DA, Witte ON.Proc Natl Acad Sci U S A2005; 102(19): 6942-6947
32 Collins AT, Berry PA, Hyde C,et al. Cancer Res2005; 65(23): 10946-10951
33 Li Y, Hibbs MA, Gard AL,et al. Stem Cells2012; 30(4): 741-752
34 Bisson I, Prowse DM.Cell Res2009; 19(6): 683-697
35 Dubrovska A, Kim S, Salamone RJ,et al. Proc Natl Acad Sci U S A2009; 106(1): 268-273
36 Marian CO, Shay JW.Biochim Biophys Acta2009; 1792(4): 289-296
37 Sun Y, Campisi J, Higano C,et al. Nat Med2012; 18(9): 1359-1368
(2014-09-10收稿)
10.3969/j.issn.1008-0848.2014.11.017
R 737.25
