红鳍东方鲀(Takifugu rubripes)性别差异微卫星标记的筛选*
2014-04-16马爱军赵艳飞王新安何伟国孟雪松翟介明刘圣聪
岳 亮 马爱军 赵艳飞 王新安 何伟国 孟雪松 翟介明 刘圣聪
红鳍东方鲀()性别差异微卫星标记的筛选*
岳 亮1, 2马爱军1①赵艳飞1王新安1何伟国1孟雪松3翟介明4刘圣聪3
(1. 中国水产科学研究院黄海水产研究所 农业部海洋渔业可持续发展重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室 青岛 266071; 2. 上海海洋大学 上海 201306; 3. 大连天正实业有限公司 大连 116000; 4. 莱州明波水产有限公司 烟台 261418)
采用以BSA为基础的微卫星标记技术对红鳍东方鲀()雌、雄群体进行性别差异标记筛选的研究。用雌、雄各30个个体构建雌、雄基因池, 利用66对微卫星引物扫描雌、雄基因池。在雌、雄基因池中扩增出差异条带的引物有8对。用两个各包括30个雌、雄个体的群体对这8对引物进行两轮个体验证。结果表明, 引物f383在两个雌、雄群体中扩增出的差异条带与性别都呈极显著相关性(分别为0.710和0.673)(<0.01), f383是与红鳍东方鲀雄性呈正相关的微卫星标记。红鳍东方鲀性别差异微卫星标记的获得, 为其性别相关基因的克隆和性别决定机制的研究提供理论基础。
红鳍东方鲀; 微卫星; 性别差异
鱼类在脊椎动物的系统进化中处于承前启后的关键地位, 与鱼类性别有关的研究是国际上的科研热点。鱼类进化历史长久, 演化分支繁多(尚晓莉等, 2010), 作为低等脊椎动物, 其性别决定和分化机制相当复杂, 鱼类的性别决定机制具有原始性、多样性和易变性, 并具有所有脊椎动物的性别决定方式(文爱韵等, 2008)。鱼类性别发育是以遗传基因为基础, 并受到自身内分泌调节和外界环境的影响, 是三者相互作用的结果(高建军等, 2010), 这在一定程度上给鱼类性别相关的研究增加难度。鱼类性别相关的研究既具有重要的理论价值, 又具有可观的实用价值, 一直吸引着国内外鱼类研究者的极大关注。分子生物学技术的快速发展为研究者们指明了方向。DNA分子标记具有标记位点多、标记稳定可靠、特异性强、实验重复性强等特点(刘云国等, 2009), 为辨别鱼类的性别开辟了出路。RFLP、RAPD、AFLP 和SSR等是常用的分子标记技术。微卫星DNA以其保守性好、易于检测、多态性高、共显性遗传、在基因组中均匀分布等特点被广泛应用于遗传图谱的构建、品系间的遗传结构特点及性状与位点的连锁分析等方面的研究(徐兴莉等, 2011)。微卫星标记技术也被用于寻找与鱼类性别相关的分子标记。在虹鳟微卫星遗传连锁图谱的研究中, Sakamoto等(2000)在雄性图谱中发现两个与性别决定位点连锁的微卫星标记OmyFGT19- TUF和OmyRGT28TUF。随后, 另外两个与虹鳟雄性性别决定位点连锁的微卫星标记Ots517NWFSC和Ssa1NVH被Woram等(2003)发现。Stein等(2002)从红点鲑的Y染色体分离出与性别连锁的微卫星位点Yp136。Waldbieser等(2001)在构建沟鲶()遗传连锁图谱的过程中, 发现7个与性别决定位点紧密连锁的微卫星位点。Lee等(2004)在奥利亚罗非鱼中发现11个与表型性别连锁的微卫星标记。目前, 国内有关应用微卫星DNA标记技术已经筛选出的鱼类性别差异标记的报道罕见。
红鳍东方鲀(), 隶属于鲀形目(Telraodontiformes)、鲀科(Tetradontidae)、东方鲀属(), 是暖水性海洋底栖鱼类, 味道鲜美、规格较大、肉质比较紧、营养丰富、经济价值高, 为我国北方地区的优良海水养殖鱼类之一。由于红鳍东方鲀的卵巢有剧毒, 而精巢无毒, 口感嫩滑, 受到美食者青睐, 因而, 雄性红鳍东方鲀的市场价值更高。因此, 开展红鳍东方鲀性别差异分子标记筛选的研究, 在早期生长阶段筛选出雄性鱼种养殖, 对提高红鳍东方鲀的经济效益和市场价值有重要的现实意义, 也为其性别决定机制和性别相关基因的研究奠定基础。
1 材料与方法
1.1 实验材料
实验用的两批红鳍东方鲀样品, 第一批来自烟台市莱州明波水产有限公司, 雌、雄各30尾, 体长为33—39cm, 体重为1.18—1.95kg; 第二批来自大连天正实业有限公司, 雌、雄各30尾, 体长为36—43cm, 体重为1.52—2.98kg。解剖后观察性腺, 辨别出雌、雄, 每尾鱼取少量尾鳍于离心管中, 编号后至于-20°C冰箱保存。
1.2 实验方法
1.2.1 基因组DNA的提取和BSA基因池的建立 从-20°C冰箱中取出保存的样品, 快速剪取30mg尾鳍, 用海洋动物基因组DNA提取试剂盒提取DNA。提取的DNA样品用核酸测序仪测定浓度和260/280值。每个DNA样品取出部分稀释到50ng/mL, 其余DNA原液放在-20°C冰箱保存。
雌、雄个体各30个, 从稀释到50ng/mL的DNA溶液中各取10mL混合成相应的雌、雄基因池,-20°C保存基因池样品。
1.2.2 引物合成及PCR扩增 从Kai等(2011)与红鳍东方鲀遗传连锁图谱有关的文章中挑选66对雌、雄图谱中特异的微卫星引物。PCR反应体系为: 10×Taq buffer 1.6mL, dNTPs 1.3mL (2.5mmoL/L), DNA 1.2mL (50ng/mL),酶 0.2mL (5U/mL), 上下游引物各0.7mL (10mmoL/L), 加无菌双蒸水补至20mL。PCR反应程序: 94°C预变性5min; 94°C变性30s, 退火30s, 退火温度依引物而异, 72°C复性30s, 30个循环; 72°C延伸10min, 4°C保存。取PCR扩增产物5mL用1%琼脂糖凝胶电泳检测, 记录具有稳定扩增产物的引物。
1.2.3 变性聚丙烯酰胺凝胶电泳 PCR扩增产物经94°C变性5min, 冰浴10min, 用8%变性聚丙烯酰胺凝胶电泳检测。电泳条件: 电压490V, 电流60mA, 功率28W。先预电泳30min, 上样后电泳2h左右。
1.2.4 差异条带的筛选 记录并分析聚丙烯酰胺电泳条带, 通过雌、雄基因池的电泳结果, 初步筛选在两基因池间能扩增出差异等位基因片段的微卫星位点。用相应的引物, 按照上述的PCR反应条件对雌、雄各30个红鳍东方鲀个体进行PCR扩增。分析有差异的引物在个体上的具体扩增情况。如果差异等位基因片段在雌、雄群体中出现次数差异极显著, 则作为候选的性别特异微卫星标记, 其对应的引物作为下一轮验证的候选引物。
以第二批红鳍东方鲀雌、雄各30个个体基因组DNA为模板, 用候选的引物按照相同的条件进行PCR扩增和聚丙烯酰胺凝胶电泳检测, 验证候选标记的准确性。
1.2.5 差异等位基因片段的回收 利用无外源DNA污染的手术刀从8%的变性聚丙烯酰胺凝胶上切目的条带, 放入盛有 20mL去离子水的 1.5mL离心管中, 用剪刀剪碎, 置于 4°C过夜, 使胶中的DNA尽可能地溶解到液体中(刘昕, 2011)。然后, 12000r/min离心约 2min, 仔细吸取上清作为再次PCR扩增的模板, 按照上述PCR体系和程序进行反应。1%琼脂糖凝胶电泳检测后, 用琼脂糖凝胶回收试剂盒(TIAN gel Midi Purification Kit)回收目的条带。按照pGM-T克隆试剂盒的说明, 将目的DNA片段克隆到pGM-T载体上, 将阳性克隆送到上海生工生物工程公司测序。利用Chromas软件对测序结果剪切和拼接(只留下红鳍东方鲀本身的基因组序列), 用DNASTAR软件中的SeqMan对同一标记的多个序列进行比对来确定DNA序列, 通过数据库BLAST比对, 搜索该序列的同源序列。
2 结果
2.1 基因组DNA的提取
通过试剂盒提取的红鳍东方鲀雌、雄群体基因组DNA, 经过分光光度计检测,260/280值在1.8—2.0之间。琼脂糖凝胶电泳图片显示DNA片段较完整, 没有大量蛋白和RNA存在, 说明DNA质量较高。图1为部分DNA电泳图。

图1 样品DNA电泳图

表1 8对微卫星标记引物序列
2.2 BSA分池及PCR扩增结果分析
用66对引物对所构建的雌、雄基因池进行PCR扩增, 用8%的变性聚丙烯酰胺凝胶对PCR产物电泳检测, 检测结果显示: 在雌、雄基因池中扩增出差异条带的引物有8对, 分别为f172、f383、f638、f1497、f1050、f1372、f1637、f152。引物序列见表1。电泳结果如图2所示。
2.3 差异等位基因片段在个体中的验证
将BSA池中筛选到的8对引物在构建基因池的雌、雄各30个个体中进行PCR扩增, 通过8%变性聚丙烯酰胺凝胶电泳检测, 分析差异等位基因片段在不同雌、雄个体的扩增情况。结果发现: 引物f1050在30个雌性个体中均未扩增出条带, 在30个雄性个体中有8个个体扩增出条带; 引物f383在几乎所有(28/30)雄性个体中扩增出条带, 在个别(7/30)雌性个体中出现条带。这与BSA扩增结果一致。结果见图3。

图2 引物f172、f383、f638、f1497、f1050、f1372、f1637、f152在BSA中的扩增条带
a. 引物f172、f383、f638、f1497在BSA中的扩增条带; b. 引物f1050、f1372、f1637、f152在BSA中的扩增条带。M1. 100bp DNA标记; M2. 50bp DNA标记
用第二批红鳍东方鲀群体雌、雄各30个个体对f1050和f383这两对引物进行第二轮的个体验证显示: 引物f1050在雌、雄群体间的扩增条带数无显著差异, 而引物f383在雌性群体中只有极个别(3/30)个体中扩增出条带, 在雄性群体30个体中有23个个体扩增出条带。具体结果如图4所示。
结合图3和图4分析, 引物f383经过2个红鳍东方鲀群体共120个个体的验证, 在雌、雄个体中扩增出的条带都出现差异极显著的结果, 差异等位基因片段在60个雌性个体中出现10次, 频率很低, 为16.7%; 而在雄性60个个体中出现51次, 频率极高, 为85.0%。由此可知, 引物f383该位点的差异片段对红鳍东方鲀的性别极具雄性偏好性, 该位点应该与红鳍东方鲀性别决定区域存在相关关系。引物f383是红鳍东方鲀遗传连锁图谱中第19号染色体上的引物, 实验结果与Kai等(2011)的研究结果相符合。

图3 引物f383(a)和f1050(b)在雌、雄群体中扩增的显著差异条带
2.4 差异等位基因片段的克隆与测序结果
对与红鳍东方鲀雄性呈极显著正相关的微卫星位点f383的差异等位基因片段克隆并进行测序。利用Chromas 软件对测序结果剪切和拼接(只留下红鳍东方鲀本身的基因组序列)序列如图5所示。
利用Blast比对, 搜索这条序列的同源序列, 结果表明这条序列为公布的红鳍东方鲀第19号染色体上的一段, 同源性高达98%, 序列的覆盖率达100%。
3 讨论
高等脊椎动物的性别决定机制皆为人知, 而鱼类作为低等脊椎动物, 性别分化处于原始阶段, 性别决定和分化机制相当复杂, 鱼类的表型性别既受基因的决定, 又受环境因子的影响(李静等, 2007)。在被研究报道过的鱼类中, 有性染色体的鱼类占10% (Devlin, 2002)。在有性染色体的鱼类中, 决定性别的基因并不明显地集中于性染色体上, 常染色体上的基因更多地参与到性别决定中(姚延丹, 2009), 罗非鱼性别决定机制的研究为此提供佐证, Hammerman和Avtalion(1979)提出性别决定的“常染色体平衡理论”。因此, 根据染色体的形态来区分鱼类的性别在大多数鱼类中行不通。基于DNA水平的遗传性别鉴定方法可以克服这一困难, 但首先需要筛选性别特异的DNA标记, DNA标记是研究鱼类性连锁的重要工具, 因为DNA的分子结构不会受生理或环境因素的变化而改变(马洪雨, 2009)。
红鳍东方鲀味道鲜美、营养丰富、脂肪含量低、经济价值高, 是一种具有较大市场发展潜力的名优海水养殖鱼类。但是, 由于卵巢有剧毒, 误食甚至丧命; 而精巢无毒, 丰腴鲜美、洁白如乳、入口即化、美妙绝伦, 因此价格不菲(陆丽君, 2012)。因此, 开展红鳍东方鲀性别差异微卫星标记筛选的研究, 在其生长早期阶段通过分子标记技术选择雄性鱼养殖, 可以减少成鱼养殖的工作量, 提高资源的利用率, 增加经济效益。
本研究采用分离群体分组分析法(BSA法), 用66对微卫星引物对雌、雄基因池扫描, 初步筛选出在雌、雄基因池间扩增出差异条带的8对引物。如果与用单个个体进行引物筛选的方法相比, BSA法工作量大大减少, 为前者的1/30。最终筛选出的引物f383在雌、雄群体间扩增出的条带均达到差异极显著的水平。皮尔逊相关性检测结果表明, 两个群体中“雌雄分组”和“条带的有无”均呈现极显著的相关性(0.710和0.673)(<0.01), 表明引物f383与红鳍东方鲀的性别相关, 是与雄性正相关的标记。采用与刘改艳(2011)相同的统计方法, 在两个群体中, 该标记在60个雄性个体中出现51个条带, 雄性正确鉴定率为85.0%; 60个雌性个体中50个无带, 雌性正确鉴定率为83.3%; 性别的平均正确鉴定率为84.17%, 在个体中的出现率为50.83%。

图4 引物f383在雌、雄群体中扩增的显著差异条带
a. 引物f383在编号1—15的雌、雄群体中扩增的显著差异条带; b. 引物f383在编号16—30的雌、雄群体中扩增的显著差异条带
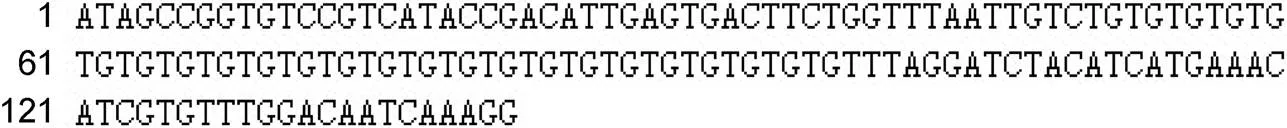
图5 红鳍东方鲀雄性相关微卫星标记DNA序列
与红鳍东方鲀雄性呈正相关的微卫星标记在雌性个体中出现的频率是16.7%, 在雄性个体中出现的频率是85.0%。说明该微卫星标记不是红鳍东方鲀雄性特异的分子标记, 而是与雄性紧密连锁的标记, 得到此结论可能有如下原因: (1) 实验所用材料不是来自同一家系, 环境条件不相同, 可能对红鳍东方鲀的表型性别有影响, 导致少数个体的基因型和表型相悖; (2) 红鳍东方鲀不存在性染色体或性染色体的分化程度较低。舒琥等(2010)在鲀形目染色体组型分析的研究中未发现红鳍东方鲀具有异型性染色体, 为该推测提供了理论基础; (3) 在减数分裂过程中发生染色体交换重组(杨东, 2006)。
Kai等(2011)发现, 以目前红鳍东方鲀完整的Tru19(总长度为16Mb)图谱为基础, 性别决定基因可能位于跨度为5Mb的区域, 该区域位于大的常染色体一样的区域侧翼。这对本实验引物的选择有重要的指示性作用, 在此基础上选择第19号染色体上的所有引物进行实验。Kikuchi等(2007)通过基因组范围的关联分析表明, 第19号连锁群的单一染色体区域决定红鳍东方鲀的性别, 而本实验筛选的性别差异引物f383来自Kai等(2011)构建的红鳍东方鲀遗传连锁图谱第19号染色体, 这与Kikuchi等(2007)的研究结果相符合。
红鳍东方鲀性别差异微卫星标记的获得, 为其性别相关基因的克隆和性别决定机制的研究提供理论基础。以该标记为基础的红鳍东方鲀性别鉴定技术可以在早期生长阶段对红鳍东方鲀进行性别选择, 实现分子标记辅助育种, 这对生产实践具有重要的指导作用和现实意义, 为红鳍东方鲀产业的发展提供更大的发展空间。
马洪雨, 2009. 三种重要海水养殖鱼类性别特异标记和微卫星标记开发及遗传连锁图谱构建. 青岛: 中国海洋大学博士学位论文, 13
文爱韵, 尤 锋, 徐永立等, 2008. 鱼类性别决定与分化相关基因研究进展. 海洋科学, 32(1): 74—80
刘 昕, 2011. 孔雀鱼遗传连锁图谱的构建及性别特异标记的筛选. 青岛: 中国海洋大学硕士学位论文, 39
刘云国, 刘贤德, 高 焕等, 2009. 水产生物DNA分子标记技术. 北京: 科学出版社, 1—2
刘改艳, 2011. 乌鳢、斑鳢性别差异SSR标记的初步筛选及其遗传多样性分析. 上海: 上海海洋大学硕士学位论文, 13
李 静, 陈松林, 邓思平等, 2007. 半滑舌鳎雌性特异扩增片段长度多态性标记的筛选与应用. 水产学报, 31(5): 591—597
陆丽君, 2012. 红鳍东方鲀国内主要养殖区养殖群体性别相关微卫星标记筛选. 上海: 上海海洋大学硕士学位论文, 1
尚晓莉, 曲宪成, 2010. 鱼类性别决定和性别分化机制研究进展. 江苏农业科学, 4: 245—248
姚延丹, 2009. 鱼类性别决定及其研究方法进展. 上海海洋大学学报, 18(1): 95
徐兴莉, 杨 虎, 2011. 微卫星DNA标记技术的特点及其在动物研究中的应用. 遗传育种, 272: 34—35
高建军, 高泽霞, 王卫民, 2010. 鱼类性别决定及性别特异分子标记的研究进展. 水产科学, 29(7): 432—437
舒 琥, 蔡晓阅, 刘 锋等, 2010. 鲀形目3种鱼的染色体组型分析. 动物学杂志, 45(2): 101—106
Devlin R H, Nagahama Y, 2002. Sex determination and sex differentiation in fish: an overview of genetic, physiological, and environmental influences. Aquaculture, 208 : 191—364
Hammerman I S, Avtalion R R, 1979. Sex determination in(Tilapia). Theoretical and Applied Genetics, 55: 177—187
Kai W, Kikuchi K, Tohari S, 2011. Integration of the genetic map and genome assembly offacilitates insights into distinct features of genome evolution in teleosts and mammals. Genome Biol Evol, 3: 424—442
Kikuchi K, Kai W, Hosokawa A, 2007. The sex-determining locus in the tiger pufferfish,. Genetics, 175: 2039—2042
Lee B-Y, Hulata G, Kocher T D, 2004. Two unlinked loci controlling the sex of blue tilapia (). Heredity, 92: 543—549
Sakamoto T, Danzmann R G, Gharbi K, 2000. A microsatellite linkage map of rainbow trout () characterized by large sex-specific differences in recombination rates. Genetics, 155: 1331—1345
Stein J, Reed K M, Wilson C C, 2002. A sex-linked microsatellite locus isolated from the Y chromosome of lake charr,. Environmental Biology of Fishes, 64: 211—216
Waldbieser G C, Bosworth B G, Nonneman D J, 2001. A microsatellite-based genetic linkage map for channel catfish,. Genetics, 158: 727—734
Woram R A, Gharbi K, Sakamoto T, 2003. Comparative genome analysis of the primary sex-determining locus in salmonid fishes. Genome Res, 13: 272—280
SCREENING OF MICROSATELLITES GENDER-INDICATIVE MARKERS OF
YUE Liang1, 2, MA Ai-Jun1, ZHAO Yan-Fei1, WANG Xin-An1, HE Wei-Guo1,MENG Xue-Song3, ZHAI Jie-Ming4, LIU Sheng-Cong3
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture; Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Qingdao 266071, China; 2. Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 3. Dalian Tianzheng Industrial Co. Ltd., Dalian 116000, China; 4. Laizhou Mingbo Aquatic Products Co. Ltd., Yantai 261418, China)
To determine the gender differences of male and female populations of, we screened the microsatellites based on bulked segregation analysis (BSA). Two gene pools were constructed with 60 individuals each containing 30 males and females, and scanned by 66 pairs of microsatellite primers, from which eight pairs of microsatellite primers of different bands were amplified and verified for the first round in the 60 individuals. The results show that the bands amplified by primers f1050 and f383 in male and female individuals differed significantly. And in the second round verification, bands amplified by primers f1050 in male and female individuals did not differ significantly, while bands amplified by primers f383 in male and female individuals differed significantly. In other words, primer f383 occurred in male individuals in two rounds of verification in coefficient 0.710 and 0.673, respectively, it is paternity-indicative for. The discovery shall provide a theoretical basis for gender-related gene cloning and sex determination.
; microsatellite; gender differences
10.11693/hyhz20120629001
* 中央级公益性科研院所基本科研业务费专项资金(20603022012005)资助。岳亮, 硕士研究生, E-mail: liang7650960@163.com
马爱军, 博士, 研究员, 博士生导师, E-mail: maaj@ysfri.ac.cn
2012-06-29,
2012-10-23
Q953
