人滑膜间充质干细胞的分离培养与鉴定*
2014-04-08陈松符培亮丛锐军吴海山许震宇
陈松符培亮△ 丛锐军吴海山**许震宇
(1.上海长征医院关节外科,上海 200003;2.第二军医大学组织胚胎学教研室,上海200433)
人滑膜间充质干细胞的分离培养与鉴定*
陈松1符培亮1△丛锐军1吴海山1**许震宇2
(1.上海长征医院关节外科,上海 200003;2.第二军医大学组织胚胎学教研室,上海200433)
背景:软骨一旦损伤将很难自我修复,组织工程学修复损伤软骨是目前的研究热点。组织工程学中找到合适的“种子细胞”至关重要。滑膜间充质干细胞(SMSCs)因较其他来源的间充质干细胞成软骨能力、增殖能力更强,且细胞容易获取、对机体损伤小等优点,越来越受到研究者的青睐。
目的:探讨人SMSCs体外分离、培养的方法与步骤,探索对SMSCs进行鉴定的最新方法。
方法:关节镜下获取 11 例行关节镜手术患者的滑膜组织,按照 Pei等[6]的方法分离培养滑膜干细胞;从细胞形态学观察、细胞生长 曲线分析、CCK-8 测定增 殖活力、流式细胞仪检 测细胞周期和细胞表面抗原、对 SMSCs进行成 脂/成骨/成软骨诱导、免疫细胞荧光染色以及RT-PCR检测成脂/成骨/成软骨相关基因的表达等方面对SMSCs进行鉴定。
结果与结论:按照Pei等的方法可以成功地从人滑膜组织中分离出干细胞,分离出的干细胞具有间充质干细胞特异性表型和多向分化潜能。
滑膜间充质干细胞;分离培养;鉴定;成脂诱导;成骨诱导;成软骨诱导
Background:It is difficult to repair the ininjuried cartilage,and it is a hot spot to repair the injuried cartilage by tissue engineering.An appropriate seed cell is crucial in ttissue engineering.Synovial mesenchymal stem cells(SMSCs)is easy to differentiate into cartilage than other source of mesenchymal stem cells.Meanwhile,SMSCs can be harvested easily.
Objective:To study the method and procedure of the isolation and culture of human SMSCs in vitro and investigate the lastest methods of SMSCs identification.
Methods:Synovial tissues were harvested from 11 patients undergoing arthroscopic surgery in our hospital.SMSCs were isolated and cultured according to Pei's method[6].The SMSCs were identificated from morphological observation,cell growth curve,proliferation activity determined by CCK-8,flow cytometer,induction of adipo-genic/osteogenicondrogenic immunofluorescence staining and RT-PCR.
Results and conclusions:SMSCs were successfully isolated from synovial tissue and had specific phenotype and potential multi-directional differentiation.
关节软骨一旦损伤将很难修复。运用自体软骨细胞移植技术治疗软骨损伤,愈后较好,但由于细胞来源不足以及因取材而造成的取材部位的病变等缺点,使 其 运 用受到了限制[1]。间充质干细 胞(mesenchymal stem cells,MSCs)来源于 胚 胎时期的中胚 层组织,具有很强的自我复制和多向分化潜能,具有向脂肪细胞、成骨细胞、软骨细胞及肌细胞等多种终末细胞定向分化的能力,运用MSCs来修复软骨损伤具有很好的应用前景[2]。2001 年,De Bari等[3]从人关节周围的滑膜中分离出了MSCs,即滑膜间充质干细胞。滑膜中的MSCs比例很高,平均每毫克滑膜组织中含(3~4)×103个有核细胞,平均10个有核细胞中就含有8 个左右MSCs,因此只需少量的标本就可以获得足量的滑膜间充质干细胞(SMSCs)。其数量是骨髓来源MSCs的100倍以上,并且随着供体年龄的增加,MSCs数量也并未出现明显减少[4]。由于其具有比骨髓、骨膜、脂肪及肌肉来源的MSCs更好的成软骨、成骨、成脂肪等多分化能力,更强的集落形成和扩增能力,以及取材方便、对机体损伤较小等优点[5],吸引了越来越多的研究者对其进行深入研究。本研究将探讨从人滑膜组织中获取和分离SMSCs的方法步 骤 ,探 索 对 SMSCs鉴 定 的 最 新 方 法 ,为 探 索SMSCs向软骨细胞分化的最优条件打下实验基础。
1 材料与方法
1.1 实验材料及主要试剂、仪器
滑膜来自11例于我科行膝关节镜治疗的患者,年龄16~35岁,平均 24.3 岁。滑膜组织无病变,术前征得患者的知情同意。本研究得到第二军医大学伦理 委 员 会 批 准 。HG-DMEM、0.25%Trypsin/EDTA(GIBCO/BRL公司,美国);一抗Ⅰ、Ⅱ型胶原、地塞米松、2-磷酸-抗坏血酸、L-脯氨酸、丙酮酸盐(Sigma公司,美国);一抗羊抗 Oct-4、鼠抗波形蛋白(Vimentin)、鼠抗人α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、鼠抗 Sox-2(Sigma-Aldrich 公 司,美 国);TGF-β3、胰岛 素 、ITS+Premix(R&D 公司 ,美国);FBS(HyClone公司,美国);Trizol(Invitrogen 公司,美国);q-PCR引物(由上海吉凯基因化学技术有限公司设计,上海英骏公司合成),逆转录试剂盒(上海宝曼生物科技有限公司),q-PCR 试剂盒 Quantitect SYBR Green PCR Kit及 q-PCR 仪 MX3005P multiplex quantitative PCR system(Stratagene公司,美国),miRNAmimics及其对照 mimics-NC(由上海吉玛制药技术有限公司合成),倒置相差显微镜(OLYMPUS公司,日本)。
1.2 人滑膜间充质干细胞的获得和分离培养
获取膝关节镜患者的滑膜,按照 Pei等[6]的方法分离滑膜干细胞。术中严格按照无菌操作的原则。无菌条件下于膝关节髌上囊处用髓核钳取出滑膜组织,将收集的标本浸于4℃无菌生理盐水中。将标本移入无菌操作台,PBS冲洗3次,剪除脂肪和部分结缔组织,分离出平滑光亮的滑膜组织。用无菌眼科剪将滑膜剪成 1.0~2.0 mm3碎块,将碎片移入 15 ml的离心管,依次用 0.1%的胰蛋白酶(30 min)和 0.1%胶原 酶 P(2 h)在 37℃、体 积分 数 为 5%的 CO2培 养 箱 中消化。消化结束后,经 120 目钢网过滤,1000 r/min 离心 10 min弃去上清液。重复3 次,除去含胶原酶的上清液,重悬细胞并计数。以1×104个有核细胞平铺于25 cm2培养瓶中,在 37℃、体积分数为 5%的 CO2条件下,在基础培养基(HG-DMEM、体积分数10%的胎牛血 清 、100 U/ml青 霉 素 和 100 U/ml链 霉 素 )中 培 养 ,24 h 后换液,除去未贴壁细胞,单层培养 7~14 d。连续观察细胞克隆的生长和形态学特征,挑选合适的细胞继续扩增培养,以此作为原代 SMSCs。细胞生长至亚融合状态时,2.5 g/L 胰蛋白酶消化,1∶3 传代接种于培养皿,每3日更换培养基。第3代细胞为目的细胞,即人滑膜间充质干细胞。
1.3 人滑膜间充质干细胞的鉴定
1.3.1 观察细胞形态,计算倍增时间和测定增殖活力(CCK-8 法):取第 3 代贴壁 SMSCs,用 0.25%Trypsin/ EDTA 消化,以离心半径 10 cm,1500 r/min 离心 10 min后,D-PBS 重悬并调整细胞密度约为 2.4×106/ml,接种于 96孔板中,每孔 200 µl,次日消化3 孔,细胞计数,倒置相差显微镜下计数3次,取平均值,以后每日消化3孔计数,取其平均值作为该天的细胞数,绘制细胞生长曲线。使用细胞计数仪计数,进行传代培养细胞生长曲线的分析。根据生长曲线对数生长期始末两点之间的变化,按照以下公式计算细胞数的倍增 时 间 :DT=t×log2/(1ogNt-logN0),t代 表 培 养 时 间(h),N0和Nt分别代表接种后及培养 t后的细胞数。
CCK-8测定增殖活力:取第3代贴壁 SMSCs,用0.25%Trypsin/EDTA消化,以离心半径10cm,1500r/min离心 10 min 后,D-PBS 重悬并调整细胞密度约为 2.4× 106/ml,接种于 96 孔板中,每孔 200 µl,37℃孵育 24 h后终止培养。每孔加入 CCK-8 10 µl,相同条件下继续培养 4 h。在酶联免疫检测仪上 450 nm 处测定每孔的 A 值,以时间为横轴,A450值为纵轴绘制细胞生长曲线。
1.3.2 流 式细胞仪检测细胞表面抗原:取第 3 代贴壁SMSCs,用 0.25%Trypsin/EDTA 消 化 ,以 离 心 半 径10 cm,1500 r/min 离心 10 min 后,D-PBS 重悬并调整细胞密度约为2.4×106/ml,取细胞悬液100 µl加入 3 µl加入不同的荧光标记单克隆抗体(CD-106PE、CD34-FITC、CD44-PE、CD45-PE、CD90-FITC、CD14-FITC、CD81-FITC、CD71-FITC、CD105-PE、CD29-FITC)和相应的同型对照抗体振荡混匀,室温避光放置 30 min。每管加入 2 ml含 1%NaN3的 PBS,混匀,1000 r/min 离心 5 min,弃上清,振荡重悬细胞。每管加入 200 µl含0.1%多聚甲醛的PBS溶液,混匀固定,4℃冰箱放置,待上流式细胞仪检测,以配套 CellQuest软件分析阳性细胞百分比。
1.3.3 hSMSCs 成 脂肪 细胞 诱导 分化 :取 第 3 代贴 壁SMSCs,以 2×105/cm2接种于6 孔板中,待细胞达80%~90%融合后,加入成脂分化诱导基础培养液(10% FBS+100 U/ml青霉素+100 U/ml链霉素+0.5 µmol/L谷氨酰+0.5 µmol/L 胰岛素+0.5 µmol/L 异丁基甲基黄嘌呤+0.5 µmol/L 吲哚美辛+0.5 µmol/L 地塞米松)诱导培养 14 d 后,吸出诱导培养基,PBS清洗2 次,4%多聚甲醛固定 30 min,油红 O 染色 30 min,镜检、拍照。
1.3.4 hSMSCs 成 骨 细 胞 诱 导 分 化 :取 第 3 代 贴 壁SMSCs,以 2×105/cm2接种于6 孔板中,待细胞达 80%~90%融合后,加入成骨分化诱导基础培养基(10% FBS+100 U/ml青霉素+100 U/ml链霉素+1 nmol/L 地塞米松、20 mmol/L β-甘油磷酸钠、50 mg/L 维生素 C)诱导培养 14 d 后,吸出诱导培养基,PBS 清洗 2 次,4%多聚甲醛固定30min,ALP染色,镜检、拍照。
1.3.5 hSMSCs 成 软骨 细胞 诱导 分化 :取 第 3 代贴 壁SMSCs,以 2×105个细胞接种后,以 1000 r/min 离心 6 min,置于 37℃、5%CO2饱和湿度孵箱中,于软骨诱导基础培养(TGF-β3 10 ng/ml+FGF-2 2 ng/ml+维甲 酸1 nmol/L+维生素 C 磷酸酯 50 µg/ml+脯氨酸 40 µg/ml+丙酮酸100 µg/ml+DEX100nmol/L+ITS+premix50mg/ml)中培养。诱导3周后弃培养基,PBS清洗2次,4%多聚甲醛固定30 min,石蜡包埋切片,脱蜡蒸馏水冲洗,甲苯胺蓝染色,镜检、拍照。
1.3.6 免疫细胞荧光染色:取第 3 代 SMSCs种植于玻璃铺片上,细胞生长贴壁汇合达60%后,PBS洗涤3次,4%多聚甲醛固定,2%牛血清白蛋白/PBS 室温封闭 10 min,一 抗 羊 抗 Oct-4(1∶50)、鼠 抗 Vimentin(1∶200)、鼠抗人 α-SMA(1∶200)、鼠 抗 Sox-2(1∶400)封闭过夜,FITC 标记的抗山羊 IgG 室温下 1∶500 稀释40 min;DAPI复染细胞核后荧光显微镜观察[2]。
1.3.7 总 RNA 的提取及 RT-qPCR 检测:取第 3 代贴壁SMSCs,以 3 mg/ml胶原酶 D 于 37℃溶解消化细胞3 h。总 RNA提取采用 TRIzol试剂盒,具体步骤参照说明书。以总RNA作为模板,逆转录和PCR反应参照试剂盒说明书进行操作。逆转录反应体积为25 µl:细胞RNA样品2 µg,随机引物OligodT100ng,10mmol/L dNTP 1.5 µl,Rnasin 20 U,M-MLV 200 U,M-MLV Buffer 5 µl。反应条件:70℃、5 min,42℃、1 h,95℃、10 min。PCR 采用 50 µl反应体系:cDNA 模板 2 μl,10 × PCR 缓 冲 液 5 μl,10 mmol/L dNTP 0.5 µl,Taq DNA 聚合酶 2.5 U,上、下游引物各 0.5 µl。引物序列见表 1。反应条件:94℃、5 min,94℃、45 s,54~60℃、45 s,72℃ 、45 s,30~35 个 循 环 ;72℃ 延 伸 5 min。 取10 µl扩增产物1%~1.5%琼脂糖凝胶电泳,紫外光分析装置拍摄。

表1 各基因引物序列
2 结果
2.1 SMSCs 的细胞形态学观察
SMSCs接 种 2 d 后 开始 贴 壁 生 长 ,原代 培养 的SMSCs具有很强的增殖能力,细胞呈多边形或星形;随着细胞不断增殖,细胞密度变大,第1代细胞形态逐渐变成圆形和梭形;经过传代培养后,各集落样生长的细胞长满汇合,细胞形态均匀一致,呈“向日葵”样分布。第3代滑膜细胞呈梭形(图1)。
2.2 SMSCs 的生长及增殖能力
SMSCs增殖生长曲线为典型S形,第3天开始进入对数生长期,至第8天生长趋势渐缓。根据生长曲线,代入公式可计算出细胞倍增时间为(30.2±2.4)h。在接种后的第l、2天,吸光度值变化不明显,且比第 l天略有减少,为细胞的潜伏适应期。第3天开始细胞迅速增加,第7天达最高,第8天则呈下降趋势(图2)。
2.3 流式细胞仪检测hSMSCs 周期

图1 滑膜间充质干细胞形态学观察(100×)
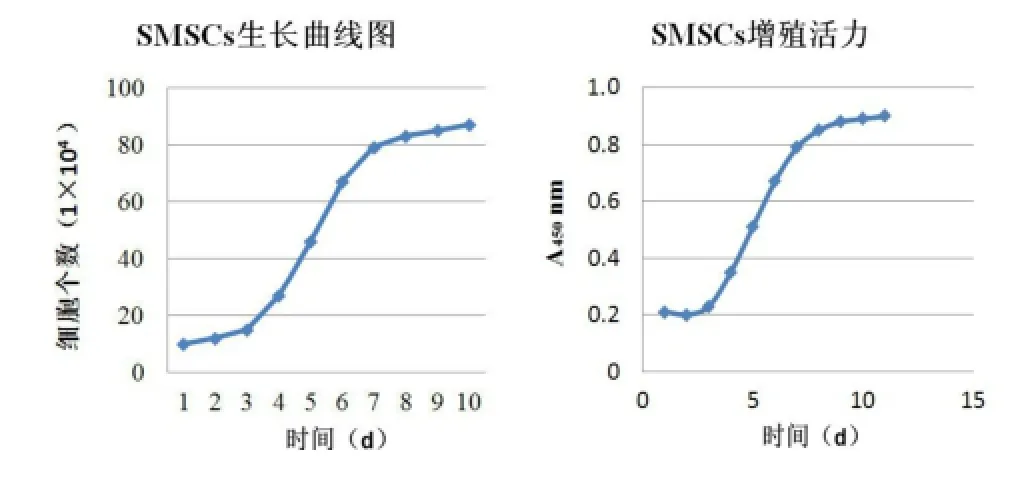
图2 滑膜间充质干细胞的生长及增殖能力检测
第 3 代 SMSCs中 ,处 于 S+G2+M 期 的 细 胞 占14.21%±3.14%,其中处于 S 期的为 8.92%±4.52%;而处于 G0+G1期的细胞占 86.79%±4.18%。结果说明大部分SMSCs处于静止期,只有少量的细胞处于活跃的增殖期。
2.4 流式细胞仪检测SMSCs 表面抗原
流式细胞仪对SMSCs的鉴定结果显示:同一表面分子在细胞群中的表达一致率在99%以上。其中CD44、CD106、CD105、CD90呈阳性表达(阳性率>99.9%,表 1),CD34、CD45、CD14、CD71呈阴性表达(<10%)。见表2。
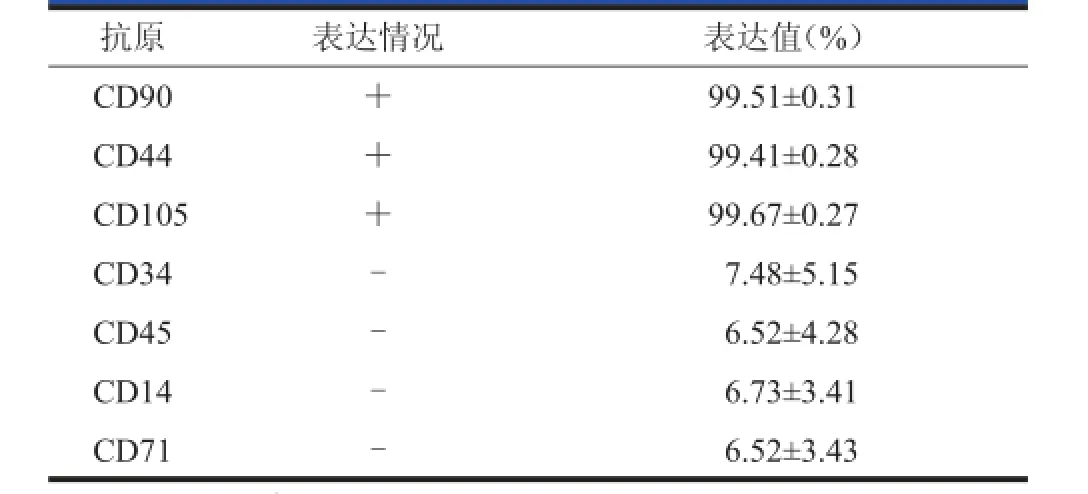
表2 流式细胞仪检测细胞表面抗原表达情况
2.5 SMSCs 成脂肪细胞诱导分化
成脂诱导 14 d 后,细胞体积逐渐增大,胞质中有小的圆形、透亮的脂滴出现。随着诱导时间的延长,脂滴逐渐增多增大,细胞由原来的梭形变成圆形,且相互融合。脂滴呈环状排列时,停止诱导,油红O染色见阳性(图3A)。
2.6 SMSCs 成骨细胞诱导分化
成骨诱导剂 1 d后,可见胞浆内有不透光物质的分泌和沉积,呈现小点状或片状。3~5 d后细胞继续生长,不透光物质面积增大,逐渐形成大片状或块状。成骨诱导 21 d 后,ALP 染色可见细胞质中出现棕黄色颗粒沉淀(图3B)。
2.7 SMSCs 成软骨细胞诱导分化
成软骨诱导 14 d,可见细胞形态逐渐由小梭形变为多角形,类似软骨细胞样形态,随着成软骨诱导分化时间的延长,多角形细胞数量逐渐增多,体积增大。诱导 21 d 后 ,甲苯胺蓝染色示有 软骨细胞特异性的细胞外基质GAG成分(图3C)。
2.8 免疫细胞荧光染色
免疫细胞荧光染色:第4 代 SMSCs细胞质中 Vimentin 和α-SMA 染色均呈阳性,α-SMA 特异性表达在SMSCs的胞膜上,呈空泡状荧光,细胞重叠处呈线状荧光,背景染色 轻。Oct-4 与 Sox-2 在细胞核中都有较强表达,其中 Oct-4表达更明显。见图 4。
2.9 RT-PCR检测脂肪、骨、软骨相关基因的表达
RT-PCR 检测细胞相关基因表达结果显示:成脂肪细胞特异性基因PPARγ2和LPL表达阳性;成骨细胞特异性基因Cbfa1、ALP、RUNX2表达阳性;成软骨特异性基因 SOX9、AGN、ColⅠ、ColⅡ、ColⅩ表达阳性。凝胶电泳结果显示如图5。
3 讨论

图3 滑膜间充质干细胞多向分化潜能检测
本研究中的滑膜取自行膝关节镜手术的年轻患者,由于膝关节滑膜组织位于关节囊的内层衬里,位置比较特殊,关节镜微创手术获取滑膜定位准确方便,易于取材,对机体创伤较小;另外,有研究表明,关节中的滑膜组织即使受到手术创伤或者化学损伤,其也能够完全恢复,对关节的功能和结构都没有明显影响[7]。有研究显示,1 mg 滑膜组织便可以收集2.1×104个有核细胞,每 1.0×103个滑膜细胞所含有的MSCs克隆数量是骨髓的 100 倍[8]。在增殖能力方面,脂肪来源的MSCs在第7代即丧失增殖力,而SMSCs在10代后仍保持增殖能力。因此滑膜是最佳的间充质干细胞的来源。
关节滑膜细胞分为两种:巨噬样细胞(A型)和成纤维样细胞(B型)。A型细胞与先天性及获得性免疫有关,B型细胞则产生滑液。SMSCs来源于B型细胞[9]。通过阴性分离 CD14 的干细胞可以产生富集 B型细胞的滑膜[10,11]。富集 B 型细胞的滑膜具有比混有A型和B型细胞的滑膜更强的成软骨能力,这一结果更加证明了 SDSCs来源于 B 型细胞的论断[11]。由于A型细胞没有B型细胞增殖快,所以细胞培养三代后就会得到富集B型细胞的细胞群。A型SMSCs具有更强的增殖和群落形成能力,且能够分泌大量的浅表层蛋白(SZP)[12]。
本研究中采用CCK-8法检测 SMSCs的增殖能力 ,与 MTT 方 法相比 具有显 著的特 点[13]:①灵敏 度高,数据可靠,重现性好;②操作简便,省时省力;③水溶性,不需要换液,尤其适合于悬浮细胞;④无需放射性同位素和有机溶剂,对细胞毒性低;⑤为1瓶溶液,毋需预制,即开即用;⑥适合于高通量药物筛选。从 SMSCs增殖曲线图可以得出,传代后的SMSCs具有极强的增殖能力,在第7天时达到生长的最高峰,倍增时间约为 30.2 h。
虽然SMSCs有别于其他MSCs,但它们的表面抗原决定簇表达和免疫抑制能力具有相似性。SMSCs与BMSCs的表面抗原决定簇差异极小,且至今为止还未发现能明显识别SMSCs的表面抗原决定簇。两种细胞类型都对CD14、CD34和CD45表达呈阴性,对CD44、CD73、CD90和CD105表达呈阳性;平均荧光强度无显著差异,但SMSCs中CD90平均荧光强度较高,这一发现或许可以解释为何SDSCs有较高的成软骨能力[14]。SMSCs对 CD9、CD10、CD13、CD54、CD55、CD166 和 D7-FIB 表达亦呈阳性,但这些标记分子并不是SMSCs独有的。本研究中,流式细胞仪对 SMSCs的鉴定结果显示 CD44、CD106、CD105、CD90的阳性表达率在99.9%以上。
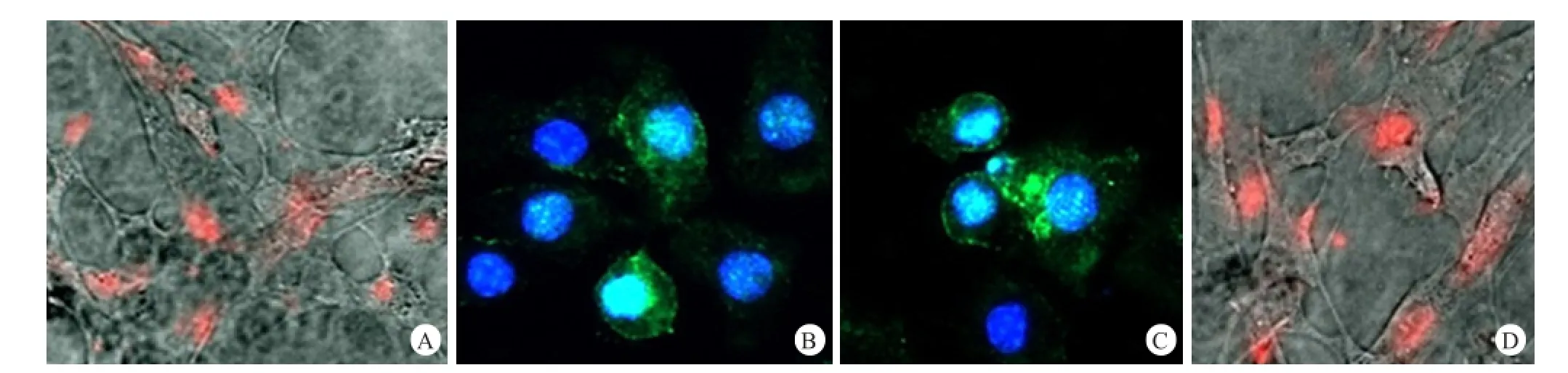
图4 免疫细胞荧光染色鉴定滑膜间充质干细胞标志物的表达

图5 RT-PCR 检测成脂、成骨、成软骨诱导过程中相关基因表达
SMSCs具有向脂肪细胞、成骨细胞、软骨细胞及肌细胞等多种终末细胞定向分化的能力[3]。本研究中,将SMSCs分别进行成脂、成骨、成软骨诱导,从细胞特异性染色、RT-PCR检测细胞特异性基因表达等方面对SMSCs的分化能力鉴定,结果显示SMSCs具有向脂肪细胞、成骨细胞、软骨细胞分化的能力。综上所述,我们从人的滑膜组织中成功分离培养出了干细胞,即滑膜间充质干细胞。
目前国内外对人SMSCs的研究还处于起步阶段,尽管人们对SMSCs的体内外增殖能力、多项分化 潜 能 等 方 面 进 行 了 广 泛 深 入 的 研 究[15],但 是 对SMSCs本身生理学、免疫学等基本功能的研究还缺乏相应的广度和深度。在成软骨能力方面,SMSCs相对于其他组织来源的MSC具有组织特异性优势,但其软骨产物还远远不够完善,如果要实现软骨的完全再生,还必须解决几个关键领域问题,如独特的能将MSCs分离鉴别出来的细胞表面标记分子、在开发过程中模拟人体自然生长的生长因子、确保再生表面与自然组织正常协同运作的生物摩擦等。我们相信,SMSCs作为一种新的种子细胞必将在组织工程、基因治疗和再生医学等各个领域发挥重要作用。
[1]Jones BA,Pei M.Synovium-derived stem cells:a tissue-specific stem cell for cartilage engineering and regeneration. Tissue Eng Part B Rev,2012,18(4):301-311.
[2] 符培亮,张雷,吴海山,等.腺病毒介导 BMP-2/7 共表达转染兔滑膜MSCs体外向纤维软骨样细胞分化的研究.中国修复重建外科杂志,2013,27(3):345-352.
[3]De Bari C,Dell'Accio F,Tylzanowski P,et al.Multipotent mesenchymal stem cells from adult human synovial membrane.Arthritis Rheum,2001,44(8):1928-1942.
[4] 芮云峰,王友.人滑膜间充质干细胞的研究现状.中华关节外科杂志(电子版),2007,4(1):60-62.
[5] 赵文君,邢国胜,于顺禄.滑膜间充质干细胞及其在组织工程中的应用.中国修复重建外科杂志,2011,25(12):1504-1507.
[6]Pei M,Zhang Y,Li J,et al.Antioxidation of decellularized stem cell matrix promotes human synovium-derived stem cell-based chondrogenesis.Stem Cells Dev,2013,22(6): 889-900.
[7]Rodriguez-Merchan EC.Regeneration of articular cartilage of the knee.Rheumatol Int,2013,33(4):837-845.
[8]Iwakura T,Sakata R,Reddi AH.Induction of chondrogenesis and expression of superficial zone protein in synovial explants with TGF-beta 1 and BMP-7.Tissue Engineering Part A,2013,19(23-24):2638-2644.
[9]Kurth TB,Dell'accio F,Crouch V,et al.Functional mesenchymal stem cell niches in adult mouse knee joint synovium in vivo.Arthritis Rheum,2011,63(5):1289-1300.
[10]Bilgen B,Ren Y,Pei M,et al.CD14-negative isolation enhances chondrogenesis in synovial fibroblasts.Tissue engineering Part A,2009,15(11):3261-3270.
[11]Pei M,He F,Vunjak-Novakovic G.Synovium-derived stem cell-based chondrogenesis.Differentiation,2008,76(10): 1044-1056.
[12]Lee SY,Nakagawa T,Reddi AH.Mesenchymal progenitor cells derived from synovium and infrapatellar fat pad as a source for superficial zone cartilage tissue engineering: analysis of superficial zone protein/lubricin expression.Tissue Eng Part A,2010,16(1):317-325.
[13]Song D,Li Y,Cao J,et al.Effect of iron deficiency on c-kit (+)cardiac stem cells in vitro.PloS one,2013,8(6):e65721.
[14]Nagase T,Muneta T,Ju YJ,et al.Analysis of the chondrogenic potential of human synovial stem cells according to harvest site and culture parameters in knees with medial compartment osteoarthritis.Arthritis Rheum,2008,58(5): 1389-1398.
[15]Pak J,Lee JH,Lee SH.A novel biological approach to treat chondromalacia patellae.PloS one,2013,8(5):e64569.
Isolation and identification of human synovial mesenchymal stem cells*
CHEN Song1,FU Peiliang1△,CONG Ruijun1,WU Haishan1**,XU Zhenyu2
(1.Department of Joint Center,Shanghai Changzheng Hospital,Shanghai 200003;2.Section of Histology&Embryology, Basic Research Department,Second Military Medical University,Shanghai 200433,China)
Synovial mesenchymal stem cells;Isolation;Identification;Adipogenic differentiation;Osteogenic differentiation;Chondrogenic differentiation
国家自然科学基金青年科学基金资助项目(81000798)
△为共同第一作者
**通信作者:吴海山,E-mail:wuhaishan@vip.sina.com
