荷移反应分光光度法测定青霉素钠的研究
2014-03-26刘芝平秦海峰
刘芝平 秦海峰
(太原理工大学化学化工学院,太原030024)
1 引言
青霉素钠(Benzylpenicillin Sodium)是一种广谱抗生素,临床主要用于治疗敏感细菌所致的感染,如猪丹毒、炭疽、气肿疽、恶性水肿、放线菌病、马腺疫、坏死杆菌病、牛肾盂肾炎、钩端螺旋体病及乳腺炎、子宫炎、肺炎、败血症等。目前关于青霉素钠已报道的分析方法主要有,高效液相色谱法[1,2]、分光光度法[3]、化学发光法[4,5]、毛细管电泳法[6,7]和极谱法[8]等。而利用苦味酸作为配体与青霉素钠反应形成荷移络合物测定青霉素钠含量的方法尚未见文献报道。本实验参考有关文献[9,10],基于药物分子中含有能够给予电子的基团,它与电子接受体苦味酸发生荷移反应,在乙醇介质中药物分子与苦味酸形成稳定的1∶1荷移络合物。进一步详细研究了青霉素钠与苦味酸形成荷移络合物的反应条件,探讨了反应机理,建立了一种简便,快速测定青霉素钠含量的分光光度新方法,结果令人满意。
2 实验部分
2.1 主要仪器与试剂
仪器:UV-265紫外可见分光光度计(日本岛津公司);HH-S型恒温水浴锅(河南巩义市英峪予华仪器厂)。
试剂:3×10-3mol/L-1苦味酸乙醇溶液(北京鑫鼎鹏飞科技发展有限公司,AR);200μg/mL青霉素钠乙醇标准溶液(中国药品生物制品检定所);所用试剂均为分析纯,实验用水为二次去离子水。
2.2 实验部分
准确吸取一定量的200μg/mL青霉素钠乙醇标准溶液于10mL容量瓶中,加入3×10-3mol/L苦味酸乙醇溶液1.0mL,用乙醇稀至刻度,摇匀后在室温下放置10min,用1cm的比色池以试剂空白为参比,于波长391.2nm处测定其吸光度。
3 结果和讨论
3.1 吸收光谱
按照实验方法配制溶液于分光光度计上扫描,所绘制吸收光谱见图1,苦味酸试剂的吸收波长λmax=360.8nm,青霉素钠的吸收波长λmax=284.8nm,在青霉素钠溶液中加入苦味酸溶液后,在391.2nm处出现一新的吸收峰,表明有新物质生成,且吸光度值与浓度在一定范围内呈良好的线性关系。本实验以络合物391.2nm作为测定波长,同时以试剂空白为参比,测定溶液的吸光度值。
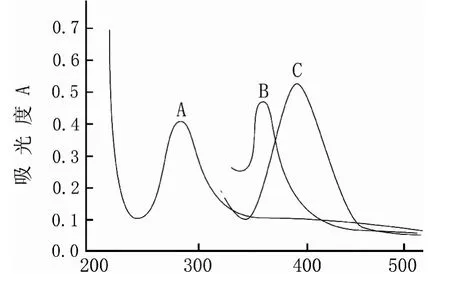
图1 吸收光谱
3.2 溶剂的选择
选用水、乙醇、甲醇、丙酮、乙腈、二甲基亚砜等不同的溶剂按照实验方法配制溶液,测量其吸光度,结果表明,青霉素钠与苦味酸分别在乙醇和丙酮溶剂中测得其吸光度值最大,本实验选择乙醇作为反应溶剂。
3.3 反应温度与反应时间的影响
按照实验方法进行实验,改变反应温度20~60℃和反应时间1~60min,测量其吸光度,结果表明青霉素钠与苦味酸生成的络合物在反应温度在室温下,反应时间1~60min时其吸光度达到最大值并趋于恒定,本实验选择反应时间为10min。
3.4 苦味酸试剂用量的影响
按照实验方法进行,改变苦味酸试剂用量,结果表明,青霉素钠与3×10-3mol/L苦味酸反应时,苦味酸试剂用量在0.8~3.0ml范围内吸光度趋于恒定,本实验选用苦味酸试剂1.0mL,见图2。
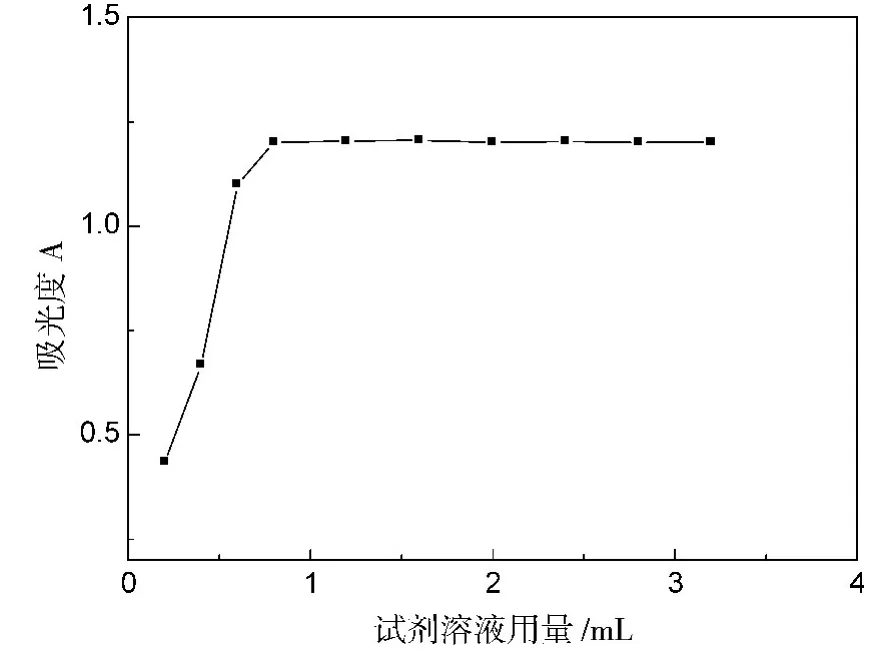
图2 苦味酸试剂用量的影响
3.5 标准曲线及灵敏度
分别取0.2mL、0.4mL、0.8mL、1.0mL、1.5mL、2.0mL、3.0mL的青霉素钠200μg/mL标准溶液,按照实验方法测量其吸光度,并绘制标准曲线,见图3。青霉素钠含量在4~60μg/mL符合比尔定律,相关系数为r=0.9992,线性方程A=0.0506C+0.0134,表观摩尔吸光系数ε=1.64×104L.mol-1.cm-1。
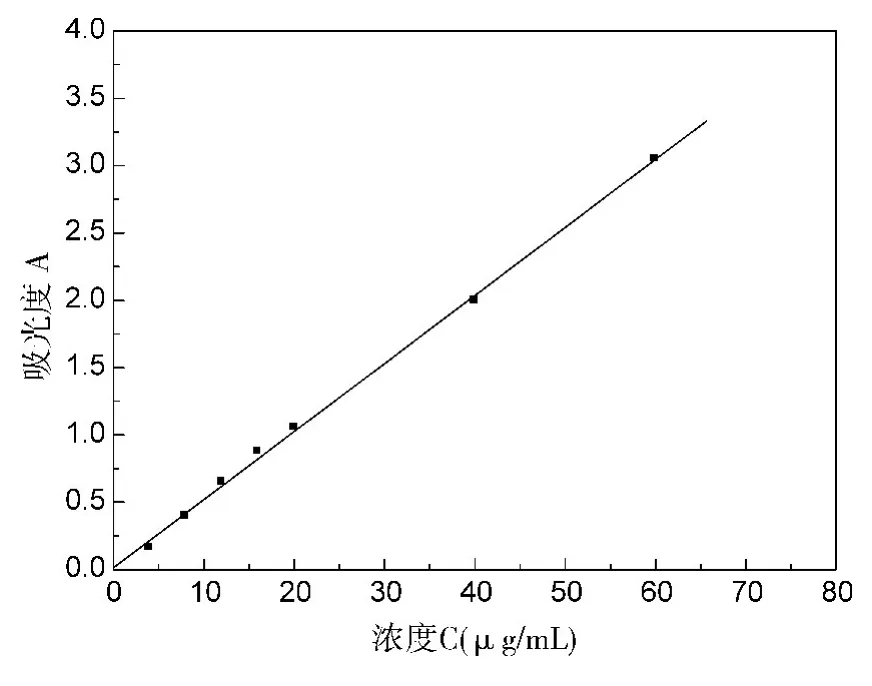
图3 标准曲线
3.6 络合物组成及反应机理探讨
用等摩尔连续变化法测定青霉素钠与苦味酸形成络合物的组成比为1∶1,见图4。在青霉素钠分子中含有电子给予体的基团存在[9,10],而苦味酸是一个良好的电子接受体[11,12],在乙醇溶液中青霉素钠与苦味酸可生成稳定的荷移络合物,经实验测得在波长391.2nm处有一强的特征吸收峰,与原来药物吸收峰相比有明显红移,证明生成了荷移络合物。
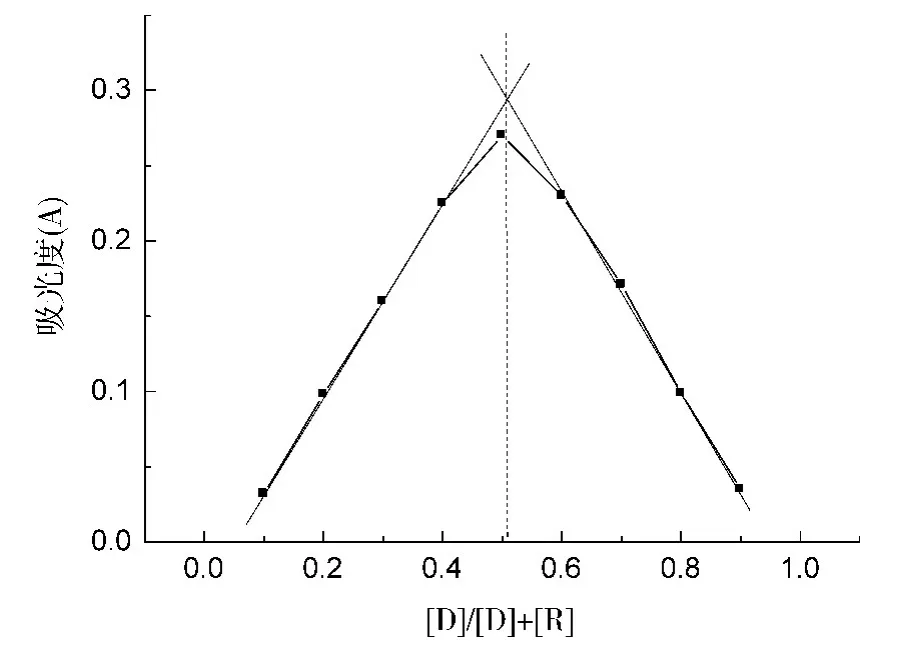
图4 等摩尔连续变化法
3.7 干扰物质实验
在实验的最佳条件下考察了其它物质对青霉素钠测定的干扰情况。当相对误差在±5%时,结果表明,600倍量的乳糖或淀粉,500倍量的蔗糖或萄葡糖,300倍量的硬脂酸镁和100倍量的果糖等共存物质均不干扰测定。
3.8 样品分析
3.8.1 试样溶液制备
取注射用青霉素钠1支(青霉素钠960mg/支),准确称取青霉素钠药粉300mg,用适量水溶解,至于1000mL容量瓶中,用水稀释至刻度(浓度约为300μg/mL),摇匀备用。
3.8.2 样品含量的测定
精密量取上述样品制备溶液1.00mL于10mL的容量瓶中,按实验方法进行测定,代入线性方程计算每枚药物中青霉素钠的平均含量,结果见表1。
3.8.3 方法的回收率和精密度
精密量取经多次测定已知含量的同一批青霉素钠适量样品制备溶液,分别加入不同量的青霉素钠标准溶液,至于10 mL的容量瓶中,按实验方法测量其吸光度,平行测定5次,按标准加入法测定回收率为98.60%-100.5%,相对标准偏差≤1.66%,结果见表1。
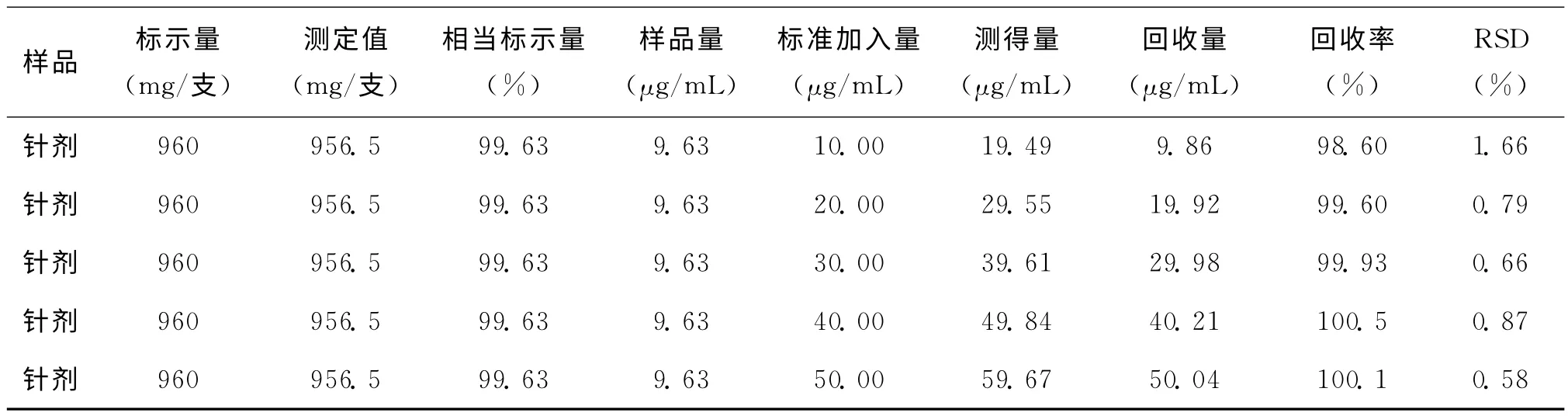
表1 样品测定结果及回收率(n=5)
4 结论
该方法利用苦味酸试剂作为电子接受体与电子给予体青霉素钠反应,在乙醇溶液中形成稳定的1∶1荷移络合物,并在波长391.2nm处出现较强的络合物特征吸收峰,证明生成了荷移络合物,与原来药物吸收峰相比有明显红移。经对实验条件进行优化,青霉素钠含量在4~60μg/mL符合比尔定律,相关系数为r=0.9992,同时对市售样品青霉素钠针剂和胶囊进行测定及回收率实验。回收率为98.60%~100.5%,相对标准偏差≤1.66%。该方法简便,快速,测定波长在可见区,易于推广,为定量测定青霉素钠制剂提供了一种新方法。
[1]中华人民共和国卫生部药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2010:422-426.
[2]Jain Rohit,Wu Zimei,Tucker,Ian G.A stability-indicating HPLC assay with diode array detection for the determination of a benzylpenicillin prodrug in aqueous solutions[J].Journal of Pharmaceutical and Biomedical Analysis,2009,50(5):841-846.
[3]刘士云,赵新昌,王宁,杨继华,彭学英,王信英.紫外分光光度法测定注射用青霉素钠的含量[J].山东医药工业,1994,(2):16-17.
[4]石文兵.KIO4-鲁米诺化学发光体系测定青霉素钠[J].分析试验室,2009,(7):75-77.
[5]杨一青,马永钧,周敏,张德懿,魏琳琳,陈慧.流动注射化学发光法测定青霉素钠[J].药物分析杂志,2006,(2):232-236.
[6]Pajchel Genowefa,Michalska Katarzyna,Tyski Stefan,Application of capilllary electrophoresis to the detemination of various benzylpenicillin salts[J].Journal of Chromatography A,2004,1032(1):265-272.
[7]Zhu Yongxin,Dalle J.Schepdael A Van,Roets E,Hoogmartens J.Analysis of benzylpenicillin by capillary electrophoresis[J].Journal of Chromatography A,2004,792(1):83-88.
[8]Belal F,Rizk M S,Eid M,Polarographic determination of some penicillins through nitrosation[J].Journal of Pharmaceutical and Biomedical Analysis,1998,17(2):275-282.
[9]Gujral Rajinder Singh,Haque Sk Manirul,Shanker Prem.A novel spectrophotometric method for the determination Penicillin sodium[J].International Journal of Biomedical Science,2009,5(4):373-379.
[10]Askal Hassan F,Saleh,Gamal A,Omar Nabil M.Utility of certainπ-acceptors for the spectrophotometric determination of some penicillins[J].Analyst,1991,116(4):387-90.
[11]Magda Y,El-Mammli.Spectrophotometric determination of flucloxacillin in pharmaceutical preparations using some nitrophenols as a complexing agent[J].Spectrochimica Acta Part A,2003,59:771-776.
[12]Aisha S M Hossan,Hanaa M Abou-Melha,Moamen S Refat.In situsynthesis,photometric and spectroscopic studies of chelating system during the 1,4,7,10,13,16-hexaoxacyclooctadecane charge transfer reaction with different acceptors[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2011,79:583-593.
