敌百虫对中国林蛙蝌蚪生长发育的毒性效应
2014-03-25张育辉
马 瑜,李 勃,张育辉
1. 陕西师范大学生命科学学院 秦巴山区可持续发展协同创新中心,西安 710062 2. 陕西省微生物研究所,西安 710043
近年来,两栖动物种群数量不断下降,其原因之一是由于杀虫剂、除草剂等化学农药在水产养殖业及农业生产中的滥用导致土壤、地下及地表水源的持续污染[1-2],进而对整个水生生态系统产生影响[3-4],严重威胁两栖类的生存。有机磷农药是继有机氯农药被禁止使用后目前应用最为广泛的一类杀虫剂,它们可直接杀死两栖动物,也可通过影响其生殖行为、降低孵化率及引起免疫抑制而间接影响两栖类种群数量[5]。
敌百虫(trichlorfon),化学名O,O-二甲基-(2,2,2-三氯-1-羟基乙基)磷酸酯,是我国目前应用较为广泛的一种有机磷杀虫剂,由于其广谱、高效、低毒等特点而被广泛用于养殖业、种植业及加工业之中[6]。在水产养殖中,0.1~1.0 mg·L-1敌百虫通常用于防治水生昆虫对养殖对象的疾病感染和蠕虫的体外寄生,同时也可用于控制水体中的浮游生物[7-9]。但长期反复使用敌百虫,将导致杀虫剂残留在水体及淤泥中富集,造成水域化学污染,对鱼、蟹、虾类等非靶标生物中的有益生物产生直接毒性[10-12]。
有关敌百虫对鱼、虾等水产养殖生物的急性和慢性毒理学研究目前已有报道[13-15],但有关水域中有机磷杀虫剂对两栖动物幼体的生长发育影响的相关研究仍较少。两栖动物的胚胎及幼体发育过程均在水域中进行,其皮肤对水体中的离子等化学物质具有较高的渗透性,因而水体中有毒物质很容易影响胚胎及幼体的发育[16]。因此,两栖动物可作为检测水域化学污染效力的理想材料之一,其生态分布也可作为环境污染程度的指示种群[17]。
中国林蛙(Ranachensinensis)是广泛分布于中国北方各地的重要经济动物,近年来受栖息地水源生态环境污染的胁迫,野生种群数量急剧下降。本研究以野生中国林蛙蝌蚪为研究对象,通过急性毒性试验,获得敌百虫对中国林蛙蝌蚪的毒性指标。然后,将蝌蚪长时间暴露于安全浓度(SC)以下或略高于SC的低浓度敌百虫水体中,观察敌百虫对蝌蚪生长发育的影响,探讨水体中以敌百虫为代表的新型低毒类有机磷农药污染对两栖动物生长发育的毒性,为进一步深入研究其毒理机制提供资料,同时也为两栖动物生殖环境的保护、水生生态风险评价以及水域污染的治理提供依据。
1 材料与方法(Materials and methods)
1.1 材 料
中国林蛙(Ranachensinensis)受精卵采集于2013年3月陕西省西安市大峪水库附近,实验室孵化,孵化水温20±2 ℃,pH 6.8~7.0,盐度1.8~1.9 g·L-1。待蝌蚪发育至Gosner 28~29期[18],选用大小一致的蝌蚪进行水体暴露实验。敌百虫(90%晶体,湖北沙隆达公司),现用现配。
1.2 急性毒性试验
通过预实验,设10、15、20、25、30 mg·L-1敌百虫共5个浓度组,设1个空白对照组。处理和对照均设2个平行组,每组20只蝌蚪,每个处理浓度共40例。采用静水连续暴露,实验的前8 h连续观察,随后在12、24、48、72和96 h观察并记录蝌蚪的中毒症状和死亡数,并及时清理死亡蝌蚪。实验用水为曝气2 d以上的自来水,24 h更换1次,急性毒性实验期间禁食。
1.3 慢性毒性试验
在急性毒性试验的基础上,在零致死浓度(LC0)以下设0.2、0.5、1.0和2.0 mg·L-1敌百虫共4个暴露浓度,设1个空白对照组。处理和对照均设两个平行组,每组20只蝌蚪,每个处理浓度共40例。暴露水温20±3 ℃,每48 h换1次水并重新加药,加药4 h后投食,饲喂蛋黄、新鲜蔬菜和猪肝。实验前受试蝌蚪为28~29期,体重0.0856±0.0057 g,体长(从吻端至泄殖腔)7.012±0.14 mm。每天观察并记录蝌蚪的死亡和畸形数。分别在暴露28和42 d时,测量体重及体长,最后统计从暴露开始到75%的个体完全变态所用的时间。
1.4 数据处理
急性毒性实验数据用线性回归法处理,计算敌百虫分别在24、48、72和96 h对蝌蚪的零致死浓度(LC0)、半致死浓度(LC50)和全致死浓度(LC100),安全浓度(SC)采用公式:SC=96 h LC50×0.1计算。慢性毒性实验数据用SPSS 19.0软件处理,用单因子方差分析(one-way ANOVA)检测不同浓度组蝌蚪的体重、体长及变态时间的差异显著性。数据均用平均值±标准误差表示。p<0.05表示差异显著,p<0.01表示差异极显著。
2 结果(Results)
2.1 敌百虫对中国林蛙蝌蚪的急性毒性
2.1.1 蝌蚪的中毒症状
中国林蛙蝌蚪被暴露于含敌百虫的水体中后,立即表现出骚动不安,不断浮出水面,游速加快。在25和30 mg·L-1组,蝌蚪暴露6 h后开始出现中毒症状,卧于水底或侧仰游动,对玻棒触之的刺激反应迟缓,仅原地游动。在10、15、20 mg·L-1组,蝌蚪暴露12 h后出现中毒症状。暴露24 h,部分蝌蚪游动中平衡失调,有的尾部弯曲与身体呈一定角度。随着暴露时间的延长对外来刺激的反应愈发迟缓,似丧失知觉。在30 mg·L-1组,暴露24 h后出现蝌蚪死亡,在25、20和15 mg·L-1组,暴露48 h出现死亡,在10 mg·L-1组,72 h出现死亡。蝌蚪死亡后尾部多呈弯曲状,仰翻,外观浮肿、膨大。蝌蚪死亡后2 h内解剖观察,其鳃腔内充水,内鳃萎缩,肝脏、肠管和肾脏呈灰白色。
2.1.2 蝌蚪的死亡率
统计分析不同浓度敌百虫水体与蝌蚪死亡率的关系,在相同暴露时间,蝌蚪的死亡率随着敌百虫浓度的增加和处理时间的延长而升高(图1)。蝌蚪暴露在含敌百虫的水体中的死亡数和死亡率,用线性回归法计算敌百虫在24、48、72及96 h对中国林蛙蝌蚪的零致死浓度(LC0)、半致死浓度(LC50)、全致死浓度(LC100)及安全浓度(SC),并通过回归分析得出中国林蛙蝌蚪死亡几率与敌百虫浓度的回归方程(表1)。
2.2 敌百虫对中国林蛙蝌蚪生长的影响
在慢性毒性试验中,蝌蚪在不同浓度敌百虫水体和对照组中暴露21 d和42 d,对其体重、体长及全长进行测量并统计处理。结果显示(图2),暴露21 d,与对照组相比,1.0、2.0 mg·L-1组蝌蚪的体重增长较慢(p<0.05),其余处理组与对照组无显著差异(p>0.05)。在暴露42 d,与对照组相比,各敌百虫处理组蝌蚪体重增加均受到抑制,其中,0.2、0.5 mg·L-1组效应显著(p<0.05),1.0、2.0 mg·L-1组蝌蚪效应极显著(p<0.01)。
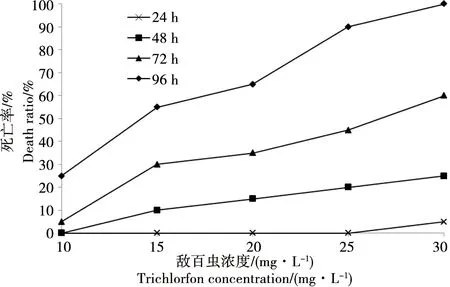
图1 敌百虫浓度与中国林蛙蝌蚪死亡率的关系Fig. 1 Relationship between trichlorfon concentration and death ratio of tadpoles Rana chensinensis
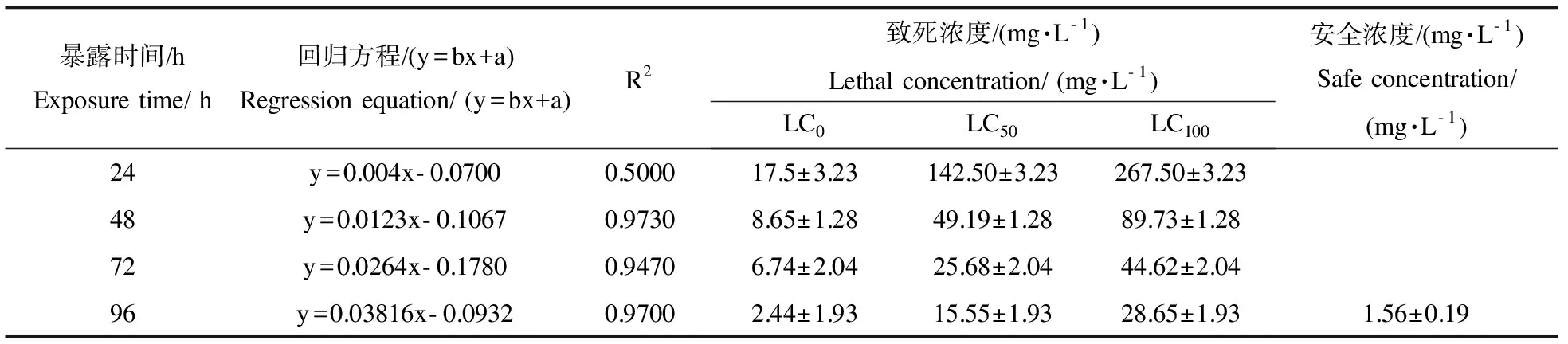
表1 中国林蛙蝌蚪暴露于敌百虫中死亡几率与敌百虫浓度的回归分析Table 1 Regress equation between death probability of tadpoles Rana chensinensis and trichlorfon concentration
注:y,死亡率几率值;x,敌百虫浓度;b,回归系数;a,截距。 Note:y, death probability value;x, trichlorfon concentration; b, regression coefficient; a, intercept.
蝌蚪体长统计结果与体重统计结果相似(图3),在暴露21 d,与对照组相比,1.0、2.0 mg·L-1组中国林蛙蝌蚪的体长增加较慢(p<0.05),其余处理组与对照组无显著差异(p>0.05)。暴露42 d,与对照组相比,各敌百虫处理组蝌蚪的体长增加均受到抑制,0.2、1.0 mg·L-1组效应显著(p<0.05),1.0、2.0mg·L-1组效应极显著(p<0.01)。
比较蝌蚪暴露于不同浓度敌百虫后的体重和体长的变化,其规律趋于一致。可见敌百虫对蝌蚪生长的抑制效应在一定浓度范围呈剂量效应,随着暴露时间的延长,抑制效应逐渐显著,呈现时间累积效应规律。
2.3 敌百虫对中国林蛙蝌蚪发育的影响
在慢性毒性试验中,统计不同浓度敌百虫处理组蝌蚪从开始暴露的28~29期到75%个体完全变态所需时间、死亡率及致畸率。结果显示,2.0 mg·L-1组蝌蚪一直未达到75%个体完全变态,其它各敌百虫处理组与对照组相比,75%个体完全变态时间有不同时间的滞后(表2)。各敌百虫处理组中蝌蚪的死亡率和畸形率均高于对照组(表2)。畸形主要表现为尾巴弯曲,腹部膨大呈透明状,其内脏清晰可辨,个别个体后肢肥大或前肢缺失(图4)。

图2 中国林蛙蝌蚪暴露于不同浓度敌百虫中体重的变化注:与对照比较,*p<0.05,**p<0.01。下同。Fig. 2 Weight of tadpoles Rana chensinensis exposed to different concentrations of trichlorfonNote: *p<0.05,**p<0.01, compared with the control. Similarly hereinafter.
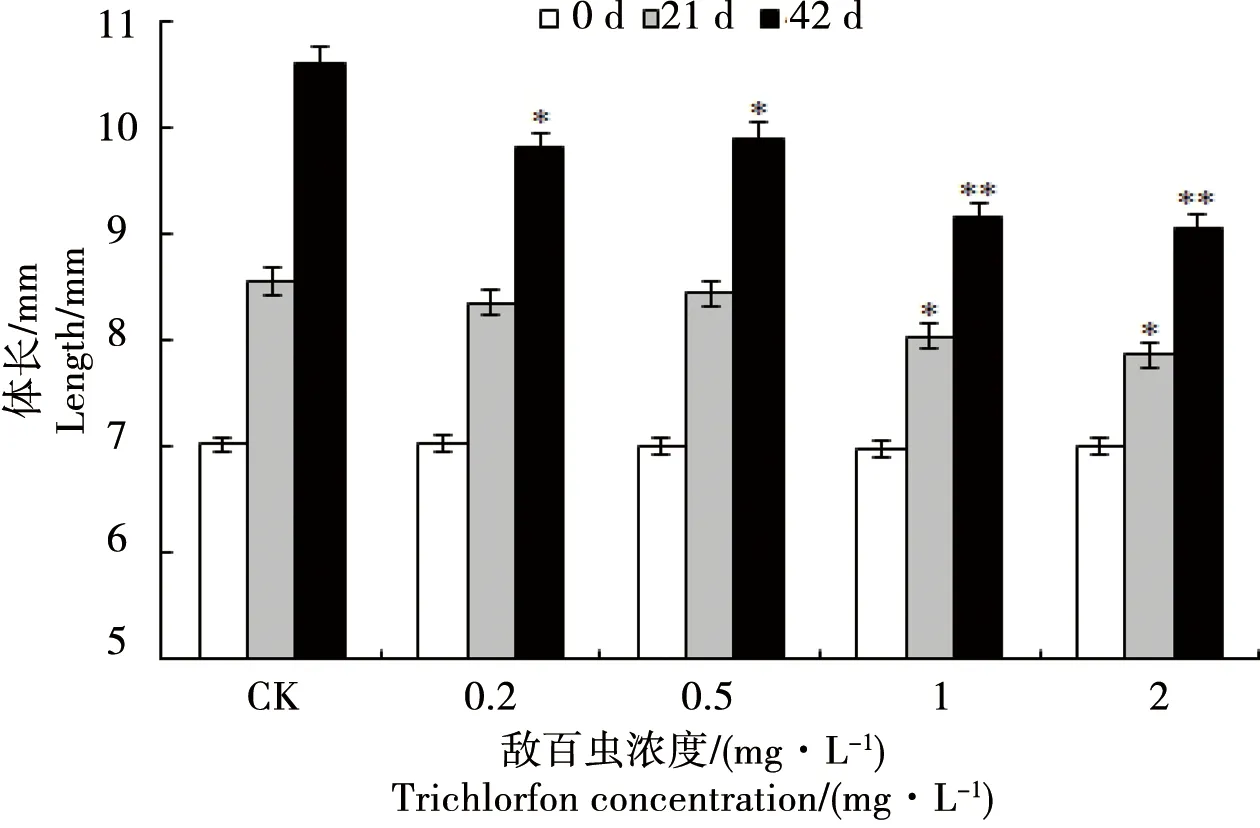
图3 中国林蛙蝌蚪暴露于不同浓度敌百虫中体长的变化Fig. 3 Length of tadpoles Rana chensinensis exposed to different concentrations of trichlorfon
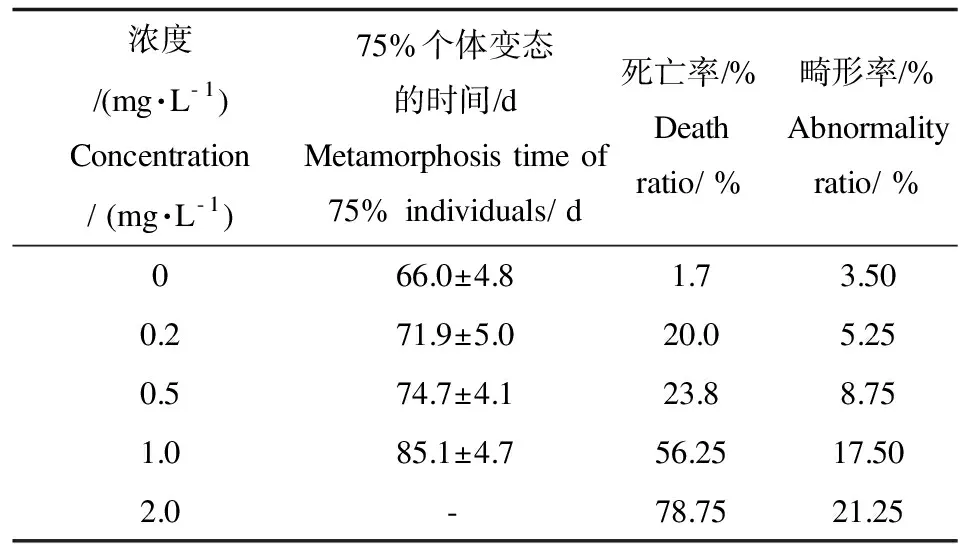
表2 中国林蛙蝌蚪暴露于不同浓度敌百虫后的变态时间、死亡率和畸形率Table 2 Death, abnormality ratio and metamorphosis time of tadpoles Rana chensinensis exposed to trichlorfon
注:-未完全变态。
Note:-has not been metamorphosis.

图4 中国林蛙蝌蚪暴露于敌百虫发生的畸形注:A,正常中国林蛙蝌蚪;B,尾部弯曲;C,腹部水肿;D,脏器呈灰白色;E,胸部膨大透明;F,变态后正常幼蛙;G,后肢肥大且前肢缺失。标尺=5 mm。Fig. 4 Abnormality of tadpoles Rana chensinensis exposed to trichlorfonNote: A, normal tadpoles R. chensinensis; B, tail bent; C, abdominal swelling; D, organs off-white; E, chest swelled and transparent; F, normal froglets Rana chensinensis; G, hindlegs hypertrophy and foreleg missing. Bar=5 mm.
3 讨论(Discussion)
3.1 敌百虫对中国林蛙蝌蚪的急性毒性
作为有机磷酸酯类杀虫剂,敌百虫的主要致毒作用是经机体吸收后与骨骼肌突触及肌肉神经接点的胆碱酯酶结合,形成不易水解的磷酰化胆碱酯酶,从而抑制胆碱酯酶的活性,导致乙酰胆碱在突触内蓄积,致使神经突触传导中断,引起生物神经功能紊乱,诱发中毒症状,被广泛用于农作物保护和害虫防治、生物体内外寄生虫的杀灭,也被用于治疗阿尔茨海默症[12,13,19,20]。除了引起抗胆碱酯酶作用,敌百虫对机体的毒性还包括对抗氧化防御体系造成影响,改变机体抗氧化激酶的活性,诱发体内、外的氧化应激反应[21-22]。
在本实验,中国林蛙蝌蚪的死亡率随着水体中敌百虫的浓度增加及暴露时间的延长而增高。中毒濒死的蝌蚪均呈现侧翻游动、并频繁出现肌肉抽搐等典型的神经中毒症状。死亡后尾部多呈强直性弯曲状,仰翻,外观浮肿、膨大。通过解剖观察,多数中毒致死的蝌蚪鳃腔内充水,内鳃萎缩,其肝脏、肾脏及肠管发生病变呈灰白色,说明除典型的神经毒性作用外,敌百虫还可能引起蝌蚪内脏的氧化损伤。统计结果显示,中国林蛙蝌蚪在含敌百虫的水体暴露24、48、72、96 h后的LC50分别为142.50±3.23、49.19±1.28、25.68±2.04和15.55±1.933 mg·L-1,其变化范围较大,表明敌百虫可在蝌蚪体内聚集,对机体产生直接毒性损伤,使得LC50在短时间内大幅度降低。其SC为1.56±0.19 mg·L-1,可见敌百虫对蝌蚪有较强的急性毒性。
近年来,由于对农药残留污染问题的日益重视,对于像敌敌畏、甲胺磷、三唑磷等对人及哺乳动物具有较强毒性的有机磷杀虫剂正在逐步被禁用,而对较低毒性的敌百虫则使用愈发广泛。与此同时,敌百虫对于非靶标生物的安全性问题也正在受到关注[23]。据报道,用含极低剂量敌百虫残留的饲料饲养草鱼,虽然不影响其进食量和存活率,但会引起草鱼生理反应的改变,如乙酰胆碱酯酶活性降低,引起肝组织结构发生改变,而且对疾病的易感性增加[23]。研究已表明,敌百虫对于水生生物的毒性具有较大差异。例如,对斑马鱼幼体和成体而言,其96 h的LC50分别为25.4和28.8 mg·L-1[24],另一报道敌百虫对斑马鱼和鲫鱼96 h的LC50值为52.50、58.29 mg·L-1[25],而对于沼泽绿牛蛙(Ranagrylio)蝌蚪的96 h LC50值为7.94 mg·L-1[26],本实验中测定敌百虫对中国林蛙蝌蚪的96 h LC50值为15.5 mg·L-1。尽管由于不同物种的生物学特性、原生活环境以及所处发育阶段的不同,可能导致有关实验数据具有一定的差异,但对于发育中的两栖类幼体,敌百虫的毒性仍是显著的。所以,所谓敌百虫的“低毒”只能是对人或大型的哺乳动物而言。目前在水产养殖以及田间施药中所使用的建议剂量将无疑对两栖动物的繁殖和生存造成严重威胁。因此对于敌百虫及其类似低毒类的有机磷杀虫剂对非靶标水生生物毒性的深入研究,对完善农药对水体及水源涵养地生态安全的风险评估显得尤为重要。
3.2 敌百虫对中国林蛙蝌蚪生长发育的影响
低剂量有机磷农药对于水生动物生长发育的毒理机制研究已有报道。如在罗非鱼(Oreochromisniloticus),0.25 ppm敌百虫暴露72 h即可引起鳃的水肿和充血,直接影响鱼体重的增长[11]。敌百虫可抑制鱼类胚胎和幼体的正常发育过程,导致发育畸形,甚至死亡。不同浓度敌百虫水体可降低斑马鱼胚胎的色素沉积,并影响孵化率和卵黄蛋白原吸收率,其效应呈现剂量和时间的依赖性。高剂量的敌百虫(160 mg·L-1)暴露2 d可引起89.6%的胚胎死亡,而较低剂量(20 mg·L-1)敌百虫暴露3 d则引起幼体心包产生水肿,并且氧化应激过程中关键代谢酶活性发生变化,诱发体内产生大量活性氧,这可能是敌百虫对机体产生毒性的机制之一[24-25]。在本实验,蝌蚪在SC以下的敌百虫水体中连续暴露,对其生长发育仍具有不同程度的抑制作用,说明敌百虫在SC以下的低剂量持续暴露也会对蝌蚪生存构成胁迫。在浓度为0.2 mg·L-1,体重和体长的增长也受到不同程度抑制。在浓度大于1.0 mg·L-1暴露21 d,蝌蚪的体长和体重增长均被显著抑制。在暴露42 d时,所有处理组蝌蚪的生长均受到不同程度的抑制。可见在SC以下的敌百虫对于蝌蚪生长的抑制随暴露时间的延长呈累积效应,与已有研究结果所得结论一致。
在慢性实验过程中,随着敌百虫剂量的增加,蝌蚪的死亡率升高。在浓度1.0 mg·L-1组在75%个体变态后,死亡率已达56%,在浓度略高于SC 的2.0 mg·L-1组,其死亡率达到78%。统计蝌蚪完成变态所需时间,经敌百虫处理后,各组蝌蚪变态所用的时间均滞后,而且 2.0 mg·L-1组未达到75%的个体变态就大部分死亡。观察可见,在SC以下的敌百虫水体中,在蝌蚪发育的各个期,敌百虫均可导致蝌蚪产生畸型,表现为身体扭曲、尾部强直性弯曲、腹部膨大、肢体缺失或畸形等。在略高于SC的2.0 mg·L-1水体中,这一现象更为严重。其原因可能是蝌蚪体壁结构较为简单,水体中敌百虫容易渗透作用进入神经系统并累积,通过抑制胆碱酯酶活性,导致乙酰胆碱蓄积,从而发生肌肉强直收缩,由于肌肉强直收缩导致身体扭曲或弯曲,蝌蚪无法自由游动及摄食,最终死亡。其实质应为神经性中毒[27]。
参考文献:
[1] Benitez F J, Real F J, Acero J L, et al. Photochemical oxidation processes for the elimination of phenyl-urea herbicides in waters [J]. Journal of Hazardous Materials, 2006, 138(2): 278-287
[2] Rebich R A, Coupe R H, Thurman E M. Herbicide concentrations in the Mississippi River Basin-the importance of chloroacetanilide herbicide degradates [J]. Science of the Total Environment, 2004, 321(1-3): 189-199
[3] Glusczak L, Loro V L, Pretto A, et al. Acute exposure to glyphosate herbicide affects oxidative parameters in piava (Leporimusobtusidens) [J].Archives of Environmental Contamination and Toxicology, 2011, 61: 624-630
[4] Rossi S C, Dreyer da Silva M, Piancini L D, et al. Sublethal effects of waterborne herbicides in tropical freshwater fish [J]. Bulletin of Environmental Contamination and Toxicology, 2011, 87(6): 603-607
[5] 李贞, 李丕鹏, 徐齐艳, 等.农药和化肥对无尾两栖类蝌蚪的毒性效应研究进展[J]. 生态毒理学报, 2010, 5(2): 287-294
Li Z, Li P P, Xu Q Y, et al. Research advances in toxicological effects of pesticide and fertilizer pollutants on the aruna larvae [J]. Asian Journal of Ecotoxicology, 2010, 5(2): 287-294 (in Chinese)
[6] Rodrigues E L, Ranzani-Paiva J T, Pacheco F J, et al. Histopathologic lesions in the liver ofProchiloduslineatus(Pisces, Prochilodontidae) exposed to sublethal concentration of the organophosphate insecticide Dipterex 500s (trichlorofon) [J]. Acta Scientiarum-Technology, 2001, 23(2): 503-505
[7] Herwig N. Handbook of Drugs and Chemicals Used in Treatment of Fish Diseases, Amanual of Fish Pharmacology and Material Medica [S]. Springfield. IIIinois: Thomas Publishers, 1979
[8] Chang C C, Lee P P, Liu C H, et al. Trichlorfon, an organophosphorus insecticide, depresses the immune responses and resistance toLactococcusgarvieaeof the giant freshwater prawnMacrobrachiumrosenbergii[J]. Fish Shellfish Immunology, 2006, 20: 574-585
[9] Graslund S, Bengtssona B E. Chemicals and biological products used in south-east Asian shrimp farming, and their potential impact on the environment-a review [J]. Science of the Total Environment, 2001, 280: 93-131
[10] Yeh S P, Sung T G, Chang C C, et al. Effect of an organophosphorus insecticide, trichlorfon, on hematological parameters of the giant freshwater prawn,Macrobrachiumrosenbergii(de man) [J]. Aquaculture, 2005, 243: 383-392
[11] Guimarães A T B, Silva de Assis H C, Boeger W. The effect of trichlorfon on acetycholinesterase activity and histopathology of cultivated fishOreochromisniloticus[J]. Ecotoxicology and Environmental Safety, 2007, 68(1): 57-62
[12] Qin J G, Dong P. Acute toxicity of trichlorfon to juvenile yabbyCheraxdestructor(Clark) and selected zooplankton species [J]. Aquaculture Research, 2004, 35(11): 1104-1107
[13] Chang C C, Rahmawaty A, Chang Z W. Molecular and immunological responses of the giant freshwater prawn,Macrobrachiumrosenbergii, to the organophosphorus insecticide, trichlorfon [J]. Aquatic Toxicology, 2013, 130-131: 18-26
[14] Sinha A K, Vanparys C, De Boeck G, et al. Expression characteristics of potential biomarkers genes in Tra catfish,Pangasianodonhypophthalmus, exposed to trichlorfon [J]. Comparative Biochemistry and Physiology, Part D, 2010, 5: 207-216
[15] 朱友芳, 洪万树. 敌百虫对中国花鲈的毒性效应[J]. 生态学杂志, 2011, 30(7): 1484-1490
Zhu Y F, Hong W S. Toxic effects of trichlorfon on perchLateolabraxmaculates[J]. Chinese Journal of Ecology, 2011, 30(7): 1484-1490 (in Chinese)
[16] Storrs S I, Kiesecker J M. Survivorship patterns of larval amphibians exposed to low concentrations of atrazine [J]. Environmental Health Perspectives, 2004, 112(10): 1054-1057
[17] Venturino A, Rosenbaum E, Caballero de Castro A, et al. Biomarkers of effect in toads and frogs[J]. Biomarkers, 2003, 8(3-4): 167-186
[18] Gosner K L. A simplified table for staging anuran embryos and larvae with notes of identification [J]. Herpetologica, 1960, 16: 183-190
[19] World Health Organisation (WHO). Environmental Health Criteria 132: Trichlorfon. International Program on Chemical Safety [S]. Switzerland: WHO, Geneva, 1992
[20] Lopez-Arrieta J, Schneider L. Metrifonate for Alzheimers disease [J]. Cochrane Database Systematic Reviews, 2006, 2: CD003155
[21] Chang C C, Lee P P, Hsu J P, et al. Survival, and biochemical, physiological, and histopathological responses of the giant freshwater prawn,Macrobrachiumrosenbergii, to short-term trichlorfon exposure [J]. Aquaculture, 2006, 253: 653-666
[22] Feng T, Li Z B, Guo X Q, et al. Effect of trichlorfon and sodium dodecyl sulphate on antioxidant defense system and acetylcholinesterase ofTilapianiloticain vitro [J]. Pesticide Biochemistry and Physiology, 2008, 92: 107-113
[23] Pucher J, Gut T, Mayrhofer R, et al. Pestiside-contaminated feeds in intergrated grass carp aquaculture: Toxicology and bioaccumulation [J]. Diseases of Aquatic Organisms, 2014, 108(2): 137-147
[24] Coelho S, Oliveira R, Pereira S, et al. Assessing lethal and sub-lethal effects of trichlorfon on different trophic levels [J]. Aquatic Toxicology, 2011, 103: 191-198
[25] 黄志斌.剑尾鱼在水产药物临床试验中应用研究[D]. 南京: 南京农业大学, 2006
Huang Z B. Application ofXiphophorushelleriin the research of aquatic pharmaceutical clinical experiment [D]. Nanjing: Nanjing Agricultural University, 2006 (in Chinese)
[26] 黄辨非. 敌百虫对沼泽绿牛蛙蝌蚪的急性毒性试验[J]. 湖北农学院学报, 1999, 19(2): 154-156
Huang B F. Studies on the acute toxicity of dipterex toRanagryliotadpole [J]. Journal of Hubei Agricultural College, 1999, 19(2): 154-156 (in Chinese)
[27] Peric L, Ribaric L, Nerlovic V. Cholinesterase activity in the tissues of bivalves Noah's ark shell (Arcanoae) and warty nevus (Venusverrucosa): Characterization and in vitro sensitivity to organophosphorous pesticide trichlorfon [J]. Comparative Biochemistry and Physiology, Part B, 2013, 165(4): 243-249
