不同处理方式的桑椹原料对其果酒品质的影响
2014-03-23,,,,,
, , , ,,
(1. 成都大学 肉类加工四川省重点实验室,四川成都 610106; 2. 四川理工大学学院生物工程学院,四川自贡 643000; 3. 四川国莎实业有限公司,四川成都 610000)
桑椹富含糖分、有机酸、游离氨基酸、多种维生素及微量元素,不仅具有极高的营养价值,而且具有许多保健功能。桑椹味甘,性寒,具有生津止渴、补肝益肾、滋阴补血、明目安神、利关节、去风湿、解酒等功效,长期食用可延年益寿,被列为“药食同源”的农产品[1 - 8]。桑椹酿制成果酒后产生的各种香味成分,可形成独特的风格特征。桑椹酒也是一种新兴的果酒,它是水果酒之中的极品,具有滋补、养身及补血之功效,有极高的营养价值和保健功效,有“万寿之酒”的美称[9 - 10]。
桑椹果酒中的活性物质主要为黄酮类、花色苷、多酚类等,在发酵过程中,不同处理方式的原料(新鲜桑椹、冻桑椹、干桑椹)酿制果酒,其活性物质的氧化及溶解速度将直接影响果酒品质的优劣。本研究主要通过对不同原料酿制桑椹果酒过程中酒精含量、总糖含量、色度色调、黄酮含量、多酚含量、花色苷含量的变化情况进行分析,不仅可以选择最佳的桑椹果酒生产原料,以达到缩短其发酵周期提高产量的目的。同时,通过选择最佳的桑椹保藏方式,克服桑椹果酒生产因原料供给而受季节的限制,为进一步酿制优质的桑椹果酒提供一定的理论依据。
1 材料与方法
1. 1 材料与仪器
果酒酿制活性干酵母 四川国友果业有限公司提供;桑椹 市售新鲜桑椹。
AR1140电子天平 梅特勒 - 托利多仪器(上海)有限公司;UV2400紫外可见分光光度计 上海舜宇恒平科学仪器有限公司;PHS - 3C 酸度计 奥豪斯仪器(上海)有限公司;ES - 36204万用加热炉 成都川西行科工贸有限公司;糖度计(0 ~ 50%) 格纳丝公司;酒精计 沈丘北郊玻璃仪器厂。
1. 2 实验方法
1. 2. 1 原料制备 冻桑椹:将新鲜桑椹放入0℃以下的冰箱中冷冻保藏7d以上。
干桑椹:将新鲜桑椹放入50℃左右的烘箱中干燥处理7d以上。
1. 2. 2 桑椹果酒的生产流程 桑椹原料→清洗、挑选→入罐→成分调整(白砂糖、SO2、菌种)→发酵→倒灌→陈酿→倒灌→下胶→过滤→陈酿→过滤→精滤→除菌→灌装→成品
原料处理:称量桑椹,加入一定体积的水进行打浆,使桑椹与水的比例为1∶ 2,在打浆过程中应及时分批加入适量的亚硫酸氢钠溶液,使SO2含量达到60 ~ 75mg/L,并同时加入180g/L的蔗糖,调节果浆中糖含量。
发酵:将打浆之后的桑椹果浆按照一定条件分装在不同250mL的锥形瓶中,用保鲜膜封口,放置在25℃下的培养箱中进行发酵,每两天测定其酒精度、糖度、黄酮含量、多酚含量、色度色调值以及花色苷含量,进行对比。
1. 2. 3 测定方法
1. 2. 3. 1 酒精度 利用密度瓶法对酒精含量进行测量[11]。
1. 2. 3. 2 总糖含量 用手持糖度计来测定。
1. 2. 3. 3 色度及色调的测定 测量果酒pH,用相同pH的磷酸氢二钠—柠檬酸缓冲液稀释n(n的数值由样品吸光度值的范围决定)倍,然后分别在420、520、620nm测其吸光值[12]。
色度=A420+A520+A620

1. 2. 3. 4 黄酮含量的测定 桑椹果酒中黄酮含量以芦丁计,以芦丁为标准品绘制标准曲线,样品分别先后与亚硝酸钠、硝酸铝反应6min,再加入氢氧化钠与乙醇放置15min,在510nm出测其吸光度[13]。
1. 2. 3. 5 多酚含量的测定 采用福林—肖卡法测定[14],桑椹果酒中多酚含量以没食子酸计,以没食子酸为标准品绘制标准曲线,样品与福林试剂、碳酸钠反应10min,在765nm处测其吸光度。
1. 2. 3. 6 花色苷含量的测定 采用pH差示法测定[15]。
A=(Aλmax-A700)pH1. 0- (Aλmax-A700)pH4.5
式中:n- 稀释倍数;ξ- 花色苷摩尔吸光系数(26900);M- 花色苷相对分子质量(449. 2,矢车菊 - 3- 单葡萄糖苷)
1. 2. 4 感官评定指标 参考文献[16]的方法,桑椹果酒色泽是否呈玫瑰红色,香气是否具有酒香及果香,口感是否有苦涩感觉。
2 结果与分析
2. 1 黄酮标准曲线
桑椹果酒中黄酮含量以芦丁计,方法同芦丁标准曲线的方法。在510nm处测其吸光度,以1号为空白,记录各吸光度并绘制标准曲线。
测量其标准曲线如图1所示。
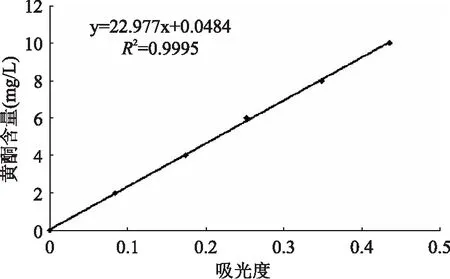
图1 芦丁标准曲线Fig. 1 Standard curve of rutin content
2. 2 多酚标准曲线
桑椹果酒中多酚含量以没食子酸计,在765nm处测其吸光度,以1号为空白,记录各吸光度并绘制标准曲线。
测量其标准曲线图2所示。

图2 多酚标准曲线Fig. 2 Standard curve of polyphenol content
2. 3 发酵过程中酒精度的变化
分别对四种不同处理方式的桑椹原料进行发酵,分析其发酵过程(2 ~ 10d)中酒精含量变化情况,如图3所示。

图3 发酵过程中酒精含量的变化Fig. 3 Change of the alcohol content during fermentation
由图3可知,冻桑椹的发酵液在发酵4 ~ 10d内酒精度趋于12. 9v/v达到稳定状态。整桑椹、桑椹浆、干桑椹的发酵液在发酵8 ~ 10d内酒精度分别趋于13、12. 1、11. 3v/v达到稳定状态。由此比较可以得出,在发酵过程中,四种不同原料酿制的桑椹果酒最后酒精度基本达到一致,在12v/v左右,但经过冷冻处理的冻桑椹在酿制初期果酒酒精度迅速增高,在第4d趋于稳定状态12. 9v/v左右,比较冻桑椹与其它三种原料的发酵时间,酒精度能提前达到稳定状态,缩短酿制周期,有利于提高果酒产量,适合桑椹果酒的酿制。
2. 4 发酵过程中总糖含量的变化
分别对四种不同处理方式的桑椹原料进行发酵,测量其发酵过程(2 ~ 10d)中总糖含量,绘制出总糖含量的变化情况,如图4所示。

图4 发酵过程中糖含量的变化Fig. 4 Change of total sugar content during fermentation
由图4可知,发酵过程中,冻桑椹发酵4d之后总糖含量趋于稳定状态5. 4%,而整桑椹、桑椹浆、干桑椹的发酵液在发酵8 ~ 10d总糖含量趋于稳定在5. 5%左右。四种不同处理方式的桑椹原料最后总糖含量基本达到一致,总糖含量维持在5% ~ 6%之间。冻桑椹中总糖含量变化迅速在第4d基本达到稳定状态5. 5%左右,总糖含量与酒精度含量变化成反比,即总糖含量降低越快,酒精含量升高越快,所以以冻桑椹为酿制果酒的原料能够较快达到国标中酒精度要求,缩短发酵周期。
2. 5 发酵过程中色度、色调的变化
分别对四种不同处理方式的桑椹原料进行发酵,测量其发酵过程(2 ~ 30d)中色度与色调的值,绘制出色度与色调的变化情况,如图5、图6所示。

图5 发酵过程中色度值的变化Fig. 5 Change of color intensity during fermentation

图6 发酵过程中色调值的变化Fig. 6 Change of Shade during fermentation
由图5可知,四种原料的桑椹果酒酿制过程中(发酵及陈酿),色度的变化是随着发酵的进行在第10d左右达到稳定值2. 0左右,随着陈酿的进行色度值基本不发生变化。色度值是随着发酵的进行有色物质在果酒中的溶解量越来越多,色度值越来越大,颜色越来越深。四种不同原料的桑椹果酒酿制过程中,干桑椹的发酵液色度值在整个发酵过程中变化不大而且保持在最高状态,整桑椹发酵过程中的色度值变化较大,是由于发酵后期花色苷的不断溶解而提高色度值,桑椹浆与冻桑椹发酵过程中色度值变化比较一致。
由图6可知,四种原料的桑椹果酒酿制过程中,干桑椹从发酵开始阶段到陈酿结束色调值基本不发生变化维持在0. 8左右,整桑椹、桑椹浆、冻桑椹是随着发酵的进行色度值不断增加在6 ~ 8d时达到最大值分别为1. 607、1. 774、1. 659,随着发酵的进行色度值开始逐渐降低当发酵进行20d时,趋于稳定状态分别为0. 71、0. 839、0. 825。综合桑椹果酒酿制过程中色度及色调变化情况,比较四种不同原料酿制的桑椹果酒的色泽,桑椹浆及冻桑椹酿制的果酒呈玫瑰红色,颜色鲜艳色泽为最佳,为桑椹果酒生产提供最佳生产原料。
2. 6 发酵过程中黄酮类物质及多酚类物质含量的变化
分别对四种不同处理方式的桑椹原料进行发酵,测量其发酵过程(2 ~ 10d)中黄酮类物质及多酚类物质含量,绘制出黄酮类物质及多酚类物质含量的变化情况,如图7、图8所示。
由图7、图8可知,在四种原料的桑椹果酒酿制过程中,黄酮类物质及多酚类物质是桑椹果酒中稳定性较好的,所以黄酮类物质及多酚类物质的含量变化不明显,黄酮类物质及多酚类物质的含量总体变化趋势是随发酵时间延长而增加。发酵前4d四种发酵液的黄酮类物质与多酚类物质含量上升的变化趋势较大,速度较快,4 ~ 8d上升的变化趋势较为缓慢,8d以后变化平缓趋于稳定。冻桑椹与桑椹浆的发酵液中黄酮类物质与多酚类物质含量变化情况相对于其它两种发酵液比较稳定,能够较快的达到稳定状态缩短发酵周期保证果酒品质。

表1 发酵过后桑椹果酒品质之间的比较Table 1 The comparison of the mulberry wine quality
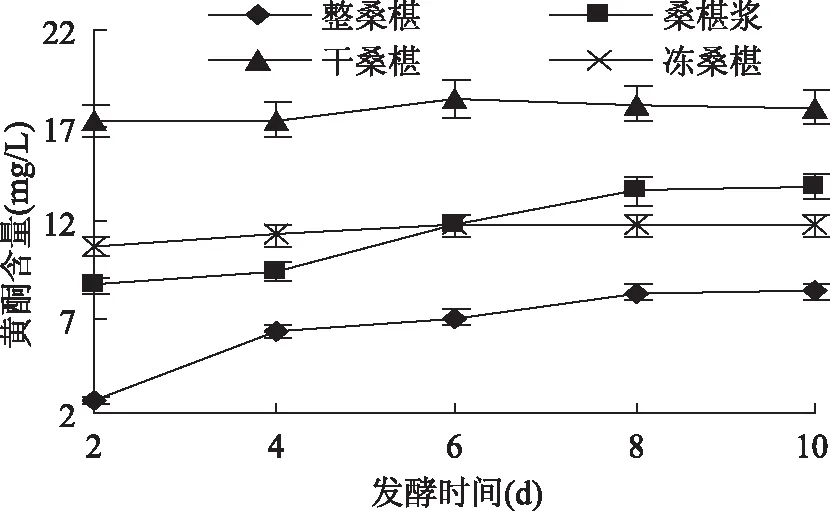
图7 发酵过程中黄酮含量的变化Fig. 7 Change of the flavonids compounds during fermentation
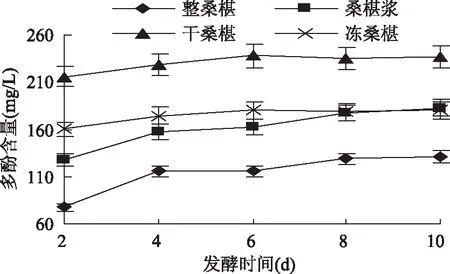
图8 发酵过程中多酚含量的变化Fig. 8 Change of the phenolics during fermentation
2. 7 发酵及陈酿过程中花色苷含量的变化
分别对四种不同处理方式的桑椹原料进行发酵,测量其发酵过程(2 ~ 30d)中花色苷含量,绘制出花色苷含量的变化情况,如图9所示。

图9 发酵过程中花色苷含量的变化Fig. 9 Change of the anthocyanidin during fermentation
由图9可知,在四种不同原料的桑椹果酒酿制过程中,花色苷较敏感易氧化,桑椹浆和冻桑椹发酵液中花色苷的含量与干桑椹和整桑椹发酵液中花色苷含量差距较大,干桑椹中的花色苷含量大多已经氧化变质,而整桑椹在果酒的整个发酵过程中为整个穗状,花色苷溶解量较少,所以出现含量差距较大的现象。四种不同原料的桑椹果酒酿制过程中,花色苷的含量变化趋势保持一致,随着发酵时间的进行花色苷含量逐渐升高,在第6d左右时达到了最大值,随着时间的进行花色苷被氧化而缓慢减少,到20d左右达到了稳定值,与发酵过程中色调相关,变化保持一致,桑椹浆与冻桑椹酿制的桑椹果酒中花色苷含量较高,酿制的果酒品质较好。
2. 8 发酵过后桑椹果酒品质之间的比较
综合酒精含量,总糖含量,色度,色调,黄酮,多酚以及花色苷含量,结果如表1所示。
对表1中整桑椹、桑椹浆、干桑椹、冻桑椹中的数据利用Excel软件进行相关性统计分析,各因素之间的相关性系数见表2所示。
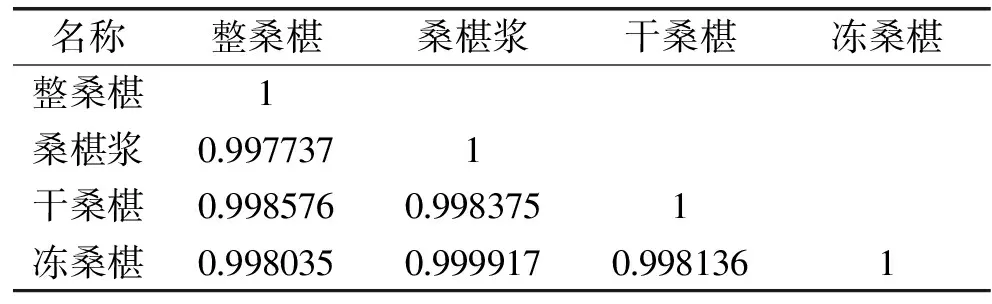
表2 发酵过后桑椹果酒相关性系数的比较Table 2 Comparing the correlation coefficient mulberry wine after fermentation
从表2中数据统计结果可以看出,各原料酿制桑椹果酒品质的相关性相关系数由大到小依次为桑椹浆与冻桑椹,干桑椹与整桑椹,桑椹浆与干桑椹,干桑椹与冻桑椹和桑椹浆与整桑椹的。从数据中可以得到冻桑椹与新鲜桑椹酿制的果酒品质相似性最好。
结合表1与表2可知,酒精含量与总糖含量互为反比关系,总糖含量是随着酒精含量的升高而降低,酒精度含量大于12(%vol)的果酒品质为佳,则整桑椹,桑椹浆以及冻桑椹酿制的果酒品质为佳。色度值与花色苷含量正相关,花色苷含量越高色度值越大,综合色度值与花色苷含量,则桑椹浆与冻桑椹酿制的果酒品质为佳。黄酮与多酚同为桑椹果酒中所含的活性物质,其变化趋势较一致如图7、图8所示,含量越高则为最佳,所以桑椹浆、冻桑椹及干桑椹酿制的果酒品质为佳,但干桑椹中花色苷大多被氧化而含量较少,所以新鲜桑椹打浆与冻桑椹打浆为最佳桑椹果酒生产原料,进一步比较其发酵时间,冻桑椹发酵周期比桑椹浆发酵周期短,能够缩短生产周期,所以冻桑椹打浆处理不仅在发酵时间上而且在发酵果酒品质上都为酿制桑椹果酒最佳原料,且冻桑椹利于长时间保藏,能够克服桑椹果酒生产的季节性困难。

表3 发酵过后桑椹果酒感官评价之间的比较Table 3 The comparison of the sensory evaluation of mulberry wine
2. 9 感官评价
由表3可知,经过冷冻处理的桑椹与新鲜桑椹酿制的果酒从色泽、滋味、香气方面相差不大,酒香浓郁,酒体丰满,具有吸引人的玫瑰红色。而整桑椹果酒从色泽还是从滋味与香气上都有欠缺,酒香欠浓郁,酒体欠丰满。干桑椹酿制的果酒品质从各方面进行比较均为最差。所以,从桑椹果酒酿制过程中各种活性物质的变化情况与酿制过后桑椹果酒的感官评价综合比较,冻桑椹与新鲜桑椹酿制的果酒品质相差不大,但是冻桑椹易保藏,能够解决桑椹果酒酿制出现的季节性问题。
3 结论
通过发酵过程中理化指标比较,冻桑椹酿制的果酒所含的活性物质如黄酮类、多酚类、花色苷的含量与鲜桑椹中的含量差别不大,其酒精含量、总糖含量、色度色调、黄酮含量、多酚含量、花色苷含量分别为12. 9(%vol)、5. 4%、2. 157、0. 825、11. 816、178. 4、11. 851mg/L。和其他处理方式的原料相比,以冻桑椹酿为原料进行发酵,果酒中的酒精含量以及活性物质的含量能够较早的达到稳定状态,可缩短发酵周期。同时,将桑椹进行冷冻保藏,不但可以保证期果酒的品质,而且还可以延长桑椹原料供给时间,克服了桑椹果酒生产受季节的限制,为生产提高产量创造了条件。
[1]陈祖满. 桑椹果酒的酿造技术[J]. 中国酿造,2005,145(4):62 - 64.
[2]Yang XY,Park GS,Lee MH,etal. Tol - like receptor 4 -mediated immunoregulation by the aqueous extract of MoriFructus[J]. Phytotherapy research,2009,23(12):1713 - 1720.
[3]梁艳英,任玉巧. 桑椹果酒及饮品的研究进展[J]. 酿酒,2005,32(6):48 - 50.
[4]翁金月,金利思. 药食两用桑椹的研究与开发[J]. 中国药业,2013,22(2):88 - 90.
[5]Hassimotto NM,Genovese MI,Lajolo FM. Absorption and metabolism of cyanidin - 3 - glucoside and cyanidin - 3 - rutinoside extracted from wild mulberry(Morus nigra L. )in rats[J]. Nutrition Research,2008,28(3):198 - 207.
[6]Isabelle M,Lee BL,Ong CN,etal. Peroxyl radical scavenging capacity,polyphenolics,and lipophilic antioxidant profiles of mulberry fruits cultivated in southern China[J]. Journal Agricultural and Food Chemistry,2008,56(20):9410 - 9416.
[7]Huang HP,Shih YW,Chang YC,etal. Chemoinhibitory effect of mulberry anthocyanins on melanoma metastasis involved in the Ras/P13K pathway[J]. Journal Agricultural and Food Chemistry,2008,56(19):9286 - 9293.
[8]Fazaeli M,Hojjatpanah G,Emam - Djomeh Z. Effects of heating method and conditions on the evaporation rate and quality attributes of black mulberry(Morus nigra)juice concentrate[J]. Journal of Food Science and Technology,2013,50(1):35 - 43.
[9]唐虎利,谢亚玲. 桑葚酒的加工技术研究[J]. 酿酒科技,2004(1):61 - 62.
[10]梁建芬,韩北忠,欧南骏. 桑椹酒发酵工艺的研究[J]. 中国酿造,2003(4):29 - 30.
[11]GB/T 15038 - 2006,中华人民共和国国家标准[S].
[12]庄惠婷,杜金华,郭春宝,等. 发酵石榴酒的色泽变化[J].食品与发酵工业,2011,37(3):113 - 117.
[13]郝倩,段力歆,马挺军,等. 超声辅助提取文冠果叶总黄酮的工艺研究[J]. 食品工业科技,2013,34(16):295 - 300.
[14]Shwartz E,Glazer I,Bar - Ya’akov I,etal. Changes in chemical constituents during the maturation and ripening of two commercially important pomegranate accessions. [J]. Food Chem 2009,115(3):965 - 973.
[15]唐琳,李子江,赵磊,等. 两种pH法测定玫瑰花花色苷含量的比较[J]. 食品科学,2009,30(18):310 - 313.
[16]蒋立文,李娟,呙亚波,等. 桑椹果酒发酵工艺条件的研究[J]. 食品科技,2008(2):24 - 28.
