乳癌组织肝癌缺失基因-3的表达及其临床意义
2014-03-22,
,
(威海市立医院甲状腺乳腺外科,山东 威海 264200)
乳癌是女性最常见的恶性肿瘤之一,其发病率占全身恶性肿瘤的7%~10%[1]。肝癌缺失基因-3(DLC-3)是新近发现的与肿瘤密切相关的基因,它通过提高内源性GTP酶的活性,参与细胞的增殖、生长和迁移过程[2-3]。DLC-3基因在乳癌组织中的表达情况目前尚未见文献报道。本研究通过检测DLC-3在乳癌组织中的表达水平,分析其与肿瘤临床病理特征的关系,以初步了解DLC-3在乳癌发生发展中的作用。
1 材料与方法
1.1 标本来源
2012年12月—2013年10月,收集在我科经手术治疗切除的原发性乳癌标本62例、癌旁组织(距肿瘤边缘大于5 cm)23例、乳房腺病组织20例。62例乳癌病人均为女性,年龄28~72岁。组织学类型:浸润性导管癌51例,浸润性小叶癌11例。组织学分级:Ⅰ级16例,Ⅱ级25例,Ⅲ级21例。依据美国癌症联合委员会(AJCC)乳癌TNM分期(第7版)标准进行分期,其中Ⅰ、Ⅱ期34例,Ⅲ、Ⅳ期28 例。有腋窝淋巴结转移者30例,无腋窝淋巴结转移者32例。所有病人术前均未接受放、化疗。
1.2 免疫组化检测
所有组织标本均常规固定包埋,4 μm厚切片,经脱蜡、水化后,DLC-3标记采用免疫组化SP法染色,EDTA高压锅热修复;其余标记采用免疫组化Envision二步法染色,PBS高压锅热修复。DAB显色,苏木精复染。用PBS代替一抗作为阴性对照,用已知阳性标本切片作为阳性对照。鼠抗人单克隆抗体DLC-3(1∶150)购自美国Abcam公司。
1.3 结果判断标准
DLC-3阳性染色为棕黄色颗粒定位于细胞核和细胞质。由两位病理学专家双盲法观察切片,采用半定量方法判断结果,≤4分为阴性(-),>4分为阳性(+)[4]。
1.4 统计学方法
应用SPSS 17.0软件包进行统计处理,率的比较采用χ2检验,以P<0.05为差异有显著性。
2 结 果
2.1 DLC-3在乳癌组织、癌旁组织和乳房腺病组织中的表达
DLC-3主要表达于细胞核中,部分表达于细胞质,以黄色、棕黄色着色为主。乳癌组织、癌旁组织及乳房腺病组织中DLC-3蛋白阳性表达率分别为17.74%(11/62)、43.48%(10/23)、60.00%(12/20),DLC-3蛋白在乳癌组织中的阳性表达率明显低于其在癌旁组织和乳房腺病组织中的阳性表达率,差异具有统计学意义(χ2=18.356,P<0.01)。
2.2 乳癌组织DLC-3蛋白表达与临床病理特征的关系
乳癌组织DLC-3蛋白表达与淋巴结转移、TNM分期、人表皮生长因子受体2(Her-2)表达有关(χ2=3.930~5.984,P<0.05),而与病人年龄、病理类型、肿瘤大小、组织学分级、雌激素受体(ER)表达无关(P>0.05)。见表1。
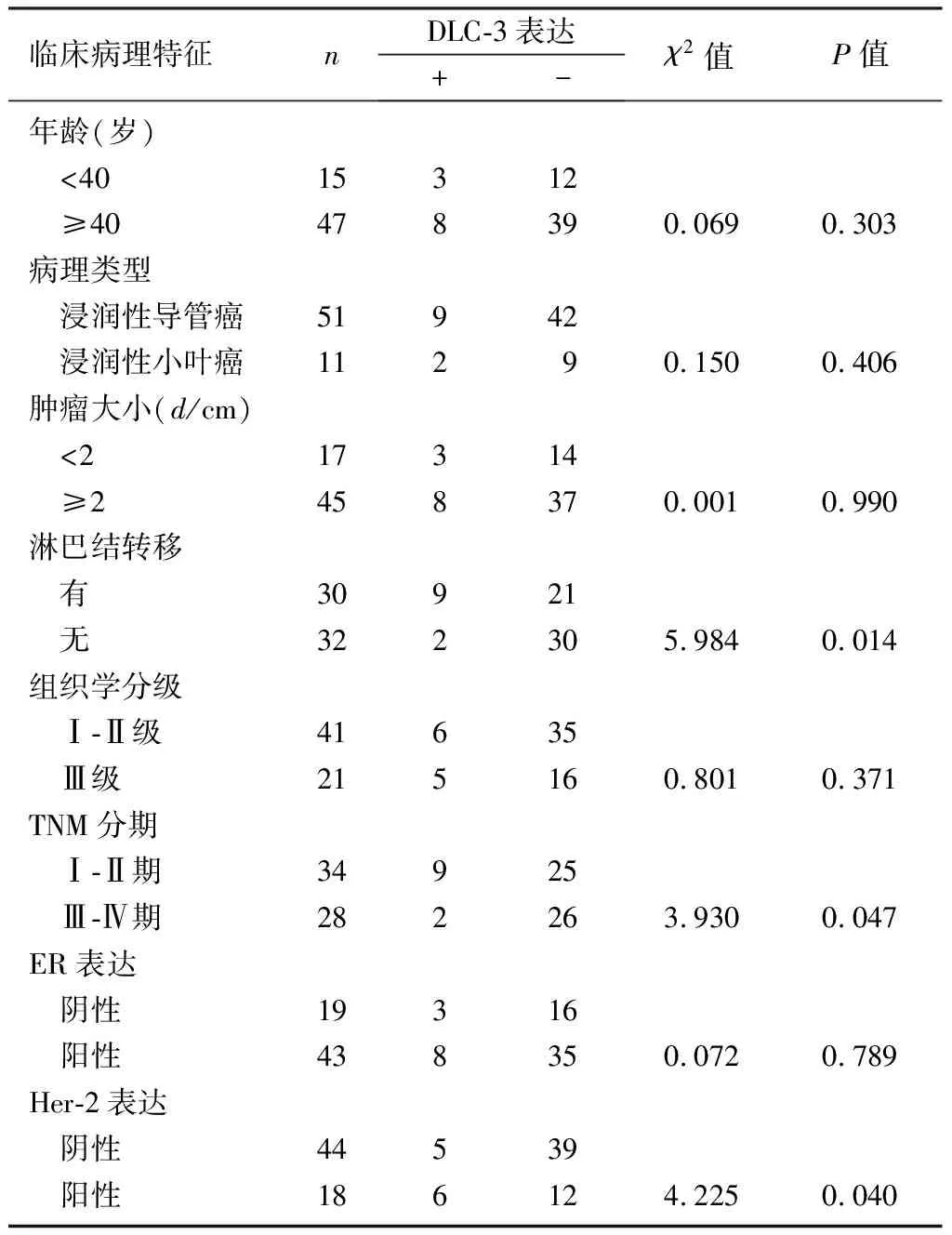
表1 乳癌组织DLC-3表达与临床病理特征的相关性(例)
3 讨 论
业已证实,肿瘤发生发展是多步骤、多因素参与过程,其中抑癌基因功能丧失是癌变事件的中心环节[5-6]。DLC-3是新近发现与肿瘤密切相关的潜在抑癌基因,位于人染色体13Xq13(STARD-GAP3)区域,全长3 800 bp,由14个外显子组成,以产生约长6 300 bp的转录物为主。研究显示,DLC-3依靠张力蛋白的辅助,募集到黏着斑,并通过RhoGAP抑制RhoGTP酶的活性,从而影响肌动蛋白应力纤维的构建和黏着斑转换,对细胞形态、细胞增殖和迁移进行调控[2,7]。DLC-3基因失活可引起RhoGTP酶活性增加,过度表达的RhoGTP酶导致细胞功能异常,促进细胞恶性转化[8]。体外实验结果证实,转染DLC-3表达载体的人前列腺癌细胞在细胞增殖、克隆形成和增长方面受到明显抑制,表明DLC-3可能对前列腺癌生长具有抑制作用[2]。
DURKIN等[9]利用微阵列技术比较分析癌组织与正常组织DLC-3表达情况,结果显示,DLC-3 mRNA在肾癌、肺癌、卵巢癌组织中表达下调。定量逆转录聚合酶链反应检测结果显示,前列腺癌组织中DLC-3的表达明显低于正常前列腺组织[10]。但DLC-3在乳癌组织中表达的研究尚未见报道。本研究应用免疫组化方法对62例乳癌进行检测,DLC-3蛋白阳性表达率为17.74%,显著低于癌旁组织和乳房腺病组织。说明DLC-3基因在正常乳房组织和乳房良性增生性组织中普遍表达,而在乳癌组织中其表达明显下调或表达缺失。进一步对DLC-3基因表达与临床病理特征的关系进行分析,结果显示,DLC-3蛋白表达与淋巴结转移、TNM分期、Her-2表达均有明显相关性,而与病人年龄、肿瘤大小、病理类型、组织学分级及ER表达无关。病理分期越晚,DLC-3表达下调越明显;伴有淋巴结转移的病人DLC-3表达缺失的发生概率明显低于不伴有淋巴结转移的病人;Her-2表达与DLC-3表达缺失亦存在显著相关性。众所周知,病理分期、淋巴结转移、Her-2表达是影响乳癌预后的重要因素,而本研究中DLC-3的表达恰好与这三者有密切关系,提示DLC-3基因在乳癌的发生发展中发挥作用。DLC-3基因在乳癌中表达降低或不表达可能是由于表观遗传学机制引起,如启动子DNA甲基化和组蛋白乙酰化,利用逆转甲基化药物或分子干预手段可对其具体下调机制进行更进一步研究[2]。
综上所述,DLC-3在乳癌中低表达或表达缺失,且其表达与淋巴结转移、TNM分期、Her-2表达存在相关性,提示DLC-3可能参与了乳癌的发生发展。本研究仅就DLC-3在乳癌组织中的表达做初步探讨,其表达缺失的原因及其在乳癌中的具体作用机制尚需进一步研究。
[参考文献]
[1] MCKENZIE F, ELLISON-LOSCHMANN L, JEFFREYS M. Investigating reasons for ethnic inequalities in breast cancer survival in New Zealand[J]. Cancer Epidemiol, 2011,16(6):535-549.
[2] LUKASIK D, WILCZEK E, WASIUTYNSKI A, et al. Deleted in liver cancer protein family in human malignancies (Review)[J]. Oncol Lett, 2011,2(5):763-768.
[3] KIM T Y, VIGIL D, DER C J, et al. Role of DLC-1, a tumor suppressor protein with RhoGAP activity, in regulation of the cytoskeleton and cell motility[J]. Cancer Metastasis Rev, 2009,28(1/2):77-83.
[4] CHAMBERS A F, MATRISIAN L M. Changing views of the role of matrix metalloproteinases in metastasis[J]. J Natl Cancer Inst, 1997,89(17):1260-1270.
[5] MCKIE A B, VAUGHAN S, ZANINI E, et al. The OPCML tumor suppressor functions as a cell surface repressor-adaptor, negatively regulating receptor tyrosine kinases in epithelial ovarian cancer[J]. Cancer Discov, 2012,2(2):156-171.
[6] 于啸,张婷,杨晨曦,等. 5-Aza-dc对宫颈癌细胞系FAM9C基因表达及甲基化影响[J]. 齐鲁医学杂志, 2013,27(4):292-295.
[7] KAWAI K, KIYOTA M, SEIKE J, et al. START-GAP3/DLC3 is a GAP for RhoA and Cdc42 and is localized in focal adhesions regulating cell morphology[J]. Biochem Biophys Res Commun, 2007,364(4):783-789.
[8] OHTA T, TAKAHASHI T, SHIBUYA T, et al. Inhibition of the Rho/ROCK pathway enhances the efficacy of cisplatin through the blockage of hypoxia-inducible factor-1α in human ovarian cancer cells[J]. Cancer Biol Ther, 2012,13(1):25-33.
[9] DURKIN M E, ULLMANNOVA V, GUAN M, et al. Deleted in liver cancer 3 (DLC-3), a novel Rho GTPase-activating protein, is downregulated in cancer and inhibits tumor cell growth[J]. Oncogene, 2007,26(31):4580-4589.
[10] QIAN X, LI G, ASMUSSEN H K, et al. Oncogenic inhibition by a deleted in liver cancer gene requires cooperation between tensin binding and Rho-specific GTPase-activating protein activities[J]. Proc Natl Acad Sci U S A, 2007,104(21):9012-9017.
