纳米金比色法在酶活力测定中的应用进展
2014-03-21赵灵芝张小清苗延青邓文婷
赵灵芝,张小清,苗延青,邓文婷,胡 颢
(西安医学院药学院,陕西西安710021)
酶是与人体所有生命活动相关的系列生化反应的高效催化剂。酶活力受多种因素的调控,与有害毒素、酶激活剂或酶抑制剂的筛选以及相关的病理学研究密切相关,因此酶可应用于靶向性治疗方法的开发[1-2]。目前常用的酶活力测定方法主要有分光光度法、荧光法、同位素法等,存在检测灵敏度低、易产生非特异性干扰等问题。近年来,纳米金因具有局域表面等离子共振效应的光学特征和良好的生物相容性,已被广泛应用于生理活性物质的分析中,包括DNA、氨基酸、蛋白质、金属离子等[3-6]。Mirkin等[7]基于纳米金溶液在聚集和解聚集过程中的颜色变化,以纳米金为探针,开拓性地完成了肉眼可视化分析寡聚核苷酸的可视化检测方法。研究者基于纳米金所呈现的颜色与其粒子尺寸或其聚集状态之间的依赖关系发展了多种以纳米金为探针的比色测定法,其中纳米金比色法在酶活力测定中的应用进展较快[8-25]。
作者在此综述了纳米金比色法的应用原理及其在酶活力测定、酶抑制剂筛选等方面的研究进展,并对今后的研究趋势进行了展望。
1 纳米金比色法的应用原理
纳米金颗粒呈现的颜色与金颗粒的尺寸、间距、表面电荷和介质盐浓度密切相关。基于酶催化底物发生生化反应前后所引起纳米金聚集状态的变化,纳米金比色法用于酶活力测定的原理大致有两种[8]:一是通过酶的加入或酶催化反应引入连接剂,使纳米金从分散状态转变为聚集状态(图1a);二是改变纳米金表面电荷或酶切纳米金表面的连接剂,使纳米金从聚集状态转变为分散状态(图1b)。
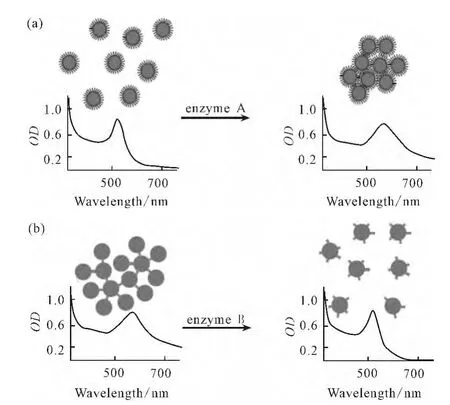
图1 纳米金比色法酶活力检测原理示意图[8]Fig.1 Principles of gold nanoparticles in colorimetric detection of enzyme activity[8]
按引起纳米金聚集方式的不同,比色法测定酶活力可分为交联作用引起的聚集变化和非交联作用引起的聚集变化。用于比色法检测的裸纳米金,一般是表面修饰柠檬酸的纳米金颗粒,在一定的盐浓度下,溶液中异种电荷的离子中和纳米金颗粒表面的电荷,使相邻纳米金颗粒的间距缩小,发生不可逆聚集,进而促使纳米金的颜色由酒红色向蓝紫色转变。如对纳米金表面进行功能化修饰,可改变其表面电荷,从而改变纳米金在特定盐溶液中的聚集状态,这是基于非交联作用(non-crosslinking aggregation)的盐效应的纳米金比色法。而在纳米金表面修饰特异性识别分子[如:生物素(biotin)],当靶物质亲和素(avidin)加入时即可识别,从而促使纳米金聚集,这是基于交联作用(crosslinking aggregation)的纳米金比色法。
2 纳米金比色法在酶活力测定中的应用
2.1 基于交联作用的纳米金比色法
基于交联作用的纳米金比色法一般使用功能化的纳米金作探针,将分子识别元件连接在纳米金表面,通过酶的加入或酶催化反应引入连接剂,从而使纳米金从分散状态转变为聚集状态。
Wang等[9]发展了cAMP依赖型蛋白激酶A(the cAMP-dependent protein kinase A,PKA)和钙调素依赖型蛋白激酶Ⅱ(the calmodulin-dependent kinaseⅡ,CaM KⅡ)2种酶活力测定和3种抑制剂筛选的方法,检测原理(图2)是基于酶催化底物磷酸化,将生物素嫁接到纳米金表面,以表面修饰生物素的纳米金作为探针1、修饰亲和素的纳米金作为探针2,通过生物素与亲和素的特异性识别,纳米金粒子发生交联聚集而呈现蓝色。当酶抑制剂存在时,生物素就不能嫁接至纳米金表面从而造成交联作用无法发生,纳米金最终呈现分散状态。

图2 cAMP依赖型蛋白激酶A和钙调素依赖型蛋白激酶Ⅱ的酶活力测定和抑制剂筛选原理示意图[9]Fig.2 Schematic representation of phosphorylation/biotinylation of substrate nanoparticles followed by addition of avidin-gold nanoparticles in the presence and absence of a kinase inhibitor[9]
通过酶将识别分子修饰至纳米金表面,进一步通过特异性抗原与抗体识别促使纳米金交联的方法也见于组蛋白甲基转移酶和组蛋白乙酰转移酶活力测定和相关抑制剂筛选中[12]。这些研究基于酶抑制剂破坏交联作用使纳米金聚集状态改变来反映酶抑制剂抑制能力强弱,并且仅靠肉眼观察即可进行判断,有望发展并应用于可视化高通量药物筛选研究中。
此外,还有基于DNA互补链识别、抗原抗体识别、肽链交联的纳米金探针。当某种酶加入后,其选择性切断连接链活性位点,从而使聚集的纳米金颗粒重新分散呈现酒红色。
Guarise等[10]基于交联作用发展了蛋白酶(protease)活力检测方法:首先设计交联剂多肽链的结构,以含有硫醇基的半胱氨酸为多肽链的头尾,将其作为蛋白酶的多肽底物,在无酶状态下,多肽链头尾的双巯基可将分散态的纳米金连接起来,使纳米金发生交联作用而聚集;当蛋白酶存在时,由于它对多肽链选择性切割,造成多肽链仅存1个巯基,交联作用被破坏,导致纳米金呈现分散的状态。此方法是基于蛋白酶催化肽水解前后交联作用被破坏导致纳米金聚集状态的改变来实现的。Xu等[11]基于相似的原理发展了DNA内切酶活力检测和酶抑制剂筛选方法。
基于交联作用的比色法用于其它酶活力测定和相关抑制剂的筛选也被多次报道[12-15],但有一些局限性:其一,受交联剂结构的限制,需要其头尾两端均具有可与纳米金表面结合的官能团(如巯基),为了得到这种特殊结构的官能团需要经过繁琐的分子设计、修饰和合成过程,使方法变得复杂;其二,在功能化纳米金探针准备过程中,需要将多余的配体分子与纳米金探针进一步分离;其三,交联过程是缓慢的动态过程,这使原本快捷的比色法失去优势。
2.2 基于非交联作用的纳米金比色法
为了克服交联作用的局限,研究者发展了多种基于非交联作用的纳米金比色法,如通过交联剂调节颗粒间距而改变纳米金颜色,或通过设计纳米金表面电荷来调节纳米金的聚集状态。在酶加入前,对纳米金颗粒表面进行分子设计使其带有一定电荷而呈现某种聚集状态;当加入酶后,酶催化反应改变纳米金表面电荷,使纳米金聚集状态发生改变而变色。Choi等[16]通过设计纳米金表面的电荷(图3),发展了可视化检测碱性磷酸酯酶活力和酶抑制剂筛选的方法:首先设计酶的底物结构,以半胱氨酸、酪氨酸、天冬氨酸三肽为底物。这样设计的目的在于:利用半胱氨酸上的巯基可将三肽修饰于纳米金表面上,天冬氨酸上的胍基与纳米金之间的静电作用以及电子给体与受体的作用可将分散的纳米金交联在一起而发生聚集,酪氨酸上的磷酸基所带的负电荷可阻碍相邻带正电荷的胍基与纳米金结合而破坏胍基诱导的纳米金聚集。当碱性磷酸酯酶加入到体系中时,由于酶催化作用使磷酸根离子脱离多肽链从而使磷酸基的阻碍作用消失,导致纳米金聚集。此研究通过设计底物结构和纳米金表面电荷来达到酶活力检测和抑制剂筛选的目的,为酶活力检测研究提供了新的思路。
基于设计纳米金表面电荷的比色法也被应用于糖苷酶、腺苷、高半胱氨酸水解酶、蛋白激酶、透明质酸酶、端粒酶等活性的测定[17-21]。
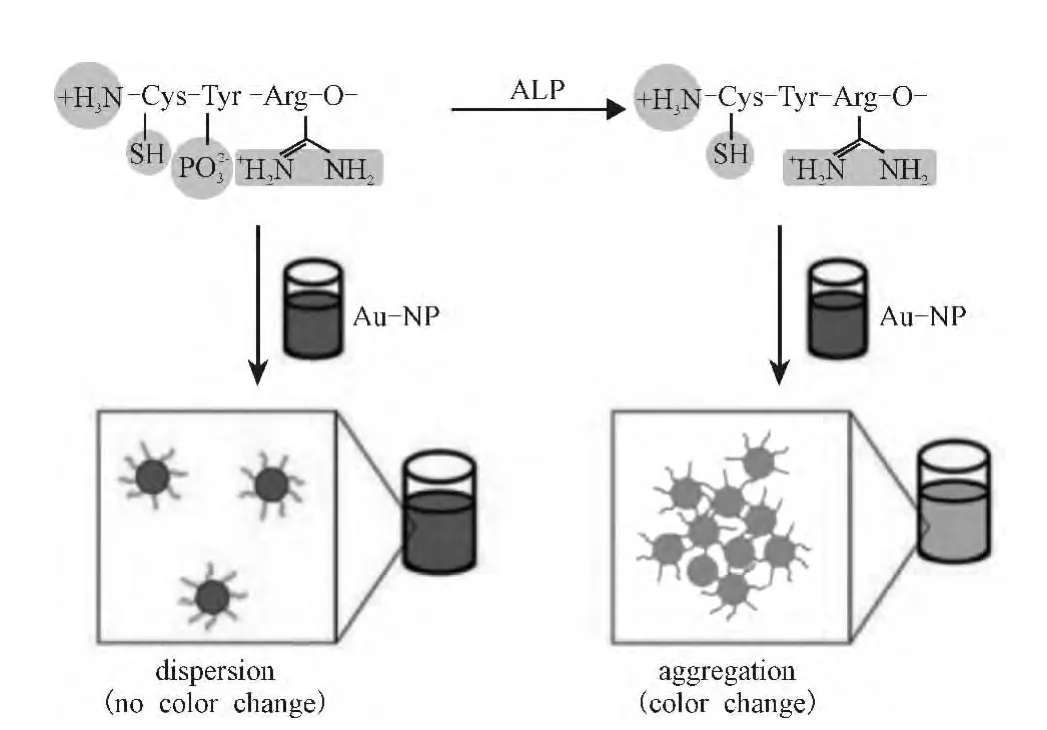
图3 基于设计纳米金表面电荷的碱性磷酸酯酶活力检测原理示意图[16]Fig.3 Alkaline phosphatase(ALP)assay based on color change during peptide-induced Au-NP aggregation[16]
2.3 以裸纳米金为探针的比色法
不论纳米金比色法基于交联作用还是基于设计纳米金表面电荷,以金硫键(Au-S)将抗原、DNA、多肽等小分子连接在纳米金表面,均需要对纳米金表面进行设计和修饰。近年来,以裸纳米金为探针的比色法被多次报道[22-25]。其原理也是基于纳米金所呈现的颜色与其粒子尺寸或其聚集状态之间的依赖关系。与交联作用不同的是,此法利用直接化学还原得到不需要进一步功能化的纳米金胶体作为检测探针。
Zhao等[22]发展了一种以裸纳米金为探针分子的可视化检测牛肠碱性磷酸酶活性的方法。其检测原理是:酶的底物ATP、ADP、AMP、腺苷等均可通过碱基上的氨基与纳米金发生电子给体与受体作用而快速连接在纳米金表面置换其表面原有的柠檬酸分子,ATP、ADP、AMP的磷酸骨架均带有负电荷,可增强纳米金的抗盐能力,但是由于所保护的纳米金表面所带电荷不同,使得它们在一定浓度的盐溶液中具有不同的稳定性,在酶催化ATP转化为腺苷过程中纳米金表面电荷发生变化,从而改变纳米金的聚集状态,达到酶活力检测的目的。
Shen等[23]基于相似的原理发展了可视化检测核酸酶活性的方法。该法也是以裸纳米金为探针分子,是根据不同链长的单链DNA保护的纳米金表面所带负电荷不同,使纳米金探针在一定浓度盐溶液中具有不同聚集状态而发展起来的。
通过选择纳米金表面的保护剂、设计纳米金表面电荷,可以发展更多可视化检测方法用于检测可引起纳米金表面电荷和抗盐能力变化的靶物质。但以裸纳米金为探针发展的比色法也存在一些局限性,如:裸纳米金颗粒对所存在的介质非常敏感,当待测生物样品成分复杂、盐浓度较高或含有大分子(如蛋白质)时,可使裸纳米金发生聚沉。针对这些问题,研究者将芯片技术与基于裸纳米金的比色法结合起来用于生物样品的现场分析。一方面,一体化的分析芯片可提供生物样品的前处理来减少复杂成分对裸纳米金探针比色法的干扰;另一方面,芯片具有高通量优势,可用于对酶抑制剂和分子库大批量、快速的筛选。
3 展望
酶活力测定与体内生理活动、病理学以及开发靶向性治疗方法研究密切相关。纳米金颗粒表面等离子共振效应所产生的特征光吸收、表面易于修饰、易合成等特征,使其作为极好的分析平台被应用于酶活力测定和酶抑制剂分子筛选研究工作中。近年来,研究者利用不同的分子识别配体构建了多种纳米金探针,纳米金比色法因具有高灵敏度和选择性已成为酶活力测定的主要手段。但是,此法仍需要进一步改进,如通过辅助其它技术手段(如荧光技术、拉曼散射技术等)来提高方法的稳定性、准确性、重现性和选择性,并结合微流控芯片技术使其发展为高通量、一体化的分析平台等。另一方面,已有报道均是基于球形纳米金粒子发展的分析方法,其它形状独特的三角形或六边形金颗粒、纳米棒等的光学性能仍未得到开发利用,不同尺寸、不同形状的纳米金颗粒所具有的多光子发光、等离子共振能量转移以及催化等优异性能有待于进一步开发,并应用于酶活力测定和生物医学分析和诊断中。
[1] DING Z,WU C J,JASKELIOFF M,et al.Telomerase reactivation following telomere dysfunction yields murine prostate tumors with bone metastases[J].Cell,2012,148(5):896-907.
[2] NOBLE M E M,ENDICOTT J A,JOHNSON L N.Protein kinase inhibitors:Insights into drug design from structure[J].Science,2004,303(5665):1800-1805.
[3] LIU D B,WANG Z,JIANG X Y.Gold nanoparticles for the color-imetric and fluorescent detection of ions and small organic molecules[J].Nanoscale,2011,3(4):1421-1433.
[4] LI Y,WU P,XU H,et al.Anti-aggregation of gold nanoparticlebased colorimetric sensor for glutathione with excellent selectivity and sensitivity[J].Analyst,2011,136(1):196-200.
[5] KIM S Y,PARK J W,KIM D,et al.Bioinspired colorimetric detection of calcium(Ⅱ)ions in serum using calsequestrin-functionalized gold nanoparticles[J].Angew Chem Int Ed,2009,48(23):4138-4141.
[6] LI T,DONG S J,WANG E.Enhanced catalytic DNAzyme for label-free colorimetric detection of DNA[J].Chem Commun,2007,(41):4209-4211.
[7] MIRKIN C A,LETSINGER R L,MUCIC R C,et al.A DNA-based method for rationally assembling nanoparticles into macroscopic materials[J].Nature,1996,382(6592):607-609.
[8] HUTTER E,MAYSINGER D.Gold-nanoparticle-based biosensors for detection of enzyme activity[J].Trends in Pharmacological Sciences,2013,34(9):497-507.
[9] WANG Z X,LEVY R,FERNING D G,et al.Kinase-catalyzed modification of gold nanoparticles:A new approach to colorimetric kinase activity screening[J].J Am Chem Soc,2006,128(7):2214-2215.
[10] GUARISE C,PASQUATO L,FILIPPIS V D,et al.Gold nanoparticles-based protease assay[J].PNAS,2006,103(11):3979-3982.
[11] XU X Y,HAN M S,MIRKIN C A.A gold-nanoparticle-based real-time colorimetric screening method for endonuclease activity and inhibition[J].Angew Chem Int Ed,2007,46(19):3468-3470.
[12] ZHEN Z,TANG L J,LONG H X,et al.Enzymatic immuno-assembly of gold nanoparticles for visualized activity screening of histone-modifying enzymes[J].Anal Chem,2012,84(8):3614-3620.
[13] WU Z,WU Z K,TANG H,et al.Activity-based DNA-gold nanoparticle probe as colorimetric biosensor for DNA methyltransferase/glycosylase assay[J].Anal Chem,2013,85(9):4376-4383.
[14] YU C C,HUANG L D,KWAN D H,et al.A glyco-gold nanoparticle based assay forα-2,8-polysialyltransferase from Neisseria meningitides[J].Chem Commun,2013,49(86):10166-10168.
[15] LE D V,NGUYEN V T,TANG L J,et al.Proteolysis-mediated protection of gold nanoparticles for sensitive activity assay of peptidases[J].Talanta,2013,107:233-238.
[16] CHOI Y,HO N H,TUNG C H.Sensing phosphatase activity by using gold nanoparticles[J].Angew Chem Int Ed,2007,46(5):707-709.
[17] ZENG Z H,MIZUKAMI S,KIKUCHI K.Simple and real-time colorimetric assay for glycosidases activity using functionalized gold nanoparticles and its application for inhibitor screening[J].Anal Chem,2012,84(21):9089-9095.
[18] LIN J H,CHANG C W,WU Z H,et al.Colorimetric assay for S-adenosylhomocysteine hydrolase activity and inhibition using fluorosurfactant-capped gold nanoparticles[J].Anal Chem,2010,82(21):8775-8779.
[19] ZHOU J,XU X H,LIU X,et al.A gold nanoparticles colorimetric assay for label-free detection of protein kinase activity based on phosphorylation protection against exopeptidase cleavage[J].Biosensors and Bioelectronics,2014,53:295-300.
[20] SHEN M Y,CHAO C F,WU Y J,et al.A design for fast and effective screening of hyaluronidase inhibitor using gold nanoparticles[J].Sensors and Actuators B,2013,181:605-610.
[21] WANG J S,WU L,REN J S,et al.Visualizing human telomerase activity with primer-modified Au nanoparticles[J].Small,2012,8(2):259-264.
[22] ZHAO W,CHIUMAN W,LAM J C F,et al.Simple and rapid colorimetric enzyme sensing assays using non-crosslinking gold nanoparticle aggregation[J].Chem Commun,2007,(36):3729-3731.
[23] SHEN Q P,NIE Z,GUO M L,et al.Simple and rapid colorimetric sensing of enzymatic cleavage and oxidative damage of singlestranded DNA with unmodified gold nanoparticles as indicator[J].Chem Commun,2009,(8):929-931.
[24] ZHANG L L,ZHAO J J,JIANG J H,et al.Enzyme-regulated unmodified gold nanoparticle aggregation:A label free colorimetric assay for rapid and sensitive detection of adenosine deaminase activity and inhibition[J].Chem Commun,2012,48(89):10996-10998.
[25] REN S,LI B X,ZHANG L.Visual detection of hexokinase activity and inhibition with positively charged gold nanoparticles as colorimetric probes[J].Analyst,2013,138(11):3142-3145.
