翘嘴红鲌(♀)×黑尾近红鲌(♂)杂种F1的AFLP分析
2014-03-17见李清王贵英李佩刘英武
陈 见李 清王贵英李 佩刘英武
(1. 武汉市水产科学研究所, 武汉 430207; 2. 武汉先锋水产科技有限公司, 武汉 430207)
翘嘴红鲌(♀)×黑尾近红鲌(♂)杂种F1的AFLP分析
陈 见1,2李 清1,2王贵英1,2李 佩1,2刘英武1,2
(1. 武汉市水产科学研究所, 武汉 430207; 2. 武汉先锋水产科技有限公司, 武汉 430207)
采用AFLP 分子标记技术对翘嘴红 鲌(♀)、 黑尾近红 鲌(♂)及杂种F1三个群体各12个个体进行遗传差异分析。结果表明: 9对引物共扩增出257条带, 多态性比例为51.36%; 三个群体间特异条带共24条, 其中黑尾近红 鲌群体和杂种F1群体共有特异带15 条、翘嘴红 鲌群体和杂种F1群体共有特异带2 条、翘嘴红鲌群体特异带7条; 黑尾近红 鲌 群体、翘嘴红 鲌群体及杂种F1群体的Shannon’s信息指数分别为0.2326、0.0794和0.1774, Nei’s基因多样性指数分别为0.1602、0.0537和0.1229, 期望杂合度分别为0.1582、0.0464和0.1062;杂种F1群体和黑尾近红 鲌 群体及翘嘴红 鲌群体遗传距离分别为0.0523、0.2165, 遗传相似系数分别为0.9490、0.8053, 遗传数据表明杂种F1更接近于父本黑尾近红 鲌。
翘嘴红鲌; 黑尾近红 鲌; 杂种F1; AFLP; 遗传差异
翘嘴红 鲌Erythroculter ilishaeformis (Bleeker)隶属鲤形目、鲤科、 鲌亚科、 鲌属, 在我国江河与湖泊皆盛产; 其自然个体大、肉质细嫩、经济价值高, 但人工养殖成本高、且性情急躁、不易捕捞、不耐活鱼运输。黑尾近红 鲌(Ancherythroculter nigrocauda Yih et Wu )隶 属鲤形目、鲤科、 鲌亚科、近红 鲌属, 是长江上游特有经济鱼类; 其人工养殖成本低、性情温驯、易捕捞、易活鱼上市, 但体型市场接受率不及翘嘴红 鲌。鉴于此, 本实验以丹江口水库翘嘴红 鲌为母本、黑尾近红 鲌为父本进行了两种鱼类的属间远缘杂交, 获得杂种 F1。通过对三种鱼的形态数据分析发现, 杂种F1在形态上接近于母本翘嘴红 鲌; 通过对比养殖发现, 杂种 F1的生长速度显著高于父母本, 饲料转化率显著高于母本翘嘴红 鲌。
AFLP技术由于多态性高、可重复性好、位点数多和操作简单等优点[1], 在(种内、种间)杂交个体的鉴定方面发挥了巨大的作用[2], 有时甚至比微卫星等共显性标记更具优势[3]。目前, AFLP在植物杂交分析中报道较多[4], 而在鱼类家系筛选和遗传育种工作中, 运用AFLP进行杂交分析也有少量报道。Liu等[5]利用AFLP技术分析了斑点叉尾和长鳍叉尾及其杂交后代, 表明AFLP标记符合孟德尔遗传规律, 重现性好, 并认为该技术可运用在叉尾的遗传分析、基因作图及辅助育种上。Congiu等[6]利用AFLP技术成功鉴定出鲟鱼的杂交后代。
本文采用AFLP 技术对翘嘴红 鲌(♀)×黑尾近红鲌(♂)杂种 F1进行分析, 期望通过该技术能够成功鉴定出杂种F1, 并对三种 鲌类进行遗传特性评价。
1 材料与方法
1.1 实验材料
翘嘴红 鲌群体引自于丹江口水库, 黑尾近红鲌群体引自于长江上游, 以上两群体经武汉先锋水产科技有限公司(先锋公司)多代选育, 目前均在先锋公司基地进行人工养殖。杂种 F1系上述两个群体杂交获得[翘 嘴红 鲌(♀)× 黑尾近红 鲌(♂)]。在先锋公司养殖基地取上述三个群体各 12尾, 分别剪尾鳍保存于无水乙醇中, 带回实验室置于 4℃冷库中备用。
1.2 实验方法
基因组DNA提取 采用Promega公司DNA提取试剂盒, 提取尾鳍中的DNA; 1%琼脂糖凝胶电泳检测DNA完整性, 分光光度计检测DNA纯度和浓度。若A260/280=1.8—2.0, 说明DNA纯度好, 则适合进行AFLP分析。
AFLP分析 基因组 DNA的限制性酶切和接头连接; 使用 MseⅠ和 EcoRⅠ限制性内切酶(NEB公司)各5 U, 在37℃水浴中, 同时对550 ng基因组DNA进行双酶切, 反应3h后70℃下对限制性内切酶灭活 15min。向酶切产物中分别加入 MseⅠ接头(50 μmol/L)和EcoRⅠ接头(5 μmol/L)各1 μL, T4 DNA连接酶(NEB公司) 0.2 μL, 13.8 μL单蒸水, 4.0 μL buffer, 16℃反应过夜, 接头具体序列见表1。

表1 AFLP接头及引物序列Tab. 1 Sequences of adaptors and primers in AFLP analysis
预扩增反应: 取上述连接产物1.5 μL作为预扩增的模板, 分别加入预扩增引物EcoRⅠ和预扩增引物MseⅠ各4.0 μL进行扩增, 预扩增引物具体序列见表1。PCR反应体系4.0 μL buffer, 2.4 μL 25 mmol/L MgCl2, 0.5 U Taq酶, 0.4 μL 10 mmol/L dNTP, 4 μL 10 μmol/L primer, 1.5 μL连接产物, 加水至40 μL。反应条件: 94℃ 30s, 56℃ 60s, 72℃ 60s, 循环数为25; 取5 μL扩增产物, 1%琼脂糖凝胶电泳进行检测。
选择性扩增: 将上述预扩增产物稀释20倍, 作为选择性扩增的模板。使用9对MseⅠ和EcoRⅠ选择性扩增引物进行选择性扩增, 预扩增引物具体序列见表1; 引物对分别为: E1-M3、E5-M13、E5-M14、E8-M10、E9-M1、E10-M3、E12-M7、E12-M8、E16-M4。PCR反应体系: 2.0 μL 10×buffer, 1.2 μL 25 mmol/L MgCl2, 1.0 U Taq, 0.4 μL 10 mmol/L dNTP, 2.0 μL 5 μmol/L primer, 5 μL预扩增产物, 加水至20 μL。反应条件: 94℃ 30s, 65℃(每循环降0.7℃) 30s, 72℃60s, 循环次数14; 94℃ 30s, 56℃ 30s, 72℃ 60s, 循环数为24。
聚丙烯酰胺凝胶电泳分离: 对选择性扩增产物采用 6%的聚丙烯酰胺凝胶电泳, 并进行银染显色,将凝胶自然风干后通过肉眼进行条带分析。
1.3 数据统计与分析
根据凝胶电泳结果, 选取清晰的多态条带用于统计分析, 有带的记为1, 无带的记为0, 建立01数据矩阵。用Popgene 1.32[7]软件计算Shannon’s信息指数、Nei’s基因多样性指数、期望杂合度、多态位点数、多态位点百分比、遗传距离和遗传相似系数。多态位点比例是以位点的百分数而不是以一个等位基因计算的。
用 Arlequin3.11[8]软件对群体结构在群体间和群体内作分子方差分析(AMOVA)。群体间的遗传距离根据Nei[9]非偏距离和相似测量, 用MEGA5.0[10]软件构建群体的UPGMA聚类图。
2 结果
2.1 AFLP扩增图谱及其多态性和特异性
9对引物组合对36个样本扩增共得到257条清晰可辨、可重复的条带, 其中多态位点132个, 多态位点比率为51.36%; 平均每对引物组合扩增出28.6条带, 每对引物扩增出的条带数范围为(22—43)条。三个群体间特异条带共24条, 其中黑尾近红 鲌群体和杂种F1群体共有特异带15 条、翘嘴红 鲌群体和杂种F1群体共有特异带2 条、翘嘴红 鲌群体特异带7条(图1)。
2.2 遗传多样性及其方差分析
从表2 可以看出黑尾近红 鲌群体的 Shannon’s信息指数、Nei’s基因多样性指数、期望杂合度、多态位点数、多态位点百分比最高, 杂种F1群体其次,翘嘴红 鲌群体最低, 表明黑尾近红 鲌群体的遗传多样性最高。
从表 3可以看出, 三个群体在遗传差异的总方差中, 54.51%的差异来自种群间, 45.49%的差异来自种群内; 表明种群间的差异比较大。
2.3 遗传距离及其遗传相似系数
由表4可见, 杂种F1和黑尾近红 鲌的遗传距离0.0523, 小于翘嘴红 鲌0.2165; 而杂种 F1和黑尾近红 鲌的遗传相似系数0.9490, 大于翘嘴红 鲌0.8053。
如图2所示, 据表4的遗传距离数据, 以UPGMA方法构建了三个种群的聚类分析图, 杂种F1群体首先和黑尾近红 鲌群体聚为一类, 然后和翘嘴红 鲌群体聚为一类。

图1 引物对E9-M1扩增结果Fig. 1 AFLP profile amplified by selective primer set E9-M1

表2 黑尾近红鲌、翘嘴红鲌及杂种F1三个群体遗传多样性Tab. 2 Genetic diversity of A. nigrocauda, E. ilishaeformis and their hybrid F1
3 讨论

表 3 黑尾近红鲌、翘嘴红鲌及杂种 F1三个群体遗传多样性方差分析Tab. 3 AMOVA results of A. nigrocauda, E. ilishaeformis and their hybrid F1
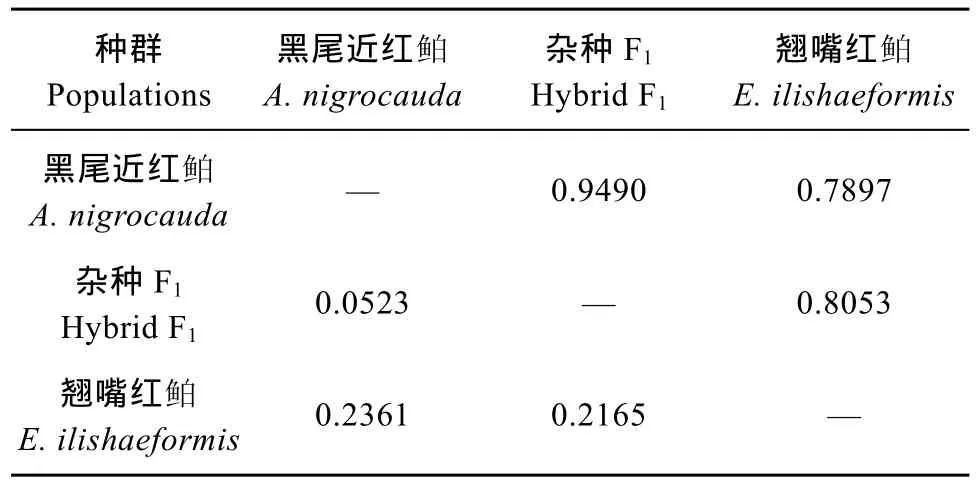
表4 三个群体遗传距离(左下)及遗传相似系数(右上)Tab. 4 Genetic distance (below diagonal) and similarity (above diagonal) of the three populations in this study

图2 据Nei遗传距离用UPGMA方法构建的三个种群的聚类分析图Fig. 2 UPMGA dendrogram of three populations in this study are based on Nei’s genetic distance
AFLP是一种 DNA指纹分析技术, 能够灵敏检测DNA的多态性, AFLP分析中的多态比例和遗传差异度是衡量群体遗传分化和亲缘关系的重要指标[11,12]。本研究采用AFLP 技术分析黑尾近红 鲌、翘嘴红 鲌及杂种F1三个群体的遗传多样性, 结果表明黑尾近红 鲌群体的Shannon’s信息指数、Nei’s基因多样性指数、期望杂合度、多态位点数、多态位点百分比最高, 杂种F1群体次之, 翘嘴红 鲌群体最低;杂种F1群体的遗传多样性处于黑尾近红 鲌群体和翘嘴红 鲌群体之间。于涛等[13]通过AFLP技术分析栉孔扇贝、虾夷扇贝及其杂交子代的遗传多样性, 表明杂交子代群体的遗传多样性水平比2个亲本群体都高; 董颖等[14]对中华绒毛蟹和日本绒毛蟹及其杂交子代的 AFLP分析研究表明, 杂交子代的遗传多性介于两个亲本之间, 杂交未使群体遗传多样性升高, 这与本研究结果相同。池喜峰等[15]用微卫星技术对荷包红鲤和德国镜鲤的正反杂交组遗传结构进行分析, 发现正交组子代遗传多样性低于父母本;分析认为可能是所选取的亲本经过连续多代的人工养殖, 在相同的养殖环境中群体亲缘关系较近, 而近亲繁殖导致这一现象的发生。在本研究中杂种F1遗传多样性介于2个亲本之间, 而父本黑尾近红鲌最高, 分析认为可能是: 母本翘嘴红 鲌来源于同一个水域并经连续多代人工选育, 黑尾近红 鲌虽经连续多代人工选育, 但来自于三个不同水域, 仍保持较高的遗传多样性。同时, AFLP标记属于显性标记,无法区分杂合基因型和显性纯合基因型, 利用显性标记估算的遗传值, 是在假定群体为遗传平衡群体下得出的, 而这种假定往往具有不可靠性[16]; 随机9对引物的筛选以及样本数量, 也往往对估算的遗传值造成一定的影响, 故本研究的结论需要更进一步的验证和探讨。
三个群体在遗传差异的总方差中, 54.51%的差异来自种群间, 45.49%的差异来自种群内; 表明三个群体之间有较大的遗传差异, 说明杂种F1同父母本之间差异较大, 在养殖实验中也表明杂种F1有着优于父母本的养殖性状。王伟伟等[17]利用AFLP技术研究 6个地理群体斑鳜的遗传多样性, 分子方差分析表明变异主要发生在群体间, 各地理群体斑鳜有极显著的遗传分化。
本次研究中杂种F1群体从遗传距离及遗传相似系数来看, 与父本黑尾近红 鲌群体更接近, 但是杂种F1群体的形态上却更接近于翘嘴红 鲌群体; 生长速度明显优于父母本群体, 饲料转化率明显优于母本翘嘴红 鲌群体、与父本黑尾近红 鲌群体基本一致。杂交后代遗传特性偏向于一方亲本是很常见的一种现象, 这可能是由于杂交不亲和、染色体丢失、雌核发育二倍体、雄核发育二倍体等原因造成。刘苏等[18]通过AFLP技术分析斑鳢、乌鳢及其杂种群体遗传特性, 顾志敏等[19]通过RAPD技术分析翘嘴红鲌(♀)与团头鲂(♂)的杂种 F1群体遗传特性, 发现杂种偏向于父本。徐冬冬[20]对褐牙鲆和夏牙鲆及其正反交子代 AFLP分析表明, 杂交子代和母本的关系较近。王晓清等[21]对大黄鱼和鱼杂交分析, 表明杂交子代与母本大黄鱼之间具有极高的遗传同质性,属异精雌核发育个体。
鱼类远缘杂交育种, 是改善鱼类性状的一种行之有效方法。本文研究的翘嘴红 鲌(♀)× 黑尾近红鲌(♂)杂种F1, 在形态上接近翘嘴红 鲌, 体型市场更易接受; 在生长速度、饲料转化率等经济性状上也体现出明显的杂种优势; 本研究尝试从分子方面阐述了杂种F1的杂种优势, 从理论与实践综合分析说明杂种F1是一个优良的养殖新品种。
[1] Vos P, Hogers R, Bleeker M, et al. AFLP: a new technique for DNA fingerprinting [J]. Nucleic Acids Research, 1995, 23(21): 4407—4414
[2] Miller L M. Classifying genealogical origins in hybrid populations using dominant markers [J]. Journal of Heredity, 2000, 91(1): 46—49
[3] Bensch S HA, Salomon M, Seibold I. Amplified fragment length polymorphism analysis identifies hybrid between two subspecies of warblers [J]. Molecular Ecology, 2002, 11: 473—481
[4] Chauhan N, Negi M S, Sabharwal V, et al. Screening interspecific hybrids of Populus (P-ciliata x maximowiczii) using AFLP markers [J]. Theoretical and Applied Genetics, 2004, 108(5): 951—957
[5] Liu Z, Nichols A, Li P, et al. Inheritance and usefulness of AFLP markers in channel catfish (Ictalurus punctatus) blue catfish (I-furcatus), and their F1, F2, and backcross hybrids [J]. Molecular and General Genetics, 1998, 258(3): 260—268
[6] Congiu L, Dupanloup I, Patarnello T, et al. Identification of interspecific hybrids by amplified fragment length polymorphism: the case of sturgeon [J]. Molecular Ecology, 2001, 10(9): 2355—2359
[7] Yeh F C, Boyle T J B. Population genetic analysis of codominant and dominant markers and quantitative traits [J]. Belgian Journal of Botany, 1997, 19: 129—157
[8] Excoffier L, Laval G, Schneider S. Arlequin (version 3.0): An integrated software package for population genetics data analysis [J]. Evolutionary bioinformatics, 2005, 1: 47—50
[9] Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals [J]. Genetics, 1978, 89(3): 583—590
[10] Tamura K, Nei M, Kumar S, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Molecular Biology and Evolution, 2011, 28(10): 2731—2739
[11] Peng M, Chen X L, Jiang W M, et al. The population genetic diversity of different geographical Pteria penguin revealed by fAFLP analysis [J]. Acta Hydrobiologica Sinica, 2012, 36(1): 102—108 [彭敏, 陈秀荔, 蒋伟明, 等. 企鹅珍珠贝不同地理群体遗传多样性的fAFLP 分析. 水生生物学报, 2012, 36(1): 102—108]
[12] Wang K Y, Mou Q F, Huang J L, et al. Amplified fragment length polymorphism analysis of Aeromonas veronii [J]. Acta Hydrobiologica Sinica, 2013, 37(5): 905—911 [汪开毓, 牟巧凤, 黄锦炉, 等. 38株维氏气单胞菌分离株的AFLP基因分型研究. 水生生物学报, 2013, 37(5): 905—911]
[13] Yu T, Yang A G, Zhou L Q, et al. Genetic variation of Chlamys farreri, Patiinopecten yessoensis and their hybrids [J]. Journal of Fishery Sciences of China, 2011, 18(3): 574—580 [于涛, 杨爱国, 周丽青, 等.栉孔扇贝、虾夷扇贝及其杂交子代的群体遗传多样性分析.中国水产科学, 2011, 18(3): 574—580]
[14] Dong Y, Zhou Z C, Song L, et al. AFLP analysis in populations of Chineses mitten crab (Eriocheir sinensis), Japanese mitten crab (E. japonica) and their hybrids [J]. Fisheries Science, 2008, 27(3): 135—138 [董颖, 周遵春,宋伦, 等.中华绒毛蟹、日本绒毛蟹及其杂交F1代群体的遗传多样性分析.水产科学, 2008, 27(3): 135—138]
[15] Chi X F, Jia Z Y, Li C T, et al. Analysis of genetic structure in obverse and inverse cross of purse red carp and greman mirror carp by microsatellite markers [J]. Journal of Dalian Ocean University, 2010, 25(5): 450—456 [池喜峰, 贾智英,李池陶, 等.荷包红鲤与德国镜鲤正反交杂交组遗传结构的微卫星分析.大连海洋大学学报, 2010, 25(5): 450—456]
[16] Yan G, Rmoero-Severson J, Walton M, et al. Population genetics of the yellow fever mosquito in Trinidad: comparisons of amplified fragment length polymorphism (AFLP) and restriction fragment length polymorphism (RFLP) markers [J]. Molecular Ecology, 1999, 8(6): 951—963
[17] Wang W W, Zhao J L, Li S F, et al. Genetic variation of Siniperca scherzeri Steindachener from different geographical populations by AFLP analysis [J]. Acta Hydrobiologica Sinica, 2009, 33(2): 304—309 [王伟伟, 赵金良, 李思发, 等.斑鳜不同地理群体遗传变异的 AFLP分析.水生生物学报, 2009, 33(2): 304—309]
[18] Liu S, Zhu X P, Chen K C, et al. Genetic variation of Channa maculata, Channa argus and their hybrid by AFLP analysis [J]. Genomics and Applied Biology, 2010, 29(4): 673—678 [刘苏, 朱新平, 陈昆慈, 等.斑鳢、乌鳢及其杂交种遗传差异的 AFLP分析.基因组学与应用生物学, 2010, 29(4): 673—678]
[19] Gu Z M, Jia Y Y, Ye J Y, et al. Studies on morphological characteristics and genetic analysis of the hybrid F1, Erythoculter ilishaeformis♀×Megalobrama amblycephala♂[J]. Journal of Fisheries of China, 2008, 32(4): 533—545 [顾志敏, 贾永义, 叶金云, 等.翘嘴红鲌 (♀)与团头鲂(♂)杂种 F1的形态特征及遗传分析.水产学报, 2008, 32(4): 533—545]
[20] Xu D D. Genetic characterization of hybridization betweenOlive Flounder and Summer Flounder [D]. Thesis for Doctor of Science. Institute of Oceanology, Chinese Academy of Sciences, Qingdao. 2009 [徐冬冬. 褐牙鲆和夏牙鲆杂交的遗传学研究. 博士论文, 中国科学院海洋研究所, 青岛. 2009]
[21] Wang X Q, Wang Z Y, Xie Z G, et al. Genntic analysis of the intergenus hybridization of Peseudosciaena crocea (♀)×Miichthys miiuy (♂) [J]. Journal of Fisheries of China, 2008, 32(1): 51—57 [王晓清, 王志勇, 谢中国, 等. 大黄鱼(♀)与(♂)杂交的遗传分析.水产学报, 2008, 32(1): 51—57]
ANALYSIS OF THE HYBRID F1BETWEEN ERYTHROCULTER ILISHAEFORMIS♀×ANCHERYTHERYTHROCULTER NIGROCAUDA♂ BY AFLP MARKER TECHNIQUE
CHEN Jian1,2, LI Qing1,2, WANG Gui-Ying1,2, LI Pei1,2and LIU Ying-Wu1,2
(1. Wuhan Aquaculture Science Research Institute, Wuhan 430207, China; 2. Wuhan Xianfeng Aquaculture Technology Co. Ltd, Wuhan 430207, China)
AFLP molecular marker technique was utilized to analyze the genetic differences among Erythroculterilishaeformis, Ancherythroculter nigrocauda and their hybrid F1(E. ilishaeformis♀×A. nigrocauda; 12 individuals each). A total of 257 bands were obtained by 9 primer combinations, and the percentage of polymorphic loci was 51.36%. There were 24 specific bands in the three populations. There were 15 shared specific bands between the A. nigrocauda and hybrid F1,and 2 were between the E. ilishaeformis and hybrid F1. There were 7 specific bands of E. ilishaeformis. The Shannon’s information indexes of A. nigrocauda, E. ilishaeformis and hybrid F1were 0.2326, 0.0794 and 0.1774, respectively. The Nei’s gene diversity indexes of the three populations were 0.1602, 0.0537 and 0.1229, respectively. The expected heterozygosity among the three populations was 0.1582, 0.0464 and 0.1062, respectively. The genetic distance was 0.0523 between the A. nigrocauda and hybrid F1and was 0.2165 between the E. ilishaeformis and hybrid F1. The genetic similarity coefficients between the A. nigrocauda and hybrid F1was 0.9490, and it was 0.8053 between the E. ilishaeformis and hybrid F1. These data showed that the hybrid F1was more homogeneous to the male parent of A. nigrocauda.
Erythroculter ilishaeformis; Ancherythroculter nigrocauda; The hybrid F1; AFLP; Genetic differences
Q346+.5
A
1000-3207(2014)05-0891-06
10.7541/2014.133
2013-07-22;
2014-02-23
国家科技支撑计划子课题(2012BAD25B06—07); 农业部“湖 北武汉 鲌鱼良种场”项目(文号: 农计函[2007]403号)资助
陈见(1983—), 男, 湖北洪湖人; 硕士; 研究方向为鱼类遗传育种。E-mail: chenjian.316@163.com
李清, E-mail: xfsckj@163.com
