人转录因子hASH4的表达纯化及其DNA结合活性
2014-03-17苏琢磊楼田甜王远东季朝能
苏琢磊 楼田甜 王远东 季朝能
(复旦大学生命科学学院 遗传学研究所,上海 200433)
人转录因子hASH4的表达纯化及其DNA结合活性
苏琢磊 楼田甜 王远东 季朝能
(复旦大学生命科学学院 遗传学研究所,上海 200433)
hASH4蛋白所属的HLH转录因子家族在调节基因表达,调控细胞周期,决定细胞分化中起了重要作用。有研究表明hASH4蛋白可能与皮肤的分化发育有着密切的关系,但具体机制不明。成功构建了pET28b-hASH4表达质粒,并在大肠杆菌BL21(DE3)中诱导表达。经过对温度、时间、IPTG浓度等表达条件的优化,确定在37℃下1 mmol/L IPTG诱导表达4 h可达到最佳表达效果,并通过亲和层析和弱阳离子交换层析纯化蛋白,得到了电泳纯的目的蛋白。通过非放射性凝胶滞留试验发现hASH4蛋白单体只具有非特异性的DNA结合活性,而不具有特异性的DNA结合活性,推进其在体内的转录因子功能可能需先形成异源二聚体或多聚体才能进一步特异性结合DNA进而作用于下游基因。研究结果为hASH4蛋白的功能和作用方式提供了线索,并为其进一步的结晶条件筛选、晶体结构解析和功能研究奠定基础。
螺旋-环-螺旋 碱性/螺旋-环-螺旋 hASH4 DNA结合 特异性结合 非特异性结合
螺旋-环-螺旋(Helix-Loop-Helix,HLH)转录因子家族是真核生物中非常重要的特异性转录因子家族,该家族广泛存在于从酵母到人类的所有真核生物中,其成员在调节基因表达,调控细胞周期,决定细胞分化中起了重要作用[1,2]。大多数的HLH蛋白属于碱性/螺旋-环-螺旋(basic/Helix-Loop-Helix,bHLH)家族成员,即有与HLH结构域相邻的一个特殊碱性区,该碱性区多数可以与下游靶基因DNA的特异性序列包括E框基序(CANNTG)或N框基序(CACNAG)结合从而发挥转录激活或抑制作用,HLH结构域则主要负责介导蛋白的同源或异源二聚化,有利于DNA结合和转录调节[3-5]。
hASH4(Human achaete-scute homolog 4)基因是Jonsson等[6]最新克隆得到的一段基因,其位于人染色体12q24.1位置,编码173个氨基酸,其蛋白结构含有bHLH(碱性/螺旋-环-螺旋)这一特殊结构域,是HLH转录因子家族的成员achaete-scute同系物的一员。在当前的研究报道中,hASH4蛋白的表达主要发现于人皮肤中,在其他器官如脑等只有十分微量的表达,而且在胎儿皮肤中蛋白的表达量是成人皮肤的7倍,固有研究认为hASH4蛋白与皮肤的分化发育有着密切的关系,但相对于HLH蛋白家族在神经细胞发育中所起的作用的研究,其在皮肤发育中的研究还十分缺乏,并没有严谨的证据证明其如何调控或者影响着皮肤细胞的分化[6]。在已有的HLH家族蛋白功能研究报道中,我们发现很多HLH蛋白都在各自的表达区域起到非常重要的发育分化调控作用,且很多跟肿瘤的形成有密切关系,并有希望能作为肿瘤的治疗靶点,如hASH1、Id4等[7-9]。而且对ASH家族的其他蛋白功能的研究也十分匮乏,hASH2和hASH3跟hASH4有相似的情况,均有可能在皮肤的发育分化中起到一定的作用[10]。本研究希望通过对hASH4的bHLH结构域进行体外克隆表达纯化,探究其是否具有特异DNA结合框,为其在体内可能的转录因子功能和作用机理提供线索,并为hASH4蛋白进一步的结晶条件筛选、晶体结构解析和功能研究奠定基础。
1 材料与方法
1.1 材料
人工合成基因hASH4;用于表达的质粒pET28b、E.coliTop10感受态细胞及表达菌株BL21(DE3)为本实验室保存;各种限制性内切酶购自New England公司;质粒抽提试剂盒购自Axygen公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1hASH4基因的人工合成和酶切鉴定 依据GenBank中的hASH4基因序列,将hASH4基因中的稀有密码子改造为大肠杆菌偏爱密码子。人工合成hASH4基因,在合成基因的上下游分别设计NheⅠ和XhoⅠ酶切位点,构建重组表达载体pET28bhASH4,转化至大肠杆菌E.coliTop 10感受态细胞中,在含50 μg/mL卡那霉素的LB固体培养基上37℃培养约14 h。挑取单克隆,菌落PCR鉴定正确后,提交Invitrogen公司测序。
1.2.2 hASH4蛋白的表达及诱导条件优化 转化鉴定正确的重组质粒于表达菌株BL21(DE3)中,37℃培养12-14 h,挑取单菌落,转接于100 mL的含50 μg/mL卡那霉素和34 μg/mL的氯霉素的LB液体培养基中,37℃ 200 r/min培养3 h后,将其转接到含50 μg/mL卡那霉素和34 μg/mL的氯霉素的新鲜LB培养基中培养(37℃,200 r/min)至OD600值为0.6-0.8,加入1.0 mmol/L IPTG对比在诱导温度为18℃(12 h)、25℃(8 h)、37℃(4 h)下的诱导情况,确定最佳的诱导表达条件。
1.2.3 hASH4蛋白的纯化
(1)使用亲和层析柱(HisTrapTMHP)纯化目的蛋白,其操作步骤如下:离心收集的菌体经缓冲液(50 mmol/L Na2HPO4-NaH2PO4,1 mol/L NaCl,10%甘油,pH8.0)重悬浮,经压力破菌仪(循环2次)破菌,高速离心(15 000 r/min,25 min),收集上清液,加入到平衡后的HisTrap柱,用缓冲液洗涤至无蛋白流出后,使用含有50 mmol/L咪唑的洗涤缓冲液(50 mmol/L咪唑,50 mmol/L Na2HPO4-NaH2PO4,1 mol/L NaCl,10%甘油,pH8.0)洗脱非特异性吸附的杂蛋白,再用含250 mmol/L咪唑的洗脱缓冲液(250 mmol/L咪唑,50 mmol/L Na2HPO4-NaH2PO4,1 mol/L NaCl,10%甘油,pH8.0)梯度洗脱目的蛋白。
(2)使用离子交换层析(HiTrapTMCM FF)进一步纯化目的蛋白,其操作步骤如下:用20倍体积的Tris缓冲液(10 mmol/L Tris,5%甘油,pH8.0)稀释从HisTrap柱上洗脱的目的蛋白,平衡弱阳离子交换柱,将稀释的溶液加入柱中,用缓冲液洗涤至无蛋白流出后,使用含有1 mol/L NaCl的缓冲液(10 mmol/L Tris,5%甘油,1 mol/L NaCl,pH8.0)梯度洗脱目的蛋白。对纯化得到的目的蛋白进行SDSPAGE分析并透析超滤保存。
1.2.4 hASH4与DNA结合活性的研究
(1)通过分子筛试验确认纯化所得蛋白的存在形式:收集离子交换层析的纯化产物,经过超滤浓缩至体积小于5 mL,通过微量注射器将蛋白纯化产物加入到平衡后的分子筛,使用分子筛缓冲液
(10 mmol/L Tris,500 mmol/L NaCl,5%甘油,pH8.0)持续流过洗柱。根据实验室之前标定的分子筛分子量范围,按时收取对称的流出峰主峰。根据流出峰所在位置和流出峰为单峰或双峰判断蛋白存在形式。
(2)筛选是否有特异性DNA结合域:离心收集37℃下1.0 mmol/L IPTG诱导表达4 h的菌体,使用不含NaCl和甘油的缓冲液悬浮,并压力破菌、高速离心收集上清液后,上样到平衡后的HisTrap柱,用含有高浓度的NaCl和甘油的缓冲液进行洗脱,收集洗脱液,进行DNA电泳,割胶回收一些较小片段的DNA,使用PCR酶进行酶切,并连接到T载体上,挑选阳性克隆,提交Invitrogen公司进行测序,鉴定所得DNA片段是否含有一些特异性结合位点。
(3)鉴定蛋白与poly(dA)·poly(dT)和poly(dG)·poly(dC)序列的结合活性:提交Invitrogen公司合成单链poly(dA)、poly(dT)、poly(dG)、poly(dC)序列,各有22个碱基,在Tris缓冲液体系中,poly(dA)与poly(dT)、poly(dG)与poly(dC)在94℃条件下变性5 min,52℃退火连接10 min,复性成双链poly(dA)·poly(dT)和poly(dG)·poly(dC)DNA片段。在缓冲体系终浓度为50 mmol/L Tris,150 mmol/L KCl下混合DNA与蛋白,25℃温育30 min通过2倍DNA电泳胶低电压30 V(防止过热导致蛋白变性)电泳检测蛋白与DNA是否具有结合活性。
(4)合成含有已知的HLH结构域蛋白的DNA特异性结合框E-box(CANNTG)和N-box(CACNAG)的所有可能的序列片段,并在DNA两端各加上8个AT碱基(保证具有超过20个碱基对,方便进行下一步的凝胶滞留试验),外加对照组poly(dG)·poly(dC)片段,并如前面步骤复性成双链DNA,所有序列如表1所示。
所有合成的DNA与蛋白在缓冲体系终浓度为50 mmol/L Tris,150 mmol/L KCl条件下按不同比例混合、25℃温育30 min,各加入6×溴酚蓝凝胶载样缓冲液,然后上样到8%非变性丙烯酰胺凝胶,在1×TBE染色液中稳压100 V 4℃低温电泳,大约90 min后结束,收板,银染显色。根据是否出现DNA滞留片段判断蛋白的DNA结合活性。

表 1 试验中用到的双链DNA序列
2 结果
2.1 hASH4的人工合成及重组质粒的鉴定
生物信息学分析所得的hASH4的bHLH结构域氨基酸序列为:
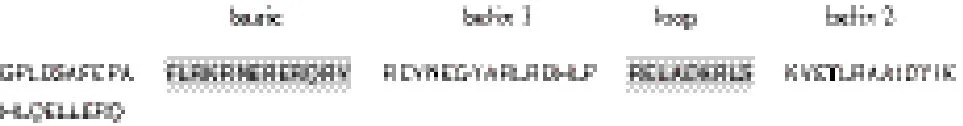
按大肠杆菌的密码子优化并加上NheI和XhoI酶切位点的基因序列为:
利用人工合成方法合成hASH4基因,将hASH4基因连接到pET28b质粒中,转入E.coliTop10感受态细胞中,挑选单菌落进行菌落PCR鉴定,阳性克隆送至Invitrogen公司测序,测序结果与设计的hASH4序列完全一致。
2.2 hASH4蛋白的诱导表达条件优化
用SDS-PAGE分析对比1.0 mmol/L IPTG条件下,在诱导温度为18℃(12 h)、25℃(8 h)、37℃(4 h)中的诱导情况如图 1所示。在37℃(4 h)诱导条件下,目的融合蛋白的可溶性表达量最高。目的融合
蛋白分子量约为9.1 kD,与图中片段大小相符。 标准分子筛图(图 4),可以看出hASH4蛋白流出峰所在的缓冲液体积略大于溶菌酶,说明纯化所得的蛋白分子量小于溶菌酶,且因为融合蛋白的单体分子量为9.1 kD,所以该蛋白是以单体形式存在。由于在纯化过程中没有加入DTT、β-巯基乙醇等试剂来抑制二硫键的作用影响二聚体的形成,说明该蛋白在体内也较难有同源二聚体的形成。这为下一步的DNA结合活性研究提供了一定的线索。
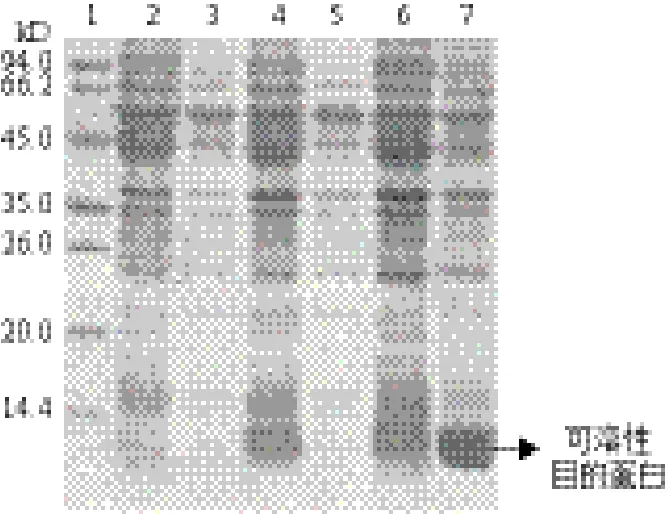
图 1 不同温度诱导hASH4蛋白表达的SDS-PAGE凝胶电泳图
2.3 hASH4蛋白的纯化
由于融合蛋白pET28b- hASH4含有His标签,可使用Ni-NTA亲和柱纯化表达产物,且融合蛋白PI值为9.73,所以选用弱阳性离子交换柱进行进一步纯化,所得融合蛋白经过SDS-PAGE分析图(图 2)中可见得到一条约为10 kD左右的蛋白条带,这与预期的蛋白分子量(9.1 kD)基本符合,且蛋白纯度较高,基本无杂带出现,并将所得蛋白用缓冲液透析,超滤至10 mg/mL,分装并-80℃保存。
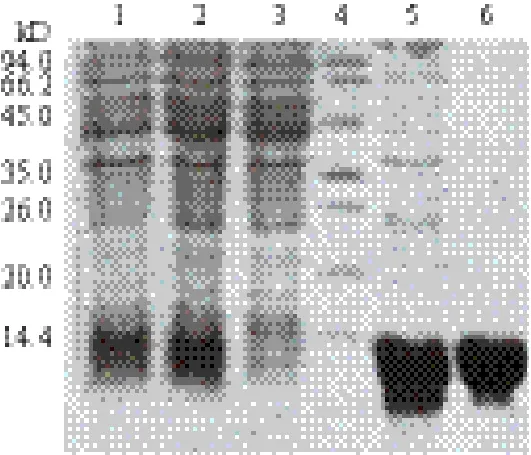
图 2 纯化过程所得蛋白的SDS-PAGE凝胶电泳图
2.4 hASH4蛋白存在形式的研究
通过分子筛试验确认蛋白是否有二聚体形成,从分子筛流程图(图 3)中可以看出,蛋白流出峰只有一个,说明蛋白只以一种形式(只有一种分子大小)存在,对照实验室保存的溶菌酶(14 kD)的
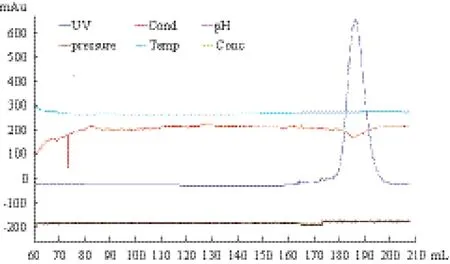
图 3 目的融合蛋白过分子筛流程图
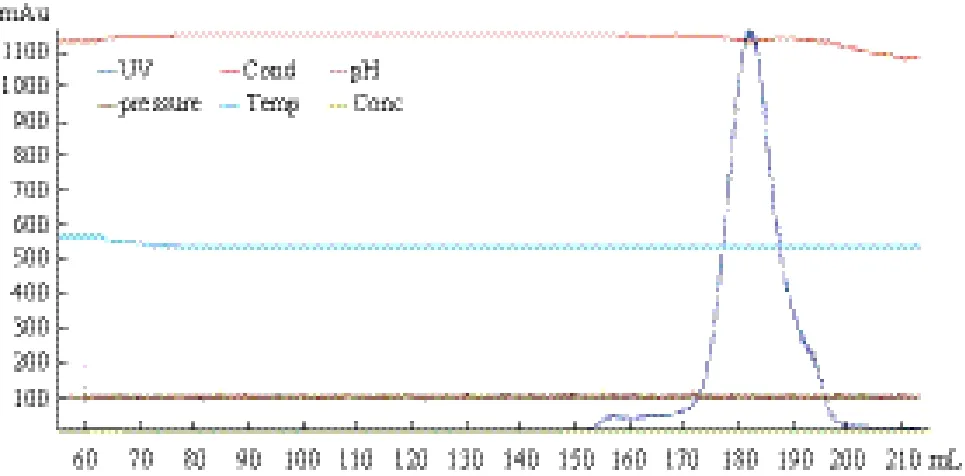
图 4 溶菌酶(14 kD)的标准分子筛图
2.5 部分与蛋白结合的DNA序列比对
经过将纯化时洗脱的DNA进行克隆表达测序,得到一些小片段DNA的序列为:
(1)5'-TGTGCGAGCCAGCTCAAACTTTTTAACC TTTTTGTTTCAATTATGATCCAGGTACATTTCTGTGA TGTTGTCTGGGTGTTATTTTAAGGCCGCAGGTACCC CATAACCTTACAAGATCTGTGGTTTTACTAAAGGAC ACCCTATGAAAACCTCTA-3'。
(2)5'-TAGACCTCGCCAATACTGTTCAGCAGG ATGTGTCGCTGGCCCTGTTTAATTTCCTGGAGCATTT CCCGTTCTCTTCTGTGCTGTCATTCATTGCAATGGCG ATGGTCATCGTCTTCTA-3'。
(3)5'-TAGACCTCGCCAATACTGTTCAGCAGG ATGTGTCGCTGGCCCTGTTTAATTTCCTGGAGCATTT CCCGTTCTCTTCTGTGCTGTCATTCATTGCAATGGCG ATGGTCATCGTCTTCTA-3'。
(4)5'-TTTGCAGTTTCATTTGATGCTCGATGAG TTTTTCTAAGAATTAATTCATGAGCGGATACATATT TGAATGTATTTAGAAAAATAAACAAATAGGGGTTC CGCGCACATTTCCCCGAAAAGTGCCACCTAAATTGT AAGCGTTAATATTTTGTTAAAAT-3'。
(5)5'-TCGCGTTAAATTTTTGTTAAATCAGCTC ATTTTTTAACCAATAGGCCGAAATCGGCAAAATCCC TTATAAATCAAAAGAATAGACCGAGATAGGGTTGA GTGTTGTTCCAGTTTGGAACAAGAGTCCACTATTAA AGAACGTGGACTCCAACGTCAAAGGGCGAAAAACC GTCTATCAGGGCGA-3'。
(6)5'-TGACCAAACAGGAAAAAACCGCCCTTA ACATGGCCCGCTTTATCAGAAGCCAGACATTAACGC TTCTGGAGAAACTCAACGAGCTGGACGCGGATGAA CAGGCAGACATA-3'。
(7)5'-TAGGAGCAGGAAACTGATGTACTGTTG ATTGGCGGCGGCATTATGAGCGCCACGTTGGGGAC CTATTTACGCGAGCTGGAGCCTGAATGGTCGATGAC CATGGTGGAGCGCCTGGAGGGTGTCGCGCAGGAGA GTTCGAACGGCTGGAA-3'。
如测序结果所示,经过比对,只有4号片段中含有E-box(CANNTG)结合框,其没有重复性高的DNA片段出现,所以猜测单体hASH4不一定具有特异性的DNA结合活性。所以下一步试验直接合成最特异性的片段poly(dA)·poly(dT)和poly(dG)·poly(dC),如果蛋白与这两种DNA依然有结合,说明其具有一定的非特异性的结合活性。poly(dA)·poly(dT)和poly(dG)·poly(dC)在试验方法1.2.4所述的体系下与蛋白反应,通过DNA凝胶电泳结果如图 5所示,poly(dA)·poly(dT)序列和poly(dG)·poly(dC)序列与蛋白均有一定的结合活性,且poly(dG)·poly(dC)序列与蛋白的结合活性稍微强一些,所以猜测hASH4蛋白具有非特异性的DNA结合活性,而特异性则需要进一步验证。
从已有研究得知hASH4蛋白所属的bHLH转录因子家族的A组子家族,最常见的DNA结合框为CAGCTG其次为CACCTG。在下一轮试验设计中,第一步采用poly(dG)·poly(dC)片段o号、带有N-box的k号片段、带有最常见的CAGCTG框的h号片段与蛋白互作。在对比DNA与蛋白比为1∶1、1∶3、1∶6的不同组别非变性丙烯酰胺凝胶电泳结果(图 6),发现在较高蛋白比6∶1时3个片段均出现相同的DNA片段滞后现象,在3∶1组中也有非常微量的滞后条带,说明蛋白与3种片段存在相同的结合活性,且蛋白与DNA结合不是按照1∶1的比例进行结合,如果为特异性结合,则一个蛋白能结合一个DNA双链,说明蛋白与3种片段均为非特异性结合。

图 5 蛋白与特异DNA互作的凝胶电泳图

图 6 双链DNA与hASH4蛋白互作的非变性聚丙烯酰胺凝胶电泳图
第2步试验,减少DNA量加大蛋白比(1∶6、1∶9、1∶12),并使用含有A组子家族中最大可能的2个DNA特异结合框CAGCTG与CACCTG的h号片段和i号片段以及对照的poly(dG)·poly(dC)与蛋白互作,从图 7中可以看出,3种DNA片段与蛋白均有结合存在,且结合活性没有明显不同。
第3步试验,使用所有合成的含有E-box
(CANNTG)以及N-box(CACNAG)DNA片段,在与蛋白比为1∶15的比例反应,并通过非变性聚丙烯酰胺凝胶电泳,从图 8发现所有泳道均有DNA滞后片段出现,其滞后片段相同,证明所有片段与蛋白都具有相同的结合活性。

图 7 双链DNA与hASH4蛋白互作的非变性聚丙烯酰胺凝胶电泳图

图 8 双链DNA与hASH4蛋白互作的非变性聚丙烯酰胺凝胶电泳图
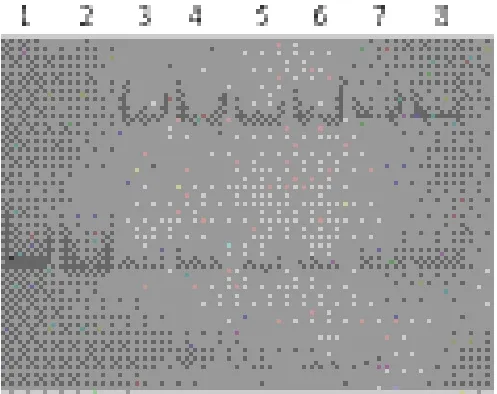
图9 双链DNA与BSA蛋白和hASH4蛋白互作的非变性聚丙烯酰胺凝胶电泳图
在前3步试验中,由于在非放射性凝胶滞留试验中高浓度蛋白有可能表现出“粘性”,继而显现出非特异性结合DNA的性质,所以采用实验室保存的BSA溶菌酶蛋白以相同蛋白浓度并DNA蛋白比(1∶12、1∶15)作为对照组。从图9中可以看出,BSA对照组(1号、2号条带)中并没有滞后的DNA片段出现,说明试验中DNA滞后的现象的确是跟hASH4蛋白结合引起的。结合前面的凝胶滞留试验结果,研究认为hASH4蛋白单体并不存在有特异性的DNA结合活性,只具有非特异性结合活性。
3 讨论
本研究中先期试验得到的与hASH4蛋白结合的DNA片段测序结果显示并没有存在已知的HLH转录因子家族所有特异性结合框,且发现蛋白与poly(dG)·poly(dC)和poly(dA)·poly(dT)这种非常特异的DNA都具有结合,固猜测其并没有特异性结合DNA现象存在。所以在进一步的试验设计中就采用较为简单的DNA凝胶电泳和非放射性凝胶滞留试验来定性证明这一猜测。如果发现其存在着特异性的DNA结合活性,则需要放射性的EMSA试验来定性和定量证明蛋白特异性DNA结合活性的强弱,虽然也有研究直接通过非放射性的凝胶滞留试验验证蛋白的特异性的DNA结合活性,但我们认为该试验方法并不严谨,可能只能定性地说明蛋白具有特异性结合活性,但并不能定量的证明[11,12]。
从试验结果中发现hASH4虽然属于HLH转录因子家族A子家族,却不具有特异性的DNA结合活性,且通过分子筛试验证明hASH4蛋白在体外以单体形式存在,不形成同源二聚体,这证明该蛋白在体内一般也不会形成同源二聚体。所以猜测hASH4蛋白可能需先形成异源二聚体或多聚体才能进一步特异性结合DNA而作用于下游基因并发挥转录因子的功能,这种现象在HLH转录因子家族中普遍存在,如Max[13]、E47[14]蛋白家族等。要证明这个猜测则需要在进一步研究进行验证。由于hASH4蛋白于幼儿皮肤中大量表达存在,其功能应该与皮肤发育有关,进一步的研究可以尝试找到已知的在皮肤分化发育中起到重要作用特别是也在幼儿皮肤大量表达的HLH转录因子或其他结构域转录因子,与hASH4蛋白相互作用研究是否存在共同作用,若存在共同作用,则进一步证明其复合物是否具有特异性的DNA结合活性。若无法找到也在皮肤中大量表
达的蛋白,则可以通过与已知的一些重要的HLH转录因子相互作用,已有研究表明存在部分HLH转录因子在多个器官可以与不同的HLH转录因子蛋白结合形成异源二聚体而发挥功能作用,若找到可以与hASH4蛋白相互作用的蛋白,可能会给其在体内所起的功能和作用机制提供线索。
本研究采用的是原核表达系统对hASH4蛋白进行表达纯化,所得蛋白的翻译后修饰状态可能与细胞内存在一定的不同,从而影响其与DNA的结合。在已有的对该家族同组别蛋白的研究中,多数均采用原核表达系统,例如MyoD、Max、E蛋白、PHO等蛋白家族[1,13-18],通过原核表达报道了完整的蛋白晶体以及蛋白和DNA结合的晶体。本研究中hASH4蛋白能非特异性的结合DNA说明原核表达的hASH4蛋白具有预测性的DNA结合活性,只是这种非特异性结合DNA的性质是否真正代表细胞内该蛋白的特性还有待进一步的研究和确认。
通过原核表达得到的真核生物转录因子蛋白单体的低溶解度和不稳定性导致其晶体结构的不易获取,所以对HLH蛋白晶体结构解析的研究大多集中于蛋白与DNA复合结构或蛋白二聚体与DNA的复合结构,PDB数据库上对HLH蛋白单体的结构数据较少,大部分为复合结构数据[1,13,15-18]。因此在对HLH转录因子蛋白结构和功能的研究中,其单体与DNA是否存在特异性结合活性是第一步需要得到验证的,本研究所采用的方法较为简单快捷,可以较好地在HLH转录因子家族的结构功能研究中得到推广。
4 结论
本研究成功构建了hASH4的表达纯化系统,通过 pET28b- hASH4 重组表达质粒在大肠杆菌BL21(DE3)菌株中,原核表达得到可溶性融合蛋白,及电泳纯化目的蛋白。hASH4蛋白单体不存在特异性的DNA结合活性,只存在非特异性结合活性。
[1] Ma PC, Rould MA, et al. Crystal structure of MyoD bHLH domain-DNA complex:perspectives on DNA recognition and implications for transcriptional activation[J]. Cell, 1994, 77(3):451-459.
[2] 王勇, 陈克平, 姚勤. bHLH 转录因子家族研究进展[J]. 遗传, 2008, 30(7):821-830.
[3] Hajime O, Haruki O, et al. Transcription factors involved in lens development from the preplacodal ectoderm[J]. Eev Biol, 2012, 363(2):333-347.
[4] Massari ME, Murre C. Helix-loop-helix proteins:regulators of transcription in eucaryotic organisms [J]. Mol Cell Bio, 2000, 20(2):429-440.
[5] Jones S. An overview of the basic helix-loop-helix proteins [J]. Genome Biol, 2004, 5(6):226-231.
[6] Jonsson M, Mark EB, Brantsing C, et al. Hash4, a novel human achaete-scute homologue found in fetal skin[J]. Genomics, 2004, 84(5):859-866.
[7] Michael F, Ralf M, Andreas S, et al. Translational regulation of the human achaete-scute homologue-1 by fragile X mental retardation Protein[J]. J Biol Chem, 2009, 284(7):4244-4266.
[10] Miyamoto T, Hasuike S, Jinno Y, et al. The human ASCL2 gene escaping genomic imprinting and its expression pattern[J]. J Assist Reprod Genet, 2002, 19(5):240-244.
[11] Huang B, Liu JY. Prokaryotic expression and purification of a cotton dehydration responsive element binding protein GhDBPl and its DNA binding activity[J]. Prog Biochem Biophys, 2006, 33(3):247-253.
[12] Huang W, Wu QY. The ManR specifically binds to the promoter of a Nramp transporter gene inAnabaenasp. PCC 7120:a novel regulatory DNA motif in cyanobacteria[J]. Biochem Biophys Res Commun, 2004, 317(2):578-585.
[13] Nair SK, Burley SK. X-ray structures of Myc-Max and Mad-Max recognizing DNA.Molecular bases of regulation by proto-oncogenic transcription factors[J]. Cell, 2003, 112(2):193-205.
[14] Antonella L, Gerald PG, et al. Crystal structure of E47-NeuroD1 beta2 bHLH domain-DNA complex:heterodimer selectivity and DNA recognition[J]. Biochemistry, 2008, 47(1):218-229.
[18] Sauv S, Tremblay L, Lavigne P. The NMR solution structure of a mutant of the Max b/HLH/LZ free of DNA:insights into the specific and reversible DNA binding mechanism of dimeric transcription factors[J]. J Mol Biol, 2004, 342(3):813-832.
(责任编辑 李楠)
Expression,Purification and DNA Binding Activity of Human Transcription Factor hASH4
Su Zhuolei Lou Tiantian Wang Yuandong Ji Chaoneng
(Institute of Genetics,School of Life Science,Fudan University,Shanghai 200433)
hASH4 is a member of Helix-Loop-Helix(HLH)proteins which are an important group of transcription factors that exert such a determinative influence on a variety of cell proliferation, determination and differentiation from yeast to human. hASH4 has been reported closely related to skin differentiation and development, but the exact mechanism is unknown. In this study, the expression plasmid of pET28bhis- hASH4 was restructured and successfully expressed in BL21(DE3). After the optimization of temperature, time, IPTG concentration of expression, we ascertain that 1mmol/L IPTG expressed 4 hours at 37℃ can get the best expression. and we got the electrophoretic purity of the target protein by Ni-NTA affinity chromatography and ion cation exchange chromatography. The non-radioactive EMSA experiment between DNA and protein showed that the hASH4 protein only has the non-sepcific DNA binding activity without specific DNA binding activity. The play of transcription factors by hASH4 in the body may be need to form a heterodimer or multimer to further specific binding to DNA and act on the downstream genes. This study provided clues for the really function in vivo of hASH4 and laid the foundation for the further crystallization conditions screening, structural analysis and functional studies.
HLH bHLH hASH4 DNA-binding Specific binding Non-specific binding
2014-04-30
国家自然科学基金项目(30770427),“973”课题(2009CB825505)
苏琢磊,男,硕士研究生,研究方向:分子遗传与结构生物学;E-mail:suzhuolei@gmail.com
季朝能,男,博士,教授,研究方向:分子遗传与结构生物学;E-mail:chnji@fudan.edu.cn
