海参溶菌酶枯草芽孢杆菌基因工程菌构建
2014-03-17孙璐刘志文邹丹李丹潘博丛丽娜
孙璐 刘志文 邹丹 李丹 潘博 丛丽娜
(大连工业大学 生物工程学院,大连 116034)
海参溶菌酶枯草芽孢杆菌基因工程菌构建
孙璐 刘志文 邹丹 李丹 潘博 丛丽娜
(大连工业大学 生物工程学院,大连 116034)
通过基因重组等技术构建重组海参溶菌酶的枯草芽孢杆菌基因工程菌,并对此基因工程菌进行生长曲线的测定和稳定性分析。结果表明,海参溶菌酶基因特异引物在400 bp处扩增出特异性条带,与预期的海参溶菌酶基因大小一致;重组表达质粒pHT43-SjLys经双酶切验证得8 000 bp和400 bp左右的片段;重组海参溶菌酶的枯草芽孢杆菌基因工程菌与原始菌株WB600相比生长趋势基本一致,外源基因的插入对菌体的生理代谢未造成太大影响;在无选择压力的条件下,重组质粒的稳定性良好,连续传5次后的遗传稳定性为94%,并且提取质粒和双酶切验证后发现工程菌没有发现重排或丢失现象。表明重组海参溶菌酶基因工程菌pHT43-SjLys/WB600构建成功。
基因重组 海参溶菌酶 枯草芽孢杆菌 基因工程菌 表达载体
溶菌酶(Lysozyme,EC3.2.1.17)是一种碱性球蛋白,该酶的作用机理是水解细菌细胞壁N-乙酰胞壁酸和N-乙酰氨基葡萄糖之间的β-1,4糖苷键,进而破坏细胞的肽聚糖致使细胞壁破裂,从而使细菌溶解[1,2]。目前已知的溶菌酶可分为6类:c-型、g-型、i-型、植物溶菌酶、细菌溶菌酶和噬菌体溶菌酶[3,4]。海参溶菌酶属于i-型溶菌酶。
目前海参溶菌酶还没有工业产品,对海参溶菌酶的研究多集中在产酶菌株的筛选、异源高效表达等方面,国内已有实验室成功将海参溶菌酶在大肠杆菌中进行了高效表达[5]。但用大肠杆菌作为宿主时表达产物会有包涵体,分离纯化较困难。然而枯草芽孢杆菌为单层膜便于产物分离纯化,并且它是一种益生菌[6,7],自身不产生内毒素[8,9],对人畜无致病性,因此枯草芽孢杆菌是极具潜力的基因工程菌[10-13]。目前已有研究表明侧孢短芽孢杆菌碱性
蛋白酶基因BLG4[14]、甘露聚糖酶基因Man23[15]、耐高温α-淀粉酶基因[16]等已经在枯草芽孢杆菌中得到了高效表达。
本课题组已克隆得到海参溶菌酶基因,为了得到重组海参溶菌酶基因工程菌,本试验构建该基因在枯草芽孢杆菌中的重组表达载体,经转化验证后,对基因工程菌的生物活性及稳定性进行分析,以期获得较稳定的工程菌株,为重组海参溶菌酶基因工程菌的高效表达及实际应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株 质粒pHT43和枯草芽孢杆菌WB600购自上海今迈生物有限公司,DH5α和pMD18T-Simple购自于大连宝生物有限公司。
1.1.2 试剂TaqDNA聚合酶、dNTP、限制性内切酶BamHⅠ、SmaⅠ、SolutionⅠ连接液、DNA Marker、氨苄青霉素(Amp)、氯霉素(Cam)、胶回收试剂盒、质粒提取试剂盒。
1.2 方法
1.2.1 引物的设计与目的基因SjLys的扩增 根据海参溶菌酶基因SjLys的cDNA全序列设计一对引物,上游引物HS-Q-P11:5'-GCCGGATCCATGCAAGTTCCTTCTG-3',下游引物HS-Q-P12:5'-GCCCGGGAATTCTCAGTTGTTGCTC-3',下划线分别为BamH I和SmaI酶切位点。以实验室保存的pMD18T-SjLys质粒为模板进行PCR扩增,反应条件:94℃ 5 min;94℃ 30 s,59℃ 30 s,72℃ 1 min,循环30次;72℃10 min。扩增完成后,用1%琼脂糖凝胶电泳检测。1.2.2 目的基因SjLys的克隆和序列比对 将上述PCR扩增产物用限制性内切酶BamHⅠ和SmaⅠ双酶切回收后连接到pMD18T-Simple载体上,转化至大肠杆菌DH5α感受态细胞中,经Amp筛选后,提取质粒,通过双酶切鉴定后,筛选出阳性克隆子,将阳性克隆子pMD18T-Simple-SjLys送至北京华大基因有限公司进行测序,然后进行序列比对分析。
1.2.3 重组表达质粒pHT43-SjLys的构建及转化 将上述重组克隆质粒pMD18T-Simple-SjLys用限制性内切酶BamHⅠ和SmaⅠ双酶切回收目的片段SjLys后,与同样双酶切回收后的pHT43用SolutionⅠ连接液进行连接,构建了重组表达载体pHT43-SjLys。然后将构建好的重组表达质粒转化至大肠杆菌DH5α感受态细胞中,经Amp筛选后,提取质粒,通过双酶切鉴定后,筛选出阳性克隆子。
1.2.4 工程菌株pHT43-SjLys/WB600的构建及鉴定 将上述构建好的重组表达质粒pHT43-SjLys通过电转化法转化至枯草芽孢杆菌WB600感受态细胞中[17,18],在10 μg/mL的Cam的LB平板上筛选转化子,挑取单菌落做菌落PCR验证,然后挑取菌落PCR验证为阳性的转化子于5 mL含有Cam抗性的LB培养基中培养,提取质粒[19],用限制性内切酶BamHⅠ和SmaⅠ双酶切鉴定,筛选阳性克隆子。
1.2.5 工程菌株pHT43-SjLys/WB600的生长曲线测定 将枯草芽孢杆菌WB600和基因工程菌pHT43-SjLys/WB600分别在LB平板上活化(后者加入10 μg/mL Cam),分别挑取单菌落接种到LB培养基中培养(后者加入10 μg/mL Cam),然后分别离心收集菌体,再用LB培养基重悬菌体。用紫外分光光度计测定两菌的OD600值,使两菌的OD600值相当后按1%接种量分别将两菌接种于无抗生素的LB培养基中振荡培养(两者条件相同),每株菌设3个重复试验,每隔一段时间取样测定其OD600值。
1.2.6 工程菌株pHT43-SjLys/WB600的稳定性分析 参考蒋岚[20]的方法挑取重组菌的单菌落,接种至5 mL不含抗生素的LB培养基中,37℃ 培养12 h,再按1%接种量转接到另一个不含抗生素的培养基中培养24 h,再将此菌液稀释后涂布于无抗生素的LB平板上,然后挑取100个单菌落分别点接在不含抗生素的LB平板上和含Cam的LB平板上,37℃ 培养12 h后计数平板上的单菌落数,作为传1次的质粒稳定性的标准。如此每隔24 h按1%接种量重新培养,直至计数传5次的稳定性。
2 结果
2.1 海参溶菌酶基因SjLys序列的获得
以含海参溶菌酶基因的质粒pMD18T-SjLys为模板,特异引物HS-Q-P11和HS-Q-P12扩增出的海参溶菌酶基因SjLys,结果(图1)显示,在400 bp左右处有明显的条带,与预期大小相符,表明扩增成功。

图1 PCR扩增目的基因SjLys
2.2 重组克隆质粒pMD18T-Simple-SjLys的构建与鉴定
将上述的溶菌酶基因SjLys进行回收和纯化,并将其克隆转化到pMD18T-Simple质粒中,获得重组克隆质粒pMD18T-Simple-SjLys,该质粒的双酶切验证结果(图2)显示,在400 bp和3 000 bp左右处有明显的特异性条带,条带大小与预期相符。并进一步对其溶菌酶基因SjLys的测序验证,测序结果通过Clustal序列比对分析后,结果表明溶菌酶基因SjLys的重组克隆质粒构建成功。
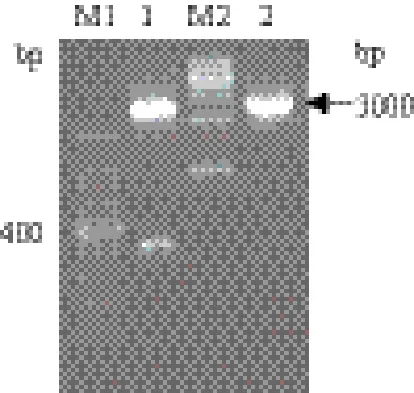
图2 重组质粒pMD18T-Simple-SjLys双酶切验证
2.3 重组表达质粒pHT43-SjLys的构建与鉴定
上述的重组质粒pMD18T-Simple-SjLys和载体pHT43用BamHⅠ和SmaⅠ双酶切后进行连接,构建了重组表达载体pHT43-SjLys。重组表达质粒pHT43-SjLys,片段长为8 432 bp(图3)。将重组质粒转化至枯草芽孢杆菌WB600中后提取质粒并进行双酶切验证,结果(图4)显示,在400 bp左右和8 000 bp左右有明显的特异性条带,条带大小与预期大小相符,表明重组表达载体的质粒已构建成功。
2.4 工程菌株pHT43-SjLys/WB600的生长曲线测定
两株菌的生长曲线(图5)显示,工程菌株和原始菌株的生长趋势基本一致,枯草芽孢杆菌WB600在接种1.5 h后进入对数生长期,6 h后对数生长期结束,而工程菌株在1 h后进入对数生长期,比原始菌株提前了0.5 h,对数生长期在5 h后结束,比原始菌株提前了1 h,之后两菌株的生长速度基本保持一致。因此可以看出,外源基因的插入对菌体的生理代谢未造成太大影响。

图3 重组表达载体pHT43-SjLys图谱

图4 重组载体pHT43-SjLys双酶切验证
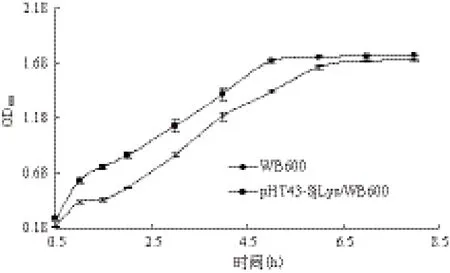
图5 枯草芽孢杆菌WB600和基因工程菌pHT43-SjLys/ WB600的生长曲线
2.5 工程菌株pHT43-SjLys/WB600的稳定性分析
对于工程菌株稳定性的分析是将工程菌株pHT43-SjLys/WB600在没有抗生素的LB培养基中连续培养,每传1次取菌液进行测定,结果(图6)显示,在无选择压力的条件下,重组质粒的稳定性良好,连续传5次后的遗传稳定性为94%。然后分别提取连续传3次和5次的工程菌pHT43-SjLys/WB600的质粒并进行双酶切检测,得出传3次和5次的菌,在含Cam的培养基上没有生长的菌提取不到质粒,而依然在Cam抗性平板上生长的细菌可以提取到质粒并且质粒大小与出发菌株大小一致,而且酶切结果也相同,因此说明工程菌没有发生重排或丢失现象。
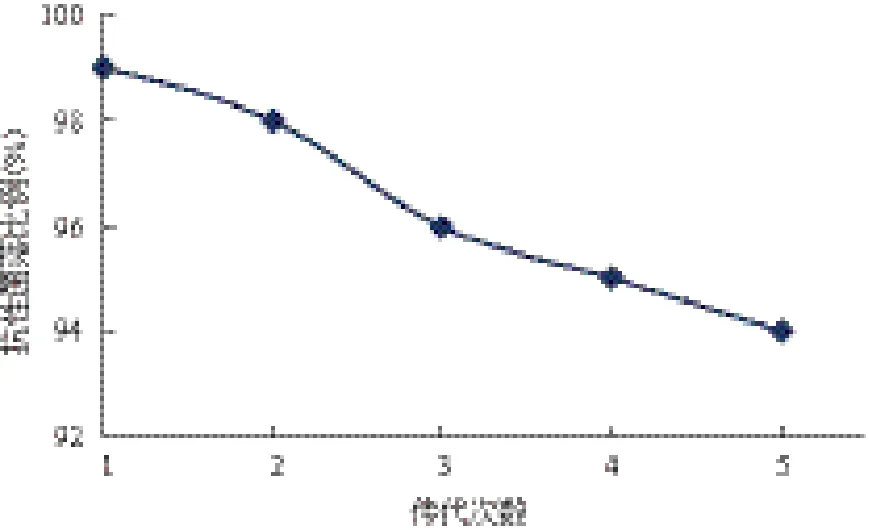
图6 工程菌pHT43-SjLys/WB600稳定性分析
3 讨论
海参溶菌酶存在于海刺参的各个组织中,由于海洋高盐、高压、低温等独特的地理环境使得该酶具有了其它陆地生物来源的溶菌酶所不具备的特点,所以,这类溶菌酶的研究也越来越广泛[21,22]。传统方法生产溶菌酶具有成本高,生产工艺复杂等问题,所以应用生物工程的方法生产溶菌酶基因工程菌已成为了当今的发展趋势。目前对海参溶菌酶的研究多是构建海参溶菌酶大肠杆菌基因工程菌[23],但大肠杆菌作为表达菌株会产生包涵体,分离纯化比较困难,生产成本较高等问题,这也是目前该酶在工业上难以推广的原因。枯草芽孢杆菌是一种益生菌,对人体无致病性,有较强的胞外分泌能力,且外源蛋白不会经过大肠杆菌包涵体复性,因此简化了外源蛋白的分离纯化。
本研究采用枯草芽孢杆菌作为表达宿主,为海参溶菌酶的高效表达提供了一个新的途径。有研究发现,枯草芽孢杆菌会分泌至少7种不同的胞外蛋白酶,这些蛋白酶没有底物的专一性,会将外源蛋白进行降解[24],但有研究表明,可以通过使枯草芽孢杆菌自身的蛋白酶基本失活的方法来减少蛋白酶对外源蛋白的降解,进而提高外源蛋白得率[25]。所以本研究选取了缺失6种胞外蛋白酶的枯草芽孢杆菌WB600[26]作为表达宿主,大大减少了胞外蛋白酶对外源蛋白降解的问题。由于重组质粒导入宿主菌后可能会影响其生长规律,而生长曲线可以较好地反应出菌株的生长情况,因此本研究对重组菌株与原始菌株进行了生长曲线的测定,试验结果表明重组质粒的导入对菌体的生理代谢未造成太大影响。在枯草芽孢杆菌的表达质粒中,Bron等[27]研究发现枯草芽孢杆菌的可复制质粒进行复制时会产生单链DNA,容易导致质粒的丢失,但这个问题可以通过引入θ-复制模式质粒克服,所以本研究选用了具有θ-复制模式的pHT43表达载体,减少了质粒丢失的问题。并且本研究进一步通过对工程菌株稳定性的测定来验证重组质粒的丢失情况,试验结果表明,本试验构建的基因工程菌没有出现重排或丢失的现象。综上所述,重组海参溶菌酶基因工程菌成功的构建,为近一步研究海参溶菌酶的高效表达奠定了基础。
4 结论
本研究成功将海参溶菌酶基因SjLys克隆到了pHT43表达载体上,构建了pHT43-SjLys重组表达载体,并转化入枯草芽孢杆菌WB600中,成功构建了重组海参溶菌酶基因工程菌。结果表明,构建的基因工程菌与原始菌株的生长趋势基本一致,并且外源基因的插入对菌体的生理代谢未造成太大影响;同时在工程菌株稳定性上本试验构建的工程菌株在连续传5次后遗传稳定性为94%,在提取质粒和双酶切后的结果表明,构建的基因工程菌没有出现重排或丢失的现象。
[1] Beck G, Habicht GS. Immunity and the invertebrates[J]. Sci Am, 1996, 275(5):60-66.
[2] 杨西建, 丛丽娜, 路美玲, 等.海参i型溶菌酶基因及其编码产物的结构特点[J]. 中国生物化学与分子生物学报, 2007, 23(7):542-547.
[3] Prager EM, Wilson AC, Arnheim N. Widespread distribution of lysozymegin egg white of birds[J]. The American Society of Biological Chemists, 1974, 249(25):7295-7297.
[4] 谷跃峰, 丛丽娜, 骆宁.海参溶菌酶基因克隆及在比赤酵母中的表达与纯化[J].大连工业大学学报, 2010, 29(5):317-320.
[5] 王丹, 丛丽娜, 谢三群, 等.重组海参溶菌酶工程菌发酵及表达产物纯化和性质的研究[J].生物技术通报, 2011(6):187-192.
[6] 刁其玉, 屠焰, 齐广海.益生菌(素)的研究及其在饲料中的应用[J].饲料工业, 2002, 23(10):1-4.
[7] 娄丽, 高学军, 敖金霞.富含蛋氨酸玉米醇溶蛋白在枯草芽孢杆菌中的表达[J].微生物学杂志, 2011, 31(5):31-34.
[8] Brockmeier U, Wendorff M, Eggert T. Versatile expression and secretion vectors forBacillus subtilis[J]. Current Microbiology, 2006, 52(2):143-148.
[9] Bolhuis A, Tjalsma H, Smith HE, et al. Evaluation of bottlenecks in the late stages of protein secretion inBacillus subtilis[J]. Appl Environ Microbiol, 1999, 65(7):2934-2941.
[10] Liu G, Xing M, Yu SW. High-effective expression of thermostable α-amylase from a bacterial phage based recombinantBacillus subtilis[J]. Chin J Appl Environ Biol, 2005, 11(3):368-372.
[11] 王彩澜, 刘教育, 李学琴, 等.酸性α-淀粉酶基因在枯草芽孢杆菌中的高效表达[J].食品与发酵专业, 2012, 38(5):52-55.
[12] Zhang XZ, Yan X, Cui ZL, et al. Recombinant expression and secretion ofmpdgene using the promoters of ytkA and ywoF gene fromBacillus subtilis[J]. Chin J Biotechnol, 2006, 22(2):249-256.
[13] 沈卫峰, 牛宝龙, 翁宏飚.枯草芽孢杆菌作为外源基因表达系统的研究进展[J].浙江农业学报, 2005, 17(4):234-238.
[14] 郭菁, 田宝玉, 蔡婉玲, 等.侧孢短芽孢杆菌碱性蛋白酶基因BLG4在枯草芽孢杆菌WB600中的高效表达[J].福建农林大学学报:自然科学版, 2011, 40(2):165-171.
[15] 胡杨, 周海燕, 董蕾, 等.甘露聚糖酶基因Man23在芽孢杆菌WB600中的表达[J].湖南农业大学学报:自然科学版, 2007, 33(5):539-541.
[16] 董晨, 曹娟, 张迹, 等.耐高温α-淀粉酶基因在枯草芽孢杆菌中的高效表达[J].应用与环境生物学报, 2008, 14(4):534-538.
[17] Sambronk J, Fritsch EF, Maniatis T. Molecular cloning:a laboratory manual[M]. 2nd ed. New York:Cold Spring Harbor Laboratory Press, 2002:568-595.
[18] Xue GP, Johnson JS, Dalrymple PB. High osmolarity improves the electro-transformation efficiencf of the gram-positive bacteriaBacillus subtilisandBacilluslicheniformis[J]. Journal of Microbiological Methods, 1999, 34(3):183-191.
[19] 吕正兵, 张方, 夏颖.一种适合芽孢杆菌质粒DNA提取的改良裂解法[J].安徽师范大学学报, 2002, 3(75):630-634.
[20] 蒋岚, 杨永华, 龚毅, 等.稀有密码子对proUK基因在大肠杆菌中高表达的影响[J].生物工程学报, 1999, 15(1):64-67.
[21] 李卫林, 汤克勇, 曹建.生物活性多肽的应用研究[J].粮食加工, 2005(2):45-47.
[22] Shimizu M. Food-derived peptides and intestinal functions[J]. Biofactors, 2004, 21(1-4):43-47.
[23] 王秀霞, 丛丽娜, 王丹, 等.海刺参i型溶菌酶基因的重组表达及抑菌谱分析[J].生物工程学报, 2009, 25(2):189-194.
[24] Sarvas M. Gene expression in recombinantBacillus[J]. Bioprocess Technol, 1995, 22:53-57.
[25] Wong SL, Kawamura F, Doi RH. Use of theBacillus subtilissubtilisin sign peptide for efficient secretion of Tem betalactamase during growth[J]. Journal of Bacteriology, 1986, 168(2):1005-1009.
[26] Wu Xu, Lee W, Tran L, et al. Engineering aBacillus subtilisexpression-secretion system with a strain deficient in six extracellular proteases[J]. J Bacteriol, 1991, 173(16):4952-4958.
[27] Bron S, Bosma P, van Belkum MJ, et al. Stability function in theBacillus subtilisplasmid pTA1060[J]. Plasmid, 1987, 18(1):8-15.
(责任编辑 马鑫)
Construction of Genetic Recombination for Sea Cucumber Lysozyme in Bacillus subtilis
Sun Lu Liu Zhiwen Zou Dan Li Dan Pan Bo Cong Lina
(College of Bioengineering,Dalian Polytechnic University,Dalian 116034)
The expression of lysozyme from sea cucumber Stichopus japonicus in Bacillus subtilis were constructed by the method of recombinant DNA technique, and the expression plasmid pHT43-SjLys of growth curve and stability were analyzed. Results showed that a specific strip about 400 bp was visible in the result of agarose gel electrophoresis, which was consistent with expected size of sea cucumber lysozyme gene. Construction of the lysozyme was performed in a vector pHT43 and validated by double digestion with BamHⅠand SmaⅠ, witch indicated the fragment size was consistent with the expected result. The growth trend of engineering bacteria was consistent compared with the wild type strain WB600, and insertion of foreign genes did not affect the cell’s metabolism. In the absence of selection pressure, the recombinant plasmid was stability, and there was no gene rearrangement and lost. The results showed that the recombinant sea cucumber lysozyme genetic engineering bacteria pHT43-SjLys/WB600 is constructed successfully.
Genetic recombination Sea cucumber lysozyme Bacillus subtilis Genetic engineering bacteria Expression vector
2014-01-02
国家自然科学基金项目(31070164),辽宁省教育厅重大平台专项(LT2011008),辽宁省自然科学基金资助项目(20102009)作者简介:孙璐,女,硕士研究生,研究方向:分子生物学;E-mail:561166567@qq.com
刘志文,男,博士,副教授,研究方向:海洋生物基因工程菌的开发和应用;E-mail:alzw@dlpu.edu.cn丛丽娜,女,博士,教授,研究方向:海洋生物活性物质的研究和开发;E-mail:congln@dlpu.edu.cn
