小麦新抗源CH5383抗条锈病基因的遗传分析及分子定位
2014-03-17詹海仙畅志坚李光蓉贾举庆郭慧娟张晓军李欣乔麟轶杨足君
詹海仙畅志坚李光蓉贾举庆郭慧娟张晓军李欣乔麟轶杨足君
(1.电子科技大学生命科学与技术学院,成都 610054;2.山西省农业科学院作物科学研究所,太原 030031;3.山西农业大学农学院,太谷 030801)
小麦新抗源CH5383抗条锈病基因的遗传分析及分子定位
詹海仙1,2畅志坚2李光蓉1贾举庆3郭慧娟2张晓军2李欣2乔麟轶2杨足君1
(1.电子科技大学生命科学与技术学院,成都 610054;2.山西省农业科学院作物科学研究所,太原 030031;3.山西农业大学农学院,太谷 030801)
CH5383是新育成的源于中间偃麦草的渗入系,对小麦条锈病和白粉病均表现免疫。为明确其抗性来源、遗传方式和抗病基因在染色体上的位置,将CH5383的系谱材料及其与高感条锈病品种(系)杂交的F1、F2和F2:3家系群体进行条锈病抗性鉴定。结果表明,CH5383对条锈病的抗性源于中间偃麦草,对条锈病生理小种CYR32的抗性由一对显性核基因控制,将此基因暂时命名为YrCH5383。从476对SSR引物中筛选到3对引物Xgwm108、Xbarc206和Xbarc77与抗病基因连锁,遗传距离分别是8.2 cM、10.7 cM和13.6 cM。根据这两对标记在染色体上的位置,将抗病基因定位到3B染色体的长臂上。3B染色体的长臂还未见有正式命名的抗条锈病基因的报道,推测YrCH5383可能是一个源于中间偃麦草的新抗条锈病基因。
小麦 条锈病 中间偃麦草 遗传分析 分子定位
由条形柄锈菌小麦专化型(Pucciniastriiformisf. sp.tritici)引起的小麦条锈病是严重威胁小麦生产的三大病害之一[1]。实践证明,培育抗病品种是防治该病最有效的方法。迄今,在小麦及其近缘物种中已经正式命名了57个小麦抗条锈病主效基因,分布在54个位点上,编号Yr1-Yr54[2-5]。但是,由于小麦条锈菌变异频率较高,平均约两年会出现一个新的生理小种,抗源单一的抗病品种被新的条锈菌变
异小种克服而频繁丧失抗性。因此,积极拓宽抗源的选择范围,充分利用抗条锈病基因源对条锈病抗性育种十分重要。
中间偃麦草(Thinopyrum intermedium2n=6x=42,JJsS)是小麦的近缘物种,具有对锈病、白粉病和黄矮病等小麦病害高抗或免疫等优良性状,是小麦抗病研究的重要基因源。我国学者通过远缘杂交将中间偃麦草抗病基因导入普通小麦中,已经获得大量小麦与中间偃麦草的部分双二倍体、代换系、附加系和易位系等材料[6-8]。由于这些材料导入的外源基因通常是大片段甚至整条染色体,除了有利基因外,一些不利的性状也同时被导入到普通小麦中,不能直接用于抗病育种。所以,选育含有抗病基因的小片段渗入系,成为今后抗病育种工作的重点。
CH5383是通过小麦-中间偃麦草部分双二倍体与感病小麦品种(品系)杂交和回交选育成的小片段渗入系。其系谱为京4ll/TAI7045//76216-96,TAI7045是畅志坚[9]研究员选育的源于中间偃麦草的部分双二倍体。用中间偃麦草DNA做探针进行基因组原位杂交,未观察到外源信号存在,说明外源片段较小,需要用其它方法进一步检测。该材料对小麦条锈病和白粉病均表现免疫,具有分蘖力强、半矮秆、株型紧凑等优良的农艺性状,可作为优良的抗性材料应用于小麦抗病育种工作中。本试验对CH5383的条锈病抗性进行遗传分析,并对其所含的抗条锈病基因作染色体定位研究,旨在为有效地利用这个理想抗源奠定基础。
1 材料与方法
1.1 材料
CH5383是从八倍体小偃麦TAI7045与普通小麦品种杂交和回交高代品系中选育的小麦-中间偃麦草渗入系。用于抗性鉴定的抗病亲本及3个抗感杂交的F1、F2和F2:3群体均由畅志坚研究员育成并提供。
1.2 方法
1.2.1 苗期抗病性鉴定 苗期抗病性鉴定在温室中进行,待测材料一叶期时分别接种条锈病小种CYR31和CYR32,10-15 d后,待对照品种川育12充分发病后,进行抗病性调查。条锈病分级采用0-4级分级标准。
1.2.2 成株期抗病性鉴定 成株期抗性鉴定在电子科技大学农场中进行,鉴定材料包括:抗病品系CH5383,感病品种或品系SY95-71、台长29和绵阳11,抗感杂交的F1、F2和F2:3群体。抽穗期人工接种条锈病小种CYR32,待对照川育12充分发病后调查抗性。按6级分级标准统计各群体的抗感分离情况[10]。
1.2.3 DNA提取及抗感池的建立 用SDS法提取抗感双亲和F2群体的184个单株DNA。从F2群体中选取10株抗性反应型为0级的高抗单株等量混合成抗病池(Br),10株抗病等级为4级的高感单株等量混合成感病池(Bs),用于多态性标记的筛选。
1.2.4 SSR分析 选取均匀分布于小麦ABD基因组21条染色体上的476对SSR引物,根据http:// wheat.pw.usda.gov公布的引物序列,由上海英骏生物技术有限公司合成。PCR反应在Icycler定量基因扩增仪上进行。扩增体系为15 μL,包括:50 ng DNA,25 ng引物,1.5 nmol dNTPs,10×PCR Buffer和0.75 UTaq酶。反应程序:94℃变性3 min;94℃变性1 min,55℃退火45 s,72℃延伸1 min,35个循环;72℃延伸5 min。取3 μL扩增产物用8%非变性聚丙烯酰胺凝胶电泳,银染观察带型并统计。
1.2.5 数据分析 用软件Mapmaker3.0分析多态性标记与抗病基因的连锁关系,并用MapDraw V2.1绘制连锁图。
2 结果
2.1 苗期抗病性鉴定
分别用条锈病生理小种CYR31和CYR32进行苗期接种。抗病性鉴定结果表明,抗病亲本CH5383、抗性供体亲本TAI7045和抗性野生亲本中间偃麦草这两个小种均表现抗病,而系谱中的4个普通小麦品种或品系全部属于高感等级。这些均说明,CH5383对条锈病的抗性来源于中间偃麦草。
2.2 成株期抗条锈基因的遗传分析
连续3年分别对抗感亲本、F1、F2群体和F2:3家系接种CYR32小种。抗病性调查结果(表1、表2)表明,抗病材料与感病品种(系)正反交3个F1群体的抗性与抗病亲本一致。F2代遗传群体中,
CH5383与绵阳11的后代群体中,抗病单株与感病单株的数量比为114∶45(χ2=0.854 2,P=0.355);台长29与CH5383的反交组合中,抗病与感病的单株数分别是127株和50株(χ2=1.007 5,P=0.316);CH5383与SY95-71的184株F2代分离群体中,141个单株的抗病表现属于抗病类型,43株属于感病类型,符合3R∶1S的期望分离比例(χ2=0.260 9,P=0.610)。CH5383/SY95-71的F2:3代家系中,纯合抗病家系42个,分离家系87个,纯合感病家系34个,抗性分离的比值符合1∶2∶1的分离比例(χ2=1.527 6,P=0.21 6)。抗病性鉴定结果说明,CH5383成株期的抗条锈病性状是一对显性核基因控制,暂时命名为YrCH5383。
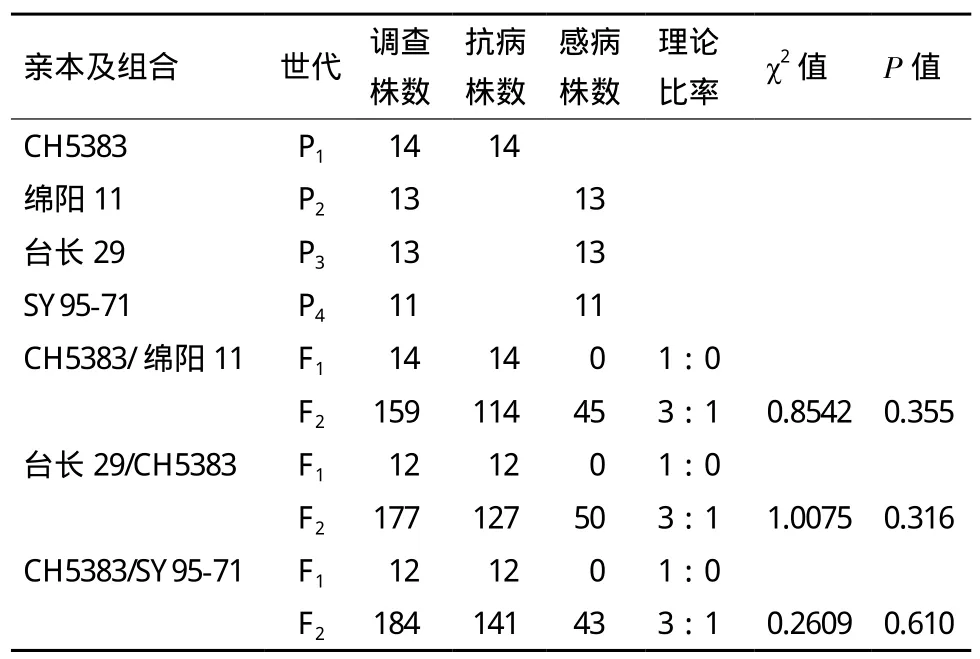
表1 抗感杂交组合各世代对白粉病的抗性表现

表2 CH5383/SY95-71的F2:3家系成株期抗病性鉴定结果
2.3 抗病基因SSR标记分析
利用分布在小麦21条染色体的476对SSR引物对抗感亲本CH5383和SY95-71进行标记筛选,发现107对引物(占22.4%)在两亲本之间有多态性。将这些有多态性的标记对构建的抗感池进一步筛选,有3对引物Xgwm108、Xbarc206和Xbarc77在抗感池之间扩增出与亲本一致的特异性条带(图1)。Xbarc206是显性标记,而Xgwm108和Xbarc77是共显性标记。这3个标记对CH5383/SY95-71杂交F2代群体的184个单株进行分析,结果(图2)显示,Xgwm108、Xbarc206和Xbarc77与抗条锈病基因YrCH5383的遗传距离分别为8.2 cM、10.7 cM和13.6 cM。Xgwm108在两亲本和抗感单株中分别扩增出约140 bp和250 bp的特异条带。Xbarc206在感病亲本和感病单株中扩增出大约290 bp的特异条带。Xbarc77扩增出的特异条带分别为320 bp和280 bp。根据Somers等[11]整合的遗传图谱,Xbarc206位于染色体3B、4A和6A染色体上,Xgwm108和Xbarc77只在3B染色体上有扩增位点,因此我们初步将YrCH5383定位到3B染色体的长臂上。
3 讨论

图1 Xbarc206(A)及Xgwm108(B)在F2群体中的扩增结果
小麦条锈病生理小种毒性变异较快,新的抗病品种在大范围使用一段时间后,抗性会很快丧失。因此,充分开发和利用小麦抗病基因源,是解决抗源单一化的有效途径。已命名的条锈病基因中,来源于小麦近缘种属的基因包括:源于顶芒山羊草(Ae.comosa2n=14,MM)的Yr8;源于黑麦(Secalecereale2n=14,RR)的Yr9;源于偏凸山羊草(Ae.
ventricosa2n=28,DDMM)的Yr17;源于粘果山羊草(Ae. kotschyi2n=28,UUSS)的Yr37;源于卵穗山羊草(Ae. geniculata2n=28,DDMM)的Yr40;源于三芒山羊草(Ae. neglecta2n=28,UUMM)的Yr42;源于中间偃麦草(Th. intermedium2n=42,JJsS)的Yr50[12-14]。其中来自黑麦1BL/1RS易位系的Yr9曾被广泛用于小麦抗条锈育种中,在CYR28小种出现前,其载体品种洛夫林10和洛夫林13曾经在全国大面积推广和应用[15,16]。由中科院西北植物所育成的源于长穗偃麦草的小偃6号保持高温抗病性长达20年之久[17]。由此可见,偃麦草属等近缘种属是小麦条锈病良好的抗源,有待开发和利用的抗病基因仍然比较多。本研究所用材料是八倍体小偃麦与普通小麦杂交后代选育的小麦-中间偃麦草渗入系,该材料具有半矮杆,株型紧凑,叶色深绿,分蘖力强,落黄好等优良的农艺性状。抗病鉴定结果显示CH5383抗谱较宽,对条锈病和白粉病的多个生理小种均表现免疫,是小麦抗病育种工作中一个新抗源。
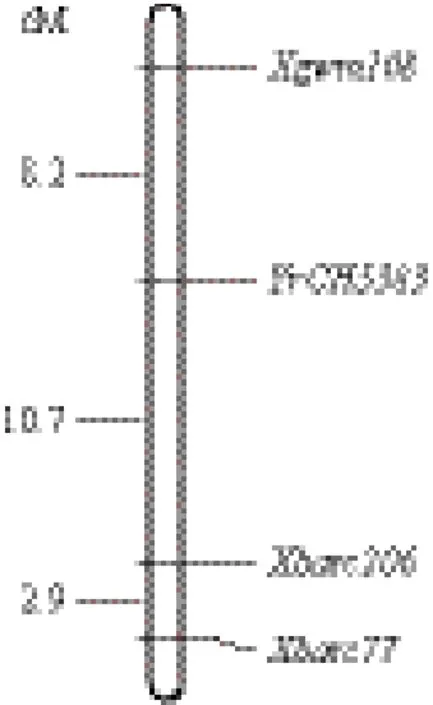
图2 条锈基因YrCH5383在3BL上的遗传图
将外源野生物种的抗性基因导入普通小麦的过程中,由于大多数导入的目标片段较大,除了有利性状外,一些不利基因也被导入受体中,从而不利于在育种工作中的应用。因此,创制含有目标性状的小片段染色体渗入系显的尤为重要。CH5383是畅志坚研究员通过六八杂交和回交选育成的小片段渗入系。CH5383的供体亲本TAI 7045和野生亲本中间偃麦草均高抗条锈病,系谱中的各小麦品种对条锈病表现高度感病,说明CH5383中的抗病基因只能来源于中间偃麦草。用中间偃麦草DNA作探针,中国春DNA做封阻进行GISH分析,未观察到外源信号存在,说明CH5383中的外源片段比较小,是一个中间偃麦草小片段渗入系。细胞学观察CH5383结构稳定,染色体数目是42条,与小麦品种中国春杂交F1花粉母细胞减数分裂中期染色体构型为2n=21Ⅱ。但中间偃麦草在该材料中渗入片段的位置及大小仍需进一步研究才能确定,目前此工作正在进行中。
已命名的57个条锈病基因中,只有Yr50来源于中间偃麦草,该基因位于小麦染色体4BL上,而本试验中YrCH5383被定位在3B染色体的长臂上。Yr50的抗病亲本TAI7047是畅志坚研究员选育的一个部分双二倍体,其外源染色体包括:6对Js染色体、1对S组染色体和1对S/Js臂间易位染色体。CH5383的抗病亲本TAI7045是畅志坚研究员选育的另一个双二倍体新类型,其外源染色体包括:4对S组(1对随体染色体),2对E组,1对S/E中间易位染色体[9]。据此推断,本试验中小麦新抗源CH5383的抗条锈病基因与已命名的抗白粉病基因Yr50不同。目前在3B染色体上命名的抗条锈基因只有Yr30,且该基因位于3B染色体的短臂[18]。根据抗病基因来源和染色体位点分析,初步推断YrCH5383可能是一个来源于中间偃麦草的抗条锈病新基因。
中间偃麦草渗入系CH5383对小麦多种病害均表现免疫,而且具有优良的农艺性状,可做为小麦抗病育种工作中良好的抗病材料加以运用。明确CH5383中条锈病基因的遗传方式和抗病基因的位置,对于充分利用这一条锈病新抗源,实现抗源多样化的抗病育种目的具有重要意义。
4 结论
本研究明确渗入系CH5383条锈病抗性源于其野生亲本中间偃麦草,对条锈病生理小种CYR32的抗性由一对显性核基因控制,该抗病基因YrCH538位于小麦染色体3B长臂上。根据基因在染色体的位置初步确定YrCH5383是一个源于中间偃麦草的抗条锈病新基因。
[1] Wellings CR. Global status of stripe rust:a review of historical and
current threats[J]. Euphytica, 2011, 179(1):129-141.
[2] McIntosh R, Dubcovsky J, Rogers J, et al. Catalogue of gene symbols for wheat:2012 supplement[EB/OL]. Annual Wheat Newsletters, 2012, 58:271-272.
[3] Liu J, Chang ZJ, Zhang XJ, et al. PutativeThinopyrum intermediumderived stripe rust resistance geneYr50maps on wheat chromosome arm 4BL[J]. Theoretical and Applied Genetics, 2013, 126:265-274.
[4] Ren RS, Wang MN, Chen XM, et al. Characterization and molecular mapping ofYr52for high-temperature adult-plant resistance to stripe rust in spring wheat germplasm PI 183527[J]. Theoretical and Applied Genetics, 2012, 125:847-857.
[5] Xu LS, Wang MN, Cheng P, et al. Molecular mapping ofYr53, a new gene for stripe rust resistance in durum wheat accession PI 480148 and its transfer to common wheat[J]. Theoretical and Applied Genetics, 2013, 126:523-533.
[6] Lin ZS, Cui ZF, Zeng XY, et al. Analysis of wheat-Thinopyrum intermediumderivatives with BYDV-resistance[J]. Euphytica, 2007, 158:109-118.
[7] Hu LJ, Li GR, Zeng ZX, et al. Molecular cytogenetic identification of a new wheat-Thinopyrumsubstitution line with stripe rust resistance[J]. Euphytica, 2010, 177:169-177.
[8] Chang ZJ, Zhang XJ, Yang ZJ, et al. Characterization of a partial wheat-Thinopyrum intermediumamphiploid and its reaction to fungal diseases of wheat[J]. Hereditas, 2010, 147(6):304-312.
[9] 畅志坚.几个小麦-偃麦草新种质的创制分子细胞遗传学分析[D].雅安:四川农业大学, 1999.
[10] 刘孝坤.小麦抗源对条锈病的抗性遗传研究初报[J].植物保护学报, 1988, 15(1):33-39.
[11] Somers DJ, Isaac P, Edwards K. A high-density microsatellite consensus map for bread wheat(Triticum aestivumL.)[J]. Theor Appl Genet, 2004, 109:1105-1114.
[12] Mago R, Miah H, Lawrence GJ, et al. High-resolution mapping and mutation analysis separate the rust resistance genesSr31, Lr26andYr9on the short arm of rye chromosome 1[J]. Theoretical and Applied Genetics, 2005, 112:41-50.
[13] Robert O, Abelard C, Dedryver F. Identification of molecular markers for the detection of the yellow rust resistance geneYr17in wheat[J]. Molecular Breeding, 1999, 5(2):167-175.
[14] Marais F, Marais A, McCallum B, et al. Transfer of leaf rust and stripe rust resistance genesLr62andYr42fromAegilops neglectaReq. ex Bertol. to common wheat[J]. Crop Science, 2009, 49(3):871-879.
[15] 王凤乐, 吴立人, 谢水仙, 等.我国小麦重要抗源材料抗条锈基因推导及成株抗病性分析[J].植物病理学报, 1994, 24(2):175-180.
[16] 牛永春, 乔奇, 吴立人.豫鲁皖三省重要小麦品种抗条锈基因推导[J].植物病理学报, 2000, 30(2):122-128.
[17] 井金学, 徐智斌, 王殿波, 等.小偃6号抗条锈性遗传分析[J].中国农业科学, 2007, 40(3):499-504.
[18] McIntosh RA, Devos KM, Dubcovsky J, et al. Catalogue of gene symbols for wheat:2004 supplement[EB/OL]. http://wheat. pw.usda.gov/ggpages/wgc/2004upd.html
(责任编辑 马鑫)
Genetic Analysis and Molecular Mapping of Stripe Rust Resistance Gene in Wheat Line CH5383
Zhan Haixian1,2Chang Zhijian2Li Guangrong1Jia Juqing3Guo Huijuan2Zhang Xiaojun2Li Xin2Qiao Linyi2Yang Zujun1
(1. School of Life Science and Technology,University of Electronic Science and Technology of China,Chengdu 610054;2. Institute of Crop Science,Shanxi Academy of Agricultural Sciences,Taiyuan 030031;3. College of Agronomy,Shanxi Agricultural University,Taigu 030801)
CH5383 is an introgression lines from Thinopyrum intermedium with high resistance to wheat stripe rust and powdery mildew. The evaluations of disease were tested using Pst races CYR31 and CYR32 in seedlings. The result showed that the stripe rust resistance came from Thinopyrum intermedium in CH5383. Genetic analysis revealed that the resistance was controlled by a single dominant gene inoculating Pst race CYR32 inadult stage. It was temporarily named YrCH5383. Two polymorphic SSR markers, Xgwm108, Xbarc206 and Xbarc77 were linked to the resistance gene with genetic distance 8.2 cM, 10.7 cM and 13.6 cM, respectively. Based on marker loci and the origination, YrCH5383 might be a new gene to wheat stripe rust on 3BL.
Wheat Stripe rust Thinopyrum intermedium Genetic analysis Molecular mapping
2013-11-06
国家自然科学基金项目(31171839),山西省留学基金项目(2012-102),山西省国际合作项目(2012081006-2)
詹海仙,女,博士研究生,研究方向:小麦分子生物学;E-mail:zhan030006@126.com
杨足君,男,博士,教授,博士生导师,研究方向:植物分子细胞生物学;E-mail:yangzujun@uestc.edu.cn
