盐度变化对携带白斑综合症病毒(WSSV)的凡纳滨对虾(Litopenaeus vannamei)的影响*
2014-03-08叶国锋陈兆明杨世平王成桂孙成波
向 赟 王 刚 叶国锋 陈兆明 杨世平, 王成桂 孙成波,①
(1.广东海洋大学水产学院 湛江 524025;2.广东高校热带海产无脊椎动物养殖工程技术研究中心 湛江 524025)
白斑综合症病毒(White spot syndrome virus,WSSV)是一种对虾高致死性病毒,其宿主广泛,传染性强,感染后出现症状 6—7d死亡率可达 80%—100%,造成的危害极大(Momoyanaet al,1994)。已使世界 30多个国家对虾养殖业蒙受巨大损失,部分地区对虾养殖业濒临绝境,严重制约了全球对虾养殖业的发展(Tapayet al,1999;Flegelet al,2009),而在我国1993年开始大规模暴发流行。近年很多研究发现引起白斑综合症暴发的原因不仅与虾体的免疫水平、病毒数量、感染方式有关,还与环境因子密切相关,例如温度、盐度、pH、氨氮含量等(吴信忠,2005;孙成波等,2006)。如高温或者低温可以抑制WSSV在对虾体内增殖(Jiravanichpaisalet al,2004;Duet al,2006;Granjaet al,2006)。pH升高可能提高斑节对虾死亡率(Gunalanet al,2010)。盐度在1h内突变大于4,会引起中国对虾体内WSSV迅速增殖和抗病能力降低(Liuet al,2006)。环境中盐度只有在对虾体液的等渗点附近,对虾才能保证正常的生理和生长状况。徐丽美等(2001)通过定量 PCR方法初步将每毫克组织含 103个病毒粒子作为疾病暴发的危险临界值;何建国等(1999)认为WSSV的潜伏期感染具有很大的危害性,且潜伏期感染转为急性感染受众多气候和水环境因子影响。凡纳滨对虾(Litopenaeus vannamei)是我国乃至全世界最主要的对虾养殖品种,本文研究不同盐度变化对感染 WSSV的凡纳滨对虾的影响,对其产业的健康可持续发展具有重要意义。
1 材料与方法
1.1 实验材料
1.1.1 健康对虾来源 健康凡纳滨对虾取自广东海洋大学东海岛海洋生物研究基地,体长为(7.71±0.98)cm。实验前随机抽取 10尾对虾进行荧光定量PCR检测,检测结果为阴性。实验前暂养5d,投喂对虾人工配合饵料 2次/d,换水 1次/d,日换水量接近100%。
1.1.2 WSSV粗提液制备 取感染WSSV症状明显的凡纳滨对虾,去除甲壳,按 1︰1(W︰V)加入高盐PBS,冰浴中匀浆,将匀浆液于4°C、7000r/min离心15min;离心后的上清液加入蔗糖至终浓度为30%(W/W),4°C、16000r/min超速离心 50min,弃上清,沉淀用PBS(pH 7.4)重悬,将重悬液用0.45μm的滤膜过滤,分装后−80°C冰箱保存。
1.1.3 DNA模板提取和引物设计 DNA模板提取方法参照Sun等(2013)的方法,PCR引物参照You等(2010)的引物设计,由上海生工生物工程技术服务有限公司合成。
1.1.4 标准品的制备 参照程晓燕等(2010)的方法制备重组质粒标准品,用核酸分析仪测定重组质粒的 DNA浓度,根据拷贝数公式计算重组质粒的拷贝数。

式中,阿伏加德罗常数为 6.02×1023,重组质粒分子量 = 1个碱基对的平均分子量(660g/mol)×重组质粒的总长度(bp)。
1.2 实验方法
1.2.1 感染方式 本实验采用人工注射感染,在凡纳滨对虾第2腹节与第3腹肌之间往心脏方向注射40μL用PBS缓冲液稀释104倍的病毒粗提液。
1.2.2 盐度变化实验 盐度变化为起始盐度(23±1)往高盐度(32±1)和低盐度(14±1)进行突变和渐变,突变时间为6h,渐变时间为72h;病毒感染分为变化前和变化后感染两种方式,实验组和对照组均设置 3个平行组,每组对虾各30尾;实验组注射40μL PBS缓冲液稀释 104倍的病毒粗提液,对照组注射 40μL PBS缓冲液。实验中投喂对虾人工配合饵料2次/日,24h充气,定时吸出排泄物,日换水量 50%。及时取出死亡对虾放入–20°C冰箱保存。各组在感染后0h、6h、12h、24h、48h、72h、96h取样保存。观察记录对虾发病及死亡率,定期检测对虾组织中病毒含量,并对死亡对虾进行病毒检测。
1.2.3 病毒检测方法 参考程晓燕等(2010)采用荧光定量PCR方法检测WSSV。
2 结果
2.1 盐度突变
2.1.1 盐度先突变后感染WSSV的结果
(1)盐度先突变后感染 WSSV对凡纳滨对虾死亡情况的影响
盐度先突变后感染 WSSV对凡纳滨对虾死亡情况的影响见图1,同一盐度感染WSSV组对虾累计死亡率显著高于未感染 WSSV组,且感染WSSV后不同盐度组的对虾累积死亡率显著提高,24h出现死亡高峰,此时低盐度14±1突变组的累计死亡率(54.1±3.8)%明显高于高盐度32±1突变组的(36.7±5.8)%和起始盐度 23±1组的(24.4±5.1)%。在整个实验过程中起始盐度 23±1组累积死亡率显著低于另外两突变组(P<0.05),各组累计死亡率至 96h达到最大,起始盐度23±1为(52.2±13.5)%,高盐度32±1突变组为(75.6±3.8)%,低盐度 14±1突变组为(63.3±3.3)%。
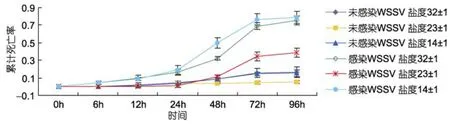
图1 盐度突变对凡纳滨对虾累积死亡率的影响Fig.1 Effects of salinity acute changes on the mortality of L.vannamei
(2)盐度突变后感染 WSSV对凡纳滨对虾携带WSSV情况的影响
盐度突变后感染WSSV对凡纳滨对虾携带WSSV情况的影响见表1,不同盐度下病虾体内病毒含量随感染时间推移逐渐升高。在整个实验过程中,在6h、24h、48h、96h时高盐度32±1突变组与起始盐度23±1组存在显著差异(P<0.05);在6h、12h、48h、72h时低盐度14±1突变组与起始盐度23±1组存在显著差异(P<0.05)。高盐度32±1突变组和起始盐度23±1组对虾体内病毒含量都在96h达到最高值,分别为5.7×107copy/g,2.3×106copy/g,低盐度突变组在72h达到最高值为2.8×107copy/g。
2.1.2 先感染WSSV后盐度突变实验结果
(1)先感染 WSSV后盐度突变对凡纳滨对虾死亡情况的影响
先感染 WSSV后盐度突变对凡纳滨对虾死亡情况的影响见图2,同一盐度感染WSSV组对虾累计死亡率显著高于未感染 WSSV组,感染 WSSV后盐度突变导致对虾累积死亡率显著提高,在整个实验过程中高盐度32±1突变组与起始盐度23±1组之间不存在显著差异(P>0.05);低盐度 14±1突变组与起始盐度23±1组之间在12h、24h、48h、72h存在显著差异(P<0.05);各组累计死亡率至96h达到最大,起始盐度23±1为(48.8±1.9)%,高盐度32±1突变组为(61.1±10.7)%,低盐度14±1突变组为(63.3±12.0)%。

表1 盐度突变后感染WSSV凡纳滨对虾携带白斑综合症病毒量的情况Tab.1 Effects of salinity acute changes on white spot syndrome virus copy number in L.vannamei infected with WSSV

图2 先感染WSSV后盐度突变对凡纳滨对虾累积死亡率的影响Fig.2 Effects of salinity acute changes on the mortality of L.vannamei infected with WSSV
(2)先感染 WSSV后盐度突变对 WSSV在凡纳滨对虾体内增殖的影响
表2中不同盐度下的病虾体内携带病毒量随时间推移而逐渐增多。整个实验过程中,高盐度32±1突变组与起始盐度23±1组在12h、24h、72h、96h存在显著差异(P<0.05);低盐度 14±1突变组与起始盐度 23±1组在 6h、12h、72h、96h存在显著差异(P<0.05),两盐度突变组病毒复制高峰期出现在盐度突变后 6h,而起始盐度23±1组出现在48h。在0h各组病毒含量差异不大,至12h高盐度32±1突变组病毒含量高出起始盐度23±1组的30倍,低盐度14±1突变组高出起始盐度23±1组的400倍,到48h后各组病毒含量相差不显著。

表2 感染WSSV后盐度突变对凡纳滨对虾携带白斑综合症病毒量的影响Tab.2 Effects of salinity acute changes on white spot syndrome virus copy number in L.vannamei infected with WSSV
2.2 盐度渐变
2.2.1 先盐度渐变后感染WSSV实验结果
(1)不同盐度对感染 WSSV凡纳滨对虾死亡情况的影响
不同盐度对感染WSSV对虾累积死亡率的影响见图3,感染WSSV组,在整个实验过程中,在0—24h各组对虾累计死亡率差异不显著(P>0.05),高盐度 32 ± 1渐变组累计死亡率与起始盐度23 ± 1组在48h、72h存在显著差异(P<0.05);低盐度14 ± 1渐变组与起始盐度23 ± 1组在48h、72h、96h存在显著差异(P<0.05)。

图3 不同盐度对感染WSSV凡纳滨对虾累计死亡率的影响Fig.3 Effects of different salinity on the mortality of L.vannamei infected with WSSV
(2)盐度渐变至相应盐度后感染WSSV对WSSV在凡纳滨对虾体内增殖的影响
不同盐度对 WSSV在对虾体内增殖的影响见表3,在整个实验过程中,0—24h凡纳滨对虾体内病毒平均含量较低,在 6h时低盐度 14 ± 1渐变组与起始盐度 23 ± 1组存在极显著性差异(P<0.01),至 12h时高盐度32 ± 1渐变组与起始盐度23 ± 1组存在极显著差异(P<0.01);至 48h出现病毒增殖高峰期,并伴随死亡高峰期,且高盐度 32 ± 1渐变组与起始盐度23 ± 1组存在显著差异(P<0.05);到 72—96h时凡纳滨对虾体内 WSSV平均含量趋于平稳,并伴随着对虾死亡。

表3 不同盐度对感染WSSV凡纳滨对虾体内病毒含量的影响Tab.3 Effects of different salinity on white spot syndrome virus copy number in L.vannamei infected with WSSV
2.2.2 先感染WSSV后盐度渐变实验结果
(1)盐度渐变对携带 WSSV的凡纳滨对虾死亡情况的影响
先感染 WSSV后盐度渐变对对虾累积死亡率的影响见图4,在整个实验过程中,感染WSSV组中高盐度32±1渐变组与起始盐度23±1组在6h、12h、24h存在显著差异(P<0.05);低盐度 14±1渐变组与起始盐度 23±1组在整个实验过程中都存在显著差异(P<0.05);在盐度渐变过程中,渐变组伴随死亡率升高,至24 h后死亡明显加快,并出现死亡高峰期。

图4 先感染WSSV后盐度渐变对凡纳滨对虾累积死亡率的影响Fig.4 Effects of salinity gradual changes on the mortality of L.vannamei infected with WSSV
(2)盐度渐变对凡纳滨对虾携带WSSV情况的影响
不同盐度下的病虾体内携带病毒量随时间推移而逐渐增多见表4,高盐度32±1渐变组与起始盐度23±1组在 6h、48h存在显著差异(P<0.05);低盐度14±1渐变组与起始盐度 23±1组在 6h、48h、96h存在显著差异(P<0.05);在整个实验中盐度渐变组对虾体内病毒增殖速度与起始盐度组的差不多,但后期死亡率明显比起始盐度高。

表4 感染WSSV后盐度渐变至相应盐度凡纳滨对虾携带白斑综合症病毒量的情况Tab.4 Effects of salinity gradual changes on white spot syndrome virus copy number in L.vannamei infected with WSSV
2.3 各处理组中不同时期死亡对虾病毒含量检测
表5中对死亡个体病毒定量检测结果可知,每个处理组的初期死亡个体病毒含量都低于死亡高峰期和后期,在感染WSSV后盐度突变处理组中,死亡初期的高盐度32±1组与起始盐度23±1组存在显著差异(P<0.05),死亡高峰中低盐度 14±1组与起始盐度23±1组存在显著差异(P<0.05),且起始盐度 23±1组病毒含量明显高于另外两盐度组病毒含量;死亡后期不存在差异性。在先感染 WSSV后盐度渐变和先盐度渐变后感染 WSSV处理组中的不同盐度组在不同死亡时期死亡个体病毒含量不存在显著性差异;在盐度突变后感染 WSSV处理组中,死亡初期和死亡高峰期中的起始盐度 23±1组与另外两盐度组中死亡个体的病毒含量都存在显著差异(P<0.05)。
3 讨论
叶建生等(2008)报道盐度突变会引起对虾体内产生一系列应激反应,在短时间内调节血液渗透压,如对虾体内的超氧阴离子产量随着盐度突变值增加而增加,血清中酚氧化酶活性随着盐度突变值增加活性升高越快,血清中 SOD活性随着盐度突变值增加而降低,血清蛋白含量随着降低。Perazzolo等(2002)也报道在盐度从34降低至22或13会引起圣保罗对虾(Farfantepenaeus paulensis)体内血淋巴中血细胞数量减少了 20%,而且抗菌活力也下降了。Sudha等(1998)已将 WSSV与印度对虾(Penaeus indicus)和斑节对虾(Penaeus monodon)的关系简单分为 3种类型:第1种为早期急性感染,对虾感染症状为出现大面积红体,机体组织高度感染 WSSV,将在 2—3d内出现大面积死亡;第2种为急性或亚急性感染,对虾组织感染程度为中度到高度之间,会在 7—10d内出现高的死亡率,主要的临床症状为被感染的对虾甲壳有明显的白斑;第3种类型为慢性感染(潜伏感染),组织仅被轻度感染,不会伴随有白斑和红体等症状,将在15—28d内出现死亡。有研究认为盐度改变会引起对虾体内相关免疫指标变化,特别是盐度降低能引起对虾血细胞数量明显降低,导致酚氧化酶活性升高。血细胞计数作为对虾免疫指标的重要参数之一,是因为对虾血细胞具有溶菌作用、凝集作用,而且能合成与免疫相关的许多酶类如溶菌酶、酸性磷酸酶、碱性磷酸酶、酚氧化酶等(Le Moullacet al,2000)。

表5 不同处理组死亡凡纳滨对虾个体WSSV定量检测结果Tab.5 WSSV amounts in the dead L.vannamei of different management group
两组盐度突变实验中都发现盐度突变对健康凡纳滨对虾存活影响显著,特别是低盐度14±1突变组累积死亡率明显高于另两组(P<0.05),原因可能是盐度突变幅度已超出部分体质较弱对虾的渗透调节能力。在先盐度突变后感染 WSSV实验发现各盐度组对虾的累积死亡率在前期较低;病毒检测也发现前期对虾体内病毒含量维持在较低水平,未达到对虾体内病毒含量的濒死临界值,而且起始盐度23±1组对虾累积死亡率都显著低于另外两突变组(P<0.05),说明感染初期由起始盐度23±1突变至 14±1和 32±1提高了对虾对病原体的易感性;感染后期由起始盐度23±1突变至14±1和32±1促使病毒在对虾体内迅速扩增,伴随着对虾大量死亡。说明盐度突变造成对虾体质损伤,抗病力下降,为病毒的扩增提供了温床。
对携带 WSSV的对虾进行盐度突变实验结果可知低盐度14±1突变组在12 h突然出现大量死亡,且与另外两组存在显著差异(P<0.05);盐度 14±1组累计死亡率比盐度32±1突变组高,此结果与Joseph等(2007)报道的盐度突变改变中国对虾血淋巴代谢和降低了对 WSSV免疫力的死亡结果相似。从病毒检测结果中发现12h后低盐度14±1突变组对虾体内病毒含量是起始盐度23±1组的400倍,高盐度32±1突变组是其的 30倍,也说明了此时各组之间累积死亡率的差异性;至实验后期病毒含量已经高于简旭凤(2003)报道的对虾感染WSSV死亡时携带病毒的数量1×105copy/g,促使对虾大量死亡。综上可知:盐度未突变时,病毒在对虾体内处于潜伏感染期,未有大量死亡和明显病症出现;盐度突变后,对虾出现大量死亡,期间伴随着红体,空胃、空肠、肝胰腺肿大等症状。盐度突变引起对虾与 WSSV之间的关系发生转变,从潜伏感染转为急性感染。
两组盐度渐变实验中都发现盐度渐变过程中对对虾存活影响不显著;将对虾驯化至不同盐度后感染WSSV实验结果发现0—24h各盐度组对虾累积死亡率无明显差异,而且 0—12h内检测到对虾体内的病毒含量有下降趋势,到 24h时病毒含量开始升高,但是病毒含量明显低于简旭凤(2003)报道对虾感染WSSV粗提液后死亡时携带病毒的数量超过 1×105copy/g,所以未见大量对虾死亡;48h至实验结束盐度14±1组累积死亡率与其它组存在显著差异(P<0.05),且高于其它组的累积死亡率,这与李才文等(2002)研究不同盐度条件下感染 WSSV日本对虾累积死亡结果相似。48h后病毒在对虾体内出现增殖高峰期,此后对虾体内病毒含量为(3.6×105)—(1.01×107)copy/g,这与孙成波等(2009)研究的斑节对虾在高位池养殖过程中体内病毒含量(9.5×105copy/g)相似,表明随着病毒含量升高,对机体造成严重损伤,最终导致对虾出现大量死亡。
先感染WSSV后盐度渐变实验结果发现0—24h起始盐度 23±1组与另外两盐度渐变组存在显著性差异,在 24h时感染组的累计死亡率都低于 18.9%,未出现大量死亡,而且 0—12h内对虾体内病毒含量较低,但累积死亡率存在差异,可能是个别对虾感染WSSV后对虾机体已有损伤,外界环境稍有变化,即出现个别死亡。48h时两盐度渐变组对虾出现死亡高峰,起始盐度23±1组死亡率有升高,到96h达到最大值78.9%。产生这样的结果可能是对虾长期处于连续较大的盐度渐变,导致对虾必须长时间进行盐度适应调节降低了自身免疫能力,使 WSSV在体内复制累积,当累积到一定值时出现大量死亡。不管盐度怎么变化,都会影响到对虾与WSSV之间的关系,在未感染 WSSV时,盐度突变和渐变都会提高对虾对WSSV的易感性,在感染WSSV后,盐度变化可能引起对虾与 WSSV之间的关系发生转变,从潜伏感染转为急性感染,因此盐度是引起白斑综合症暴发的关键影响因子。
叶建生,王兴强,马 甡等,2008.盐度突变对凡纳滨对虾非特异性免疫因子的影响.海洋水产研究,29(1):38—43
孙成波,李 婷,王 平等,2009.高位池养殖对虾携带白斑综合症病毒变化.海洋通报,28(2):116—120
孙成波,何建国,黎子兰等,2006.凡纳滨对虾和斑节对虾对WSSV敏感性的比较.湛江海洋大学学报,26(3):17—20
李才文,管越强,俞志明,2002.盐度变化对日本对虾暴发白斑综合症病毒病的影响.海洋环境科学,21(4):6—9
吴信忠,2005.中国海洋病害主流研究的进展.太平洋学报,10:49—59.
何建国,莫 福,1999.对虾白斑综合症病毒暴发流行与传播途径,气候和水体理化因子的关系及其控制.中国水产,(007):34—37
徐丽美,杨 丰,2001.利用定量PCR方法研究对虾白斑杆状病毒感染与发病的关系.高技术通讯,11(12):9—11
程晓燕,刘庆慧,黄 倢,2010.实时荧光定量PCR检测对虾白斑综合症病毒方法的建立.安徽农业科学,(26):14265—14267
简旭凤,2003.白斑综合症病毒(WSSV)原位PCR及定量PCR检测技术的建立.广州:中山大学硕士学位论文,1—67
Du H H,Li W F,Xu Z Ret al,2006.Effect of hyperthermia on the replication of white spot syndrome virus inProcambarus clarkii.Diseases of Aquatic Organisms,71(2):175—178
Flegel T W,Lio-Po G,2009.Current status of viral diseases in Asian shrimp aquaculture. Israeli Journal of Aquaculture-Bamidgeh,61(3):229—239
Granja C B,Vidal O M,Parra Get al,2006.Hyperthermia reduces viral load of white spot syndrome virus inPenaeus vannamei.Diseases of Aquatic Organisms,68(2):175—180
Gunalan B,Soundarapandian P,Dinakaran G K,2010.The effect of temperature and pH on WSSV infection in cultured marine shrimpPenaeus monodon(Fabricius).Middle East J Sci Res,5(1):28—33
Jiravanichpaisal P,Söderhäll K,Söderhäll I,2004.Effect of water temperature on the immune response and infectivity pattern of white spot syndrome virus(WSSV)in freshwater crayfish.Fish &Shellfish Immunology,17(3):265—275
Joseph A,Philip R,2007.Acute salinity stress alters the haemolymph metabolic profile ofPenaeus monodonand reduces immunocompetence to white spot syndrome virus infection.Aquaculture,272(1):87—97
Le Moullac G,Haffner P,2000.Environmental factors affecting immune responses in Crustacea.Aquaculture,191(1):121—131
Liu B,Yu Z,Song Xet al,2006.The effect of acute salinity change on white spot syndrome(WSS)outbreaks inFenneropenaeus chinensis.Aquaculture,253(1):163—170
Momoyana K,Nakano H,Koube H,1994.Mass mortalities of cultured Kuruma shrimp,Penaeus japonicus,in Japan in 1993:epizootiological survey and infection trials.Fish Pathology,29(2):135—139
Perazzolo L M,Gargioni R,Ogliari Pet al,2002.Evaluation of some hemato-immunological parameters in the shrimpFarfantepenaeus paulensissubmitted to environmental and physiological stress.Aquaculture,214(1):19—33
Sudha P M,Mohan C V,Shankar K Met al,1998.Relationship between white spot syndrome virus infection and clinical manifestation in Indian cultured penaeid shrimp.Aquaculture,167(1):95—101
Sun Y,Li F,Xiang J,2013.Analysis on the dynamic changes of the amount of WSSV in Chinese shrimpFenneropenaeus chinensisduring infection.Aquaculture,376:124—132
Tapay L M,Nadala Jr E C B,Loh P C,1999.A polymerase chain reaction protocol for the detection of various geographical isolates of white spot virus.Journal of Virological Methods,82(1):39—43
You X,Su Y,Mao Yet al,2010.Effect of high water temperature on mortality,immune response and viral replication of WSSV-infectedMarsupenaeus japonicusjuveniles and adults.Aquaculture,305(1):133—137
