L-谷氨酸包覆四氧化三铁水基磁流体的制备
2014-02-27黄秋霞广东省高州农业学校
黄秋霞(广东省高州农业学校)
一、前言
随着科技和人类生产、生活需求的快速发展,越来越多种新型材料被人们研制和应用到各个领域。磁流体作为一种新型智能材料,是一种既有固体强磁性又有液体流动性的新型功能材料,尤其是具有良好生物相容性的水基磁流体在生物医药领域有着广泛的应用。
1.L-谷氨酸概述
谷氨酸(2—氨基戊二酸)有左旋体、右旋体和外消旋体。左旋体,即L-谷氨酸。L-谷氨酸(L-Glutamicacid),化学名称为L-2-氨基戊二酸或L-α-氨基戊二酸,分子式:C5H9NO4,结构式:HOOC-CH2-CH2-CH(NH2)-COOH,分子量:147.13 g/moL,是一种鳞片状或粉末状晶体,呈微酸性,无毒。微溶于冷水,易溶于热水,几乎不溶于乙醚、丙酮及冷醋酸中,也不溶于乙醇和甲醇。
L-谷氨酸是一种重要的化合物,是动植物氮平衡中非常重要的一种氨基酸,主要用发酵法生产,玉米、小麦、甘薯、大米、甘蔗糖蜜、甜菜糖蜜等是发酵生产L-谷氨酸的淀粉质主要原料。来源丰富且生产工艺成熟,目前我国谷氨酸总发酵能力已接近160万吨,约占全球L-谷氨酸产能的75% 。同时,大量存在于谷类蛋白质中,动物脑中含量也较多。L-谷氨酸在生物体内的蛋白质代谢过程中占重要地位,参与动物、植物和微生物中的许多重要化学反应。医学上L-谷氨酸主要用于治疗肝性昏迷,还用于改善儿童智力发育。
2.本文研究的目的、内容和意义
(1)研究的目的 在前人大量的水基磁流体实验基础上,基于上述L-谷氨酸众多的化学和生物特性,以L-谷氨酸为包覆剂、以水为载液、以Fe3O4为磁性粒子研究制备具有良好生物相容性、超顺磁性、高稳定性、强磁响应性的四氧化三铁水基磁流体制备的最佳工艺。
(2)研究的内容 本文主要研究以水为载液、以Fe3O4为磁性粒子、以L-谷氨酸为表面活性剂制备水基磁流体的工艺。关于水基磁流体的制备,前人已有大量的实验和大量文献显示,同时本实验室已有合适的制备四氧化三铁水基磁流体制备的工艺,并在此基础上利用各种物理化学方法,同时借鉴前人的经验,将会从包覆阶段的以下几个方面进行深层次的研究:L-谷氨酸的用量、反应的pH值、包覆时间的把握、包覆温度的控制、反应时间和搅拌速度。
(3)研究的意义 L-谷氨酸化学吸附在纳米四氧化三铁粒子表面,制备得到强生物亲合性的水基磁流体。可作为生物医用的磁流体,达到磁性粒子、表面活性剂、基液都具有良好的生物相容性,以及在人体血液的pH值弱酸性范围内具有较好的稳定性的要求[1],在实际应用过程中,一次治疗或一次给药的时间间隔一般为数小时到数十小时,而L-谷氨酸磁流体即使在敞口的状态下,20天后,其磁性衰减都在5%以内,具有很强的磁稳定性,所以这种氨基酸磁流体具有很好的实用价值。这种磁流体在磁性药物载体、磁共振造影剂、磁高热治疗肿瘤、视网膜磁流体夹 (用于视网膜分离的修复手术)和血流的磁测量等领域有良好的应用前景[2]。通过研究水基磁流体的包覆机理,可以更好地制备性能优良的磁流体,将可以更好地指导制备无毒可生物降解的磁流体实验。在实际应用上提高实用价值。
二、实验及结果分析
1.实验仪器及药品
(1)实验仪器
JJ型电动搅拌器、HH-2A恒温水浴锅 、KQ-250DB型数控超声波清洗器 、古埃磁天平Avatar 360 FT-IR、PHS-3C精密PH计、FA 1004型电子天平
(2)实验药品
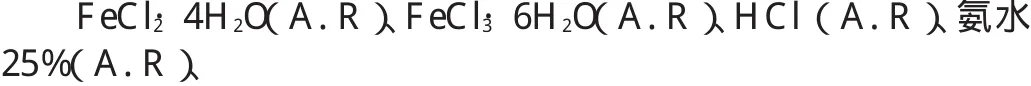
L-谷氨酸(化学纯)
2.实验的基本原理
本实验采用化学共沉淀法,其反应原理如下:
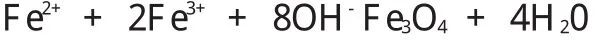
由上述反应可知Fe2+、Fe3+、OH-的理论物质的量之比为1:2:8,但实际上在反应过程中有且肯定会有一部分Fe2+会被氧化为Fe3+。因为反应是在有氧环境中进行的,而且在加热搅拌过程中,也会造成一部分Fe2+被氧化为Fe3+。。只有当Fe3+与Fe2+的比例恰当时,才能制出饱和磁化强度最大的Fe3O4粒子。很明显Fe3+/Fe2+应该小于2(物质的量之比),本文没有对此作深入的研究,因为已有大量资料研究显示,该值为1.7-1.75是比较合理的,若反应温度较高,则Fe3+/Fe2+值较小,在查阅了大量资料后,最终选择Fe3+/Fe2+为1.75进行实验。
3.工艺流程设计
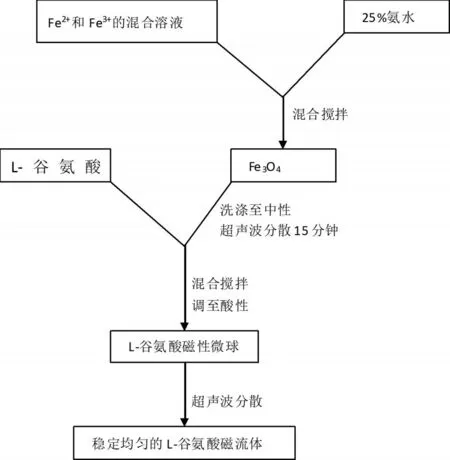
图1 L-谷氨酸磁流体的制备工艺流程图
4.实验过程
磁性粒子的制备 (1)用二次蒸馏水清洗实验用的所有玻璃仪器,保证没有杂质混入,然后量取约150mL的二次蒸馏水于250mL烧杯中用电炉加热煮沸,驱除溶解在水中的氧气,冷却到室温。
(2)然后用电子天平准确称量FeC13·6H2O 2.7036g置于冲洗好的烧杯中,加入100mL煮沸后已冷却到室温的二次蒸馏水,滴入3~4滴稀HCl,再加入准确称量的FeC12·4H2O 1.1376g搅拌溶解后待用。
(3)用量筒量取8mL或稍多一点的25%的氨水置于三颈烧瓶中,打开电动搅拌器,开始时转速调低一点(约800r/m in,驱赶氧气),然后迅速将刚才配制好的混合溶液倒入其中,可以看到马上有亮黑色的沉淀生成。
(4)加完混合液后,将三颈烧瓶塞好,尽量减少空气的进入,并将转速尽量调高(3000r/m in),以保证生成的粒子能够快速得到分散,使其粒径更小。35℃条件下,反应约60m in,即得活性粒子Fe3O4。
水基磁流体的制备
(1)准确称取0.0202g的L-谷氨酸于小烧杯中,加入10mL二次蒸馏水,用玻璃棒搅拌使L-谷氨酸完全溶解在水中,待用。
(2)将制得的Fe3O4活性粒子倒入250mL的烧杯中,加入100mL二次蒸馏水洗涤,将烧杯置于磁铁上帮助吸降。同时将水温升到500C。
(3)待粒子沉降后,连着磁铁一起倾泻倒出上层水液。重复水洗3至4次洗去液相中的过多的NH3·H2O。洗涤过程尽量要快。
(4)然后加入30mL二次蒸馏水,马上进行超声波分散。分散过程中并用玻璃棒不停搅拌,将上述制备好的L-谷氨酸溶液倒入,并用二次蒸馏水调节溶液的体积约为50mL,一边搅拌一边用稀盐酸调pH值为1~2,超声波分散约15分钟。
(5)然后加入到三颈烧瓶中,打开搅拌器,将转速尽量调高(3000r/m in),50℃进行包覆60 m in,即得由L-谷氨酸包覆的水基磁流体。
包覆完成后将产物倒入烧杯中,超声波分散30m in,即得稳定均匀的水基磁流体。最后,把黑亮色的产品倒进试剂瓶保存。
5.不同实验条件对结果的影响及分析 在查阅了大量资料后[3],本实验中经过实验实践,最终选取反应液的起始浓度为0.15mol/L,采用氨水作为沉淀剂,在35℃下制得的Fe3O4粒子磁性和稳定性是最好的,并取得较好的效果。在查阅大量文献之后,结合本实验的情况本人主要在L-谷氨酸用量的确定、包覆温度和时间的确定、搅拌速度的确定和pH值的影响这些方面进行讨论,具体如下:
(1)pH值 溶液在反应过程中必需处于碱性条件下才能生成磁性粒子Fe3O4。参考前人的经验以及本人实验证明,反应过程中溶液pH≤8,磁性粒子Fe3O4生成少,产物磁性极弱;pH≥11,溶液体系反应速度过快,生成的磁性粒子粒径大,导致稳定性下降;pH=9~11,磁性粒子的分散性很好,磁性强。因此,在制备磁性粒子Fe3O4时,应控制体系的pH=9~11。
L-谷氨酸分子中含有两个酸性的羧基和一个碱性的氨基,是一个既有酸性基因,又有碱性基因的两性电解质,与酸或碱作用都可以生成盐。由于羧基离解力大于氨基,所以L-谷氨酸是一种酸性氨基酸。L-谷氨酸溶解于水后,呈离子状态存在,其解离方式取决于溶液的pH值,在酸性介质中,α—羧基的解离受到抑制,L-谷氨酸主要以阳离子(GA+)状态存在,带正电荷,形成双电层;由双电层稳定理论可知,胶体表面电荷越多,胶体之间的排斥力就越大,胶体就越稳定,颗粒沉降的速度就越慢。在pH=1~6的溶液中,胶体表面电荷随着pH的升高而降低,则磁流体的稳定性随着pH的升高而降低[1]。而且L-谷氨酸在不同的pH值溶液中有不同的溶解度,L-谷氨酸在pH=1.0附近或碱性情况下,溶解度很高。
对于水基磁液,pH值对磁液稳定性的影响是显著的。pH值过高(>12)会造成离子强度太高,不利于表面活性剂的包覆,而且容易导致粒子在包裹过程中被氧化而变为红棕色[4]。 pH值调整为何值最理想,与使用的表面活性剂有关。实验表明:使用L-谷氨酸作包覆剂,在最佳pH值=1~2的条件下,可以获得稳定性好的磁流体。如表1:
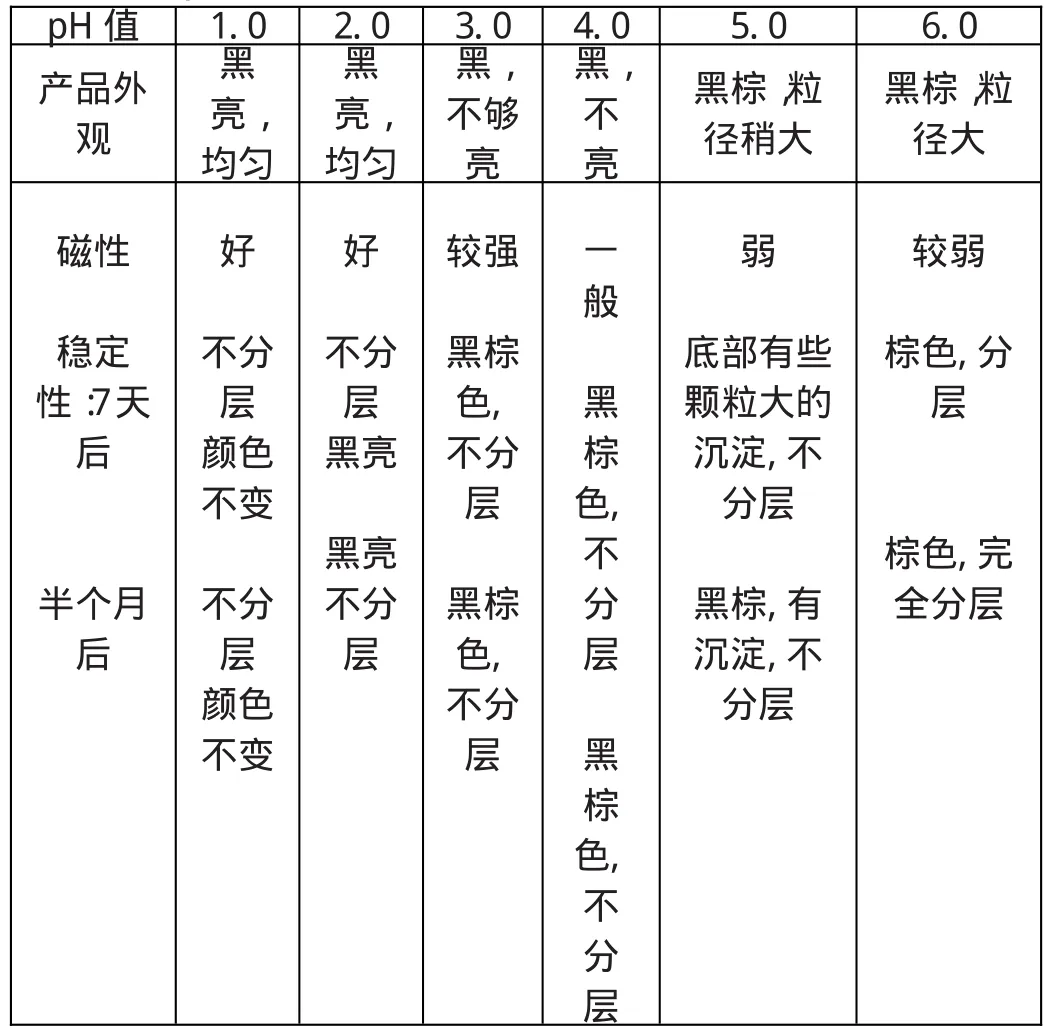
表1 pH值对产物的影响
(2)包覆剂的用量 一种好的磁流体,磁性粒子在基液中应具有所要求的浓度并是稳定的胶态体系,在制备磁流体时使用的包覆剂(分散剂)是影响的重要因素。磁性Fe3O4微粒必须借助包覆剂才能均匀地分散在水相中。
包覆剂的分散作用可以克服范德华力所造成的颗粒凝聚、削弱静磁吸引力、改变磁性颗粒表面的性质、使颗粒和基液浑成一体、同时还可以防止磁性颗粒的氧化[5]。 加入L-谷氨酸后,L-谷氨酸以氢键或配位键的形式缠绕在Fe3O4表面,形成一层保护膜,阻止了纳米粒子的团聚,同时,由于空间位阻效应和有机基团之间的相互斥力,克服了纳米Fe3O4粒子的自身重力和相互之间的磁力吸引,使之能稳定分散于基液中,提高磁流体的分散性和稳定性[6]。因此,包覆剂对磁性微球在载液中的悬浮稳定性起着至关重要的作用,其用量的把握是一个关键。
当包覆剂的剂量较少,不足以完全覆盖所有磁性粒子,或磁微粒包覆剂包覆层较薄时,包覆剂间产生的斥力不足以克服磁引力和范德华力的作用而发生磁颗粒团聚,会使磁颗粒变大。若包覆剂用量过多,在磁性微粒表面形成多层包覆,同时表面活性剂的长链互相交织在一起,从而又使颗粒粘结在一起而变大,并降低了磁性颗粒的稳定性和导致磁性能下降[7]。如表2所示,为了获得高稳定性和强磁性能的磁流体,工艺条件不变、基液一定的情况下,仅改变L-谷氨酸的用量,包覆剂的最佳用量控制为0.0200g/50mL。
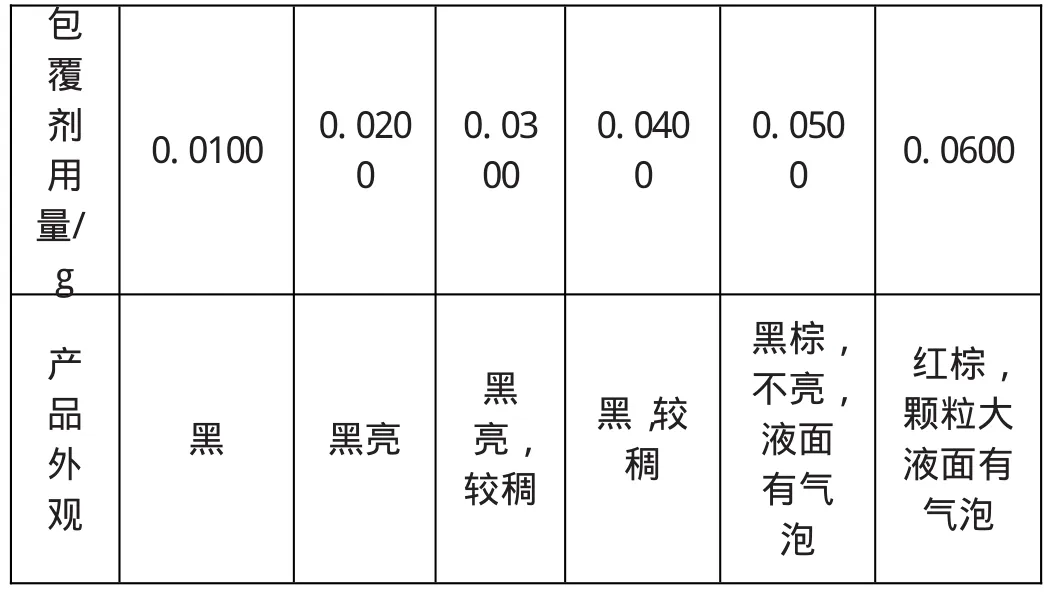
表2 L-谷氨酸用量对产物的影响
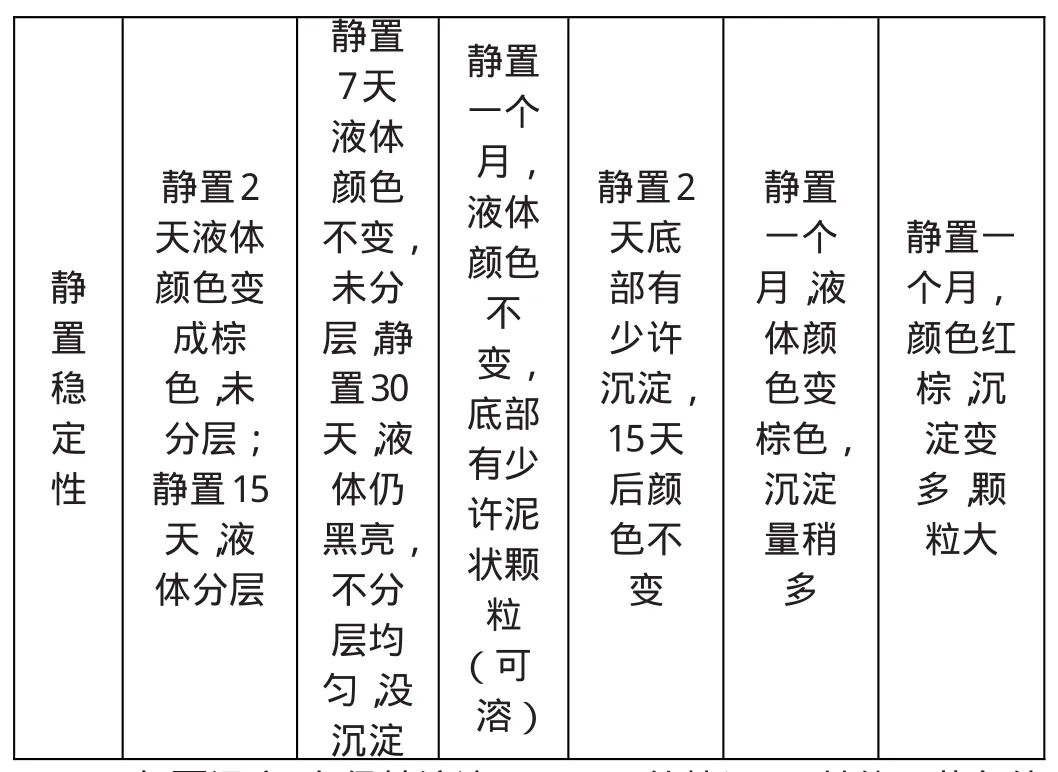
静置稳定性静置2天液体颜色变成棕色,未分层;静置15天,液体分层静置7天液体颜色不变,未分层;静置30天,液体仍黑亮,不分层均匀,没沉淀静置一个月,液体颜色不变,底部有少许泥状颗粒(可溶)静置2天底部有少许沉淀,15天后颜色不变静置一个月,液体颜色变棕色,沉淀量稍多静置一个月,颜色红棕,沉淀变多,颗粒大
(3)包覆温度 在保持溶液pH=1-2的情况下,其他工艺条件不变的情况下,对于制备用L-谷氨酸作包覆剂的水基磁流体,本人经过多次实验表明:L-谷氨酸包覆磁性粒子的最佳温度是50℃,在此温度下,其包覆量达到最大值,包覆得最完全,而且磁性粒子粒径小,磁性高,稳定性好;如表3所示:
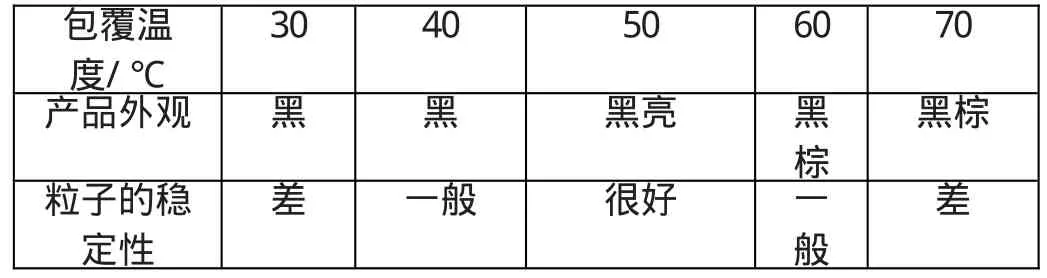
表3 包裹温度对产物的影响
(4)包覆时间 根据文献[8],一个表面活性剂分子通过溶剂化层和离子吸附层的扩散、渗透、取代、吸附进而牢固结合的过程,需要一定的时间才能形成牢固的表面活性剂包覆层。本实验在密封的条件下,从不同时间和搅拌速度进行探讨:
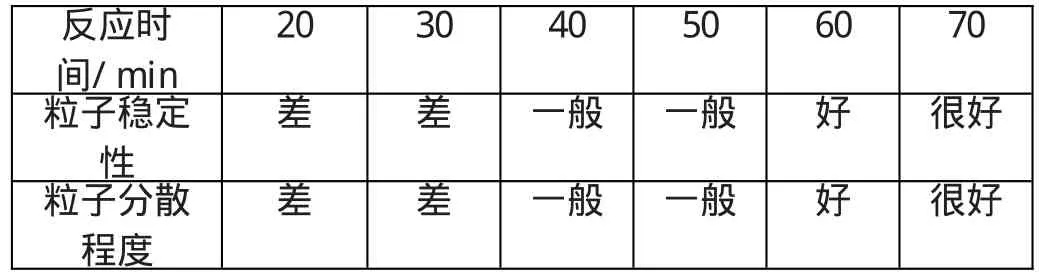
表4 反应时间的影响
表4结果表明,当包覆时间足够长,搅拌足够充分,所制得的粒子越难沉降,经过表面处理后,粒子的稳定性越高。这是因为包覆时间保证了搅拌时间足够长,使螯合反应得以完全,反应过程形成的粒子团聚得到充分的打散,粒子变得越小,分散性越好。如果反应时间太短,就如表4所示,反应不完全,粒子的稳定性很差,分散性也不好。虽然包覆时间足够长会更好,根据实验室实际情况和为了节约时间和资源,包覆进行60m in已经足够生成稳定性好分散程度好的磁流体。
(5)搅拌速度 在包覆剂包裹过程中,搅拌速度对磁性颗粒有着重要影响。本实验中所用的搅拌器从起动到最大速,转速从0到3000 r/m in,共分六等分,每格是500r/m in。本实验在密封的条件下,探讨了搅拌速度对产物的影响,(固定其它因素),具体见表5。
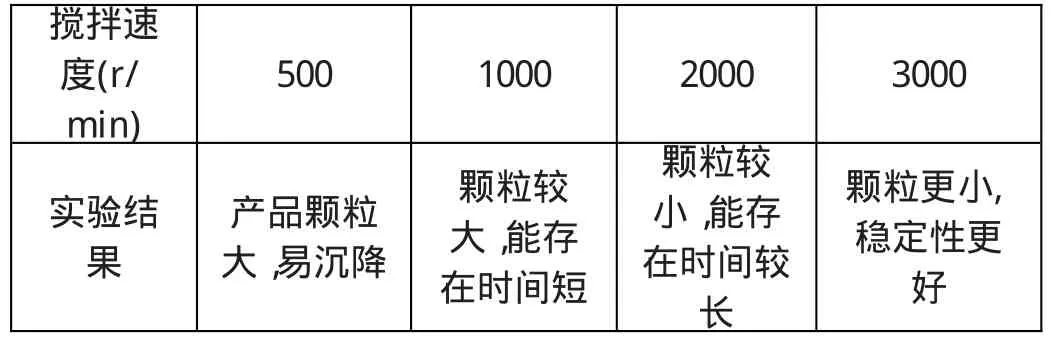
表5 搅拌速度对产物的影响
如果不搅拌,磁性颗粒会凝结成团状,导致包裹无法继续进行;搅拌速度过慢,制得的磁性颗粒粒径大,包裹不均匀,不能使生成的颗粒得到及时的分散,最终会生成沉淀聚沉下来。由试验表明:本人选择在最大搅拌速度(3000r/m in)下进行反应和包覆,所制的磁流体效果最好。
(6)超声波分散对产物的影响 利用超声波溶解技术对产品分散,是加速试样溶解的一种物理方法。一般适宜在室温溶解样品,根据需要调节功率和频率,使之产生振荡,可使试样粉碎变小。
超声波分散的原理是其所产生的瞬态高温效应、空化效应在很小的范围内形成高达数千大气压的压力从而可以在固体或液体内部产生巨大的粉碎作用[5]。机械搅拌分散不能替代超声波分散,机械搅拌是长程力的分散,适用于均匀混合和打开较大的团聚体。而超声波是把小的团聚体打开,是一种短程力的分散,适用于打开较小的团聚体(纳米级)。磁性微球的粒径处于纳米级别,具有巨大的表面自由能,吸附能力强,团聚趋势大。虽然在反应过程中有强力搅拌防止其团聚长大,但是这个作用并不完全。另一方面,粒子在洗涤过程中采用磁铁来帮助吸降,更加容易造成粒子的团聚。在开始时团聚属于软团聚,需要马上将其分散,以防止进一步变成硬团聚。所以在洗涤、包覆完成后应马上进行超声波分散,分散过程中并用玻璃棒搅拌,可以达到更好的分散效果。表6可以说明超声波分散的作用。

表6 超声波分散对产物的影响
小结 以上各条件若控制得好,可以得到高质量的用L-谷氨酸包覆的水基磁流体。下面是本人总结前人的经验和通过多次实验得出的结果,总结出制备用L-谷氨酸包覆四氧化三铁水基磁流体的最佳制备工艺条件,具体如下:
1.反应物Fe3+/Fe2+(物质的量)之比在1.70~1.75之间;
2.以25%NH3·H2O作为沉淀剂,沉淀剂应过量20~30%,这样制出的粒子磁性较好;
3.在35℃条件下制备磁性粒子,溶液pH=9~11;
4.以L-谷氨酸作为包覆剂,L-谷氨酸的最佳用量是每50mL反应液0.0200g;
5.用L-谷氨酸包覆时的最佳温度为50℃,包覆时间为60m in;
6.用L-谷氨酸包覆时的最佳pH=1.0~2.0;
7.反应阶段和包覆阶段搅拌速度都应该尽量调高(3000r/m in);
8.在洗涤和包覆粒子之后应马上进行超声波分散。
[1]熊隆荣,文玉华,易成,等.聚乙二醇-4000包覆Fe3O4磁流体的制备及稳定性研究[J].材料导报,2007,21(8):195-197.
[2]高道江,赖欣,王建华.磁性流体制备技术的现状与展望[J].磁性材料及器件,1997,29(2):20-23.
[3]张银燕,王遵义,等.纳米磁性液体的制备和影响因素研究[J].湖南文理学院学报(自然科学版).2004,16(2):23-26.
[4]苑星海,林穗云.二次包裹Fe3O4磁性流体的制备与表征[J].广州化工,2007,35(3):41-43.
[5]陈晓青,张俊山等.双层表面活性剂分散制备水基磁流体[J].无机化学学报,2005,16(5):549-552.
[6]杨瑞成,郧栋,穆元春.纳米Fe3O4磁流体的制备及表征[J].兰州理工大学学报,2008,34(1):22-25.
[7]赵静,刘勇健.磁流体制备中表面活性剂的选择及其包裹条件的影响[J].应用化工,2008,37(2):198-217.
[8]张金升,尹衍,张银燕,马来鹏,等.均匀超细Fe3O4磁流体的研究[J].应用进展,2003,22(5):494-498.
[9]张金升.磁性流体中纳米Fe3O4包覆结构的研究[J].中国学报,2003,33(7):611-613.
