感染对糖尿病大鼠病理状态的影响*
2014-02-27王彦江谢席胜冯胜刚龙琼先
王彦江,谢席胜,冯胜刚,龙琼先
(川北医学院第二临床医学院·南充市中心医院 1.肾内科,2.病理科,四川 南充637000)
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病(diabetes mellitus,DM)最常见的微血管并发症之一。然而其发病机制至今仍未完全阐明。因此,建立理想的DM实验动物模型是研究DKD发病及防治机制的重要手段。我们在实验中发现,DM大鼠常常发生感染,并且DM模型大鼠的肾脏病变在剔除感染前后存在差异,现将我们的研究报告如下。
1 实验材料
1.1 实验动物 清洁级雄性SD大鼠100只,8周龄,体重(200±20)g,购自川北医学院实验动物中心,生产许可证号为SCXK(川)2008-1B。适应性饲养1w后进行实验,12h昼夜交替,自由进水进食。动物室温度控制在21℃~25℃,湿度控制在65%~69%。
1.2 实验试剂 广衡电子计重秤(广衡电子衡器有限公司生产),编号:粤制00000547,由川北医学院实验动物中心提供;大鼠代谢笼(北京莱尔净化设备有限公司);链脲佐菌素(streptozotocin,STZ)(Sigma公司,美国),规格:1g/瓶(灭菌装),2~8℃保存,购自北京市博爱港商贸有限公司;柠檬酸、柠檬酸钠,购自北京市博爱港商贸有限公司;三诺安稳血糖仪以及三诺安慰血糖试纸(长沙三诺生物传感技术股份有限公司);75%消毒酒精;高尔宝目测尿糖试纸(广州市花都高尔宝生物技术有限公司);肌酐试剂盒、尿素氮试剂盒(上海科华生物工程股份有限公司);HITACHI全自动生化分析仪(日立仪器(苏州)有限公司):仪器型号:7600-010,由南充市中心医院提供。全自动尿液干化学分析仪(日本京都),仪器型号:AX-4280由南充市中心医院提供。HM315轮转式石蜡切片机(广州市炳阳生物科技有限公司):型号:HM315,由南充市中心医院病理科提供;BMJ-A型包埋机及病理组织包埋冷却台(常州市中威电子仪器有限公司):型号:BMJ-A型,由南充市中心医院病理科提供。
2 实验与统计方法
2.1 实验分组及造模 雄性SD大鼠100只,随机分为正常对照组(10只)和实验组(90只)。适应性喂养1周后,造模前将大鼠禁食 12h[2],将 STZ 用 0.01mmol/L、PH为4.5的柠檬酸钠缓冲液配成1%的浓度,以65mg/kg体质量行一次性腹腔注射[1],正常对照组则注射等量的柠檬酸盐缓冲液腹腔注射。DM造模标准[2]:72小时后检测空腹血糖(fasting blood glucose,FBG),以FBG≥16.7mmol的大鼠视为造模成功。根据造模标准,从实验组筛选出DM模型大鼠。通过对肾脏、肺脏的解剖发现以及小便常规是否存在着尿路感染等指标判定大鼠是否有感染的发生。以此,在随后的实验研究中,将感染大鼠排除在外。
2.2 指标检测及方法
2.2.1 一般情况 观察各组大鼠的一般状况,如进食、饮水量、小便量,色以及气味等。
2.2.2 生化指标检测 采用血糖仪及配套血糖试纸进行血糖监测,检测前禁食8小时,各组大鼠经剪尾尖放血法检测FPG;采用肌氨酸氧化酶法和紫外-谷氨酸脱氢酶法检测分别测定血清肌酐及尿素氮指标;采用尿糖试纸对尿糖水平进行半定量检测;实验结束前24小时,将大鼠放入代谢笼中,收集各组大鼠尿液,记录尿量并送至我院检验科做尿常规及24小时尿蛋白定量检测。
2.2.3 肾脏肥大指数(kidney hypertrophy index,KHI) 全部大鼠摘取左肾,用分析天平称重,计算KHI,KHI=[肾重(g)/体重(g)]×1000‰。
2.2.4 普通光学显微镜观察 采用3%的戊巴比妥钠,按0.1ml/100g体质量腹腔注射麻醉后,处死大鼠。收取各组大鼠的肾脏及肺脏标本,将肾脏称重后去除包膜。此时,将肺脏以及去除包膜的肾脏浸泡于10%中性甲醛溶液,固定12小时,作常规石蜡包埋组织块,5μm超薄切片,肾脏、肺脏行HE染色,光镜下观察肾脏、肺脏的病理改变。每张片子随机选取20个肾小球,每个肾小球按标准计分,然后取20个记分的均值作为该片肾小球系膜增生分级数。0级:正常肾小球(记0分);Ⅰ 级:增生的系膜组织对肾小球毛细血管袢无明显影响,系膜增生宽度小于毛细血管直径,呈节段性分布(记2分);Ⅱ级:增生的系膜组织对肾小球毛细血管袢有一定的压迫和破坏作用,系膜增生宽度大于毛细血管直径,呈弥漫性分布(记4分);Ⅲ级:增生的系膜组织对肾小球毛细血袢有一定的压迫和破坏作用,系膜增生呈结节状或团块状,弥漫性分布且阶段性加重[3]。采用 WinROOF图像处理软件(MitaniCorp.)评估小管间质的损害程度[4],每张切片选取10个视野,计算皮质部每一视野中小管扩张、间质浸润以及纤维化区域所占的百分率。得分情况为0~5分:0,正常间质;1,<10%的区域损伤;2,11%~25%的区域损伤;3,26%~50%的区域损伤;51%~75%的区域损伤;>76%的区域损伤。
2.3 统计方法 采用SPSS 13.0统计软件进行统计分析处理,计量资料以表示,两组之间的均值比较采用t检验;以P<0.05,认为差异具有统计学意义。
3 结果
3.1 各组大鼠一般情况 腹腔注射STZ诱导后,正常对照组大鼠精神状态良好,活动自如,反应灵敏,毛色光滑;DM组大鼠毛色粗糙,精神较差,反应较迟钝,活动差,脊柱呈弓背样弯曲。并且,DM组大鼠尿液的泡沫较多,酸臭味更加明显。正常对照组大鼠无感染的发生,DM组大鼠感染的发生率为35.7%,并且DM组大鼠常常合并多种感染发生,其中有2只为尿路感染合并肾脓肿及肺部感染,有3只为单纯性尿路感染,有6只为单纯性肾脓肿,有1只为单纯性肺部感染。DM模型中感染大鼠的死亡率为80%。如图1所示,正常对照组大鼠的肺泡结构正常,肺泡上皮细胞及毛细血管内皮细胞基底膜分布正常,毛细血管腔开放,肺间质无炎症细胞浸润。发生肺部感染的DM大鼠的肺脏表现为严重的肺水肿,病理表现为肺泡上皮细胞及毛细血管内皮细胞基底膜明显增厚,肺泡间隔增宽,间质中胶原和弹性蛋白含量增多,部分肺泡腔萎缩甚至塌陷,部分肺泡腔内有多量炎症细胞浸润,并可见片状坏死。发生尿路感染大鼠的尿常规表现为较高的红细胞及白细胞水平,肾脏病理中可见大量的炎症细胞中浸润,脓肿及坏死形成等。解剖时也发现,发生尿路感染的大鼠肾脏与周围组织界限模糊,有脓腔存在等。与正常对照组相比,DM组大鼠的进食量、尿量以及饮水量均显著增加;然而,与剔除感染前相比,剔除后的DM组大鼠的进食量较高,差异具有统计学意义(P<0.05),结果见表1。
3.2 各组大鼠血糖情况 与正常对照组相比,DM组大鼠的FPG水平显著升高,具有统计学差异(P<0.05);与剔除感染前相比,剔除后DM组大鼠的FPG水平稍低,但不具有统计学差异(P>0.05),见表2。
3.3 各组大鼠体重、肾功情况 与正常对照组相比,DM组大鼠的体重水平较低,而KHI较高,差异具有统计学意义(P<0.05);与剔除感染前组相比,剔除感染后DM组大鼠的KHI较低,具有统计学差异。与正常对照组相比,DM组大鼠的肌酐和尿素氮水平均较高,差异具有统计学意义(P<0.05);与剔除感染前组相比,剔除感染后DM组大鼠的肌酐及尿素氮水平较低,差异具有统计学意义(P<0.05),结果详见图2。

表1 剔除感染前后各组大鼠的一般情况Table 1 General situation of rats of all groups before and after the removal of infection

图1 各组大鼠的肺脏及病理Figure 1 Lungs and pathology of rats of groups
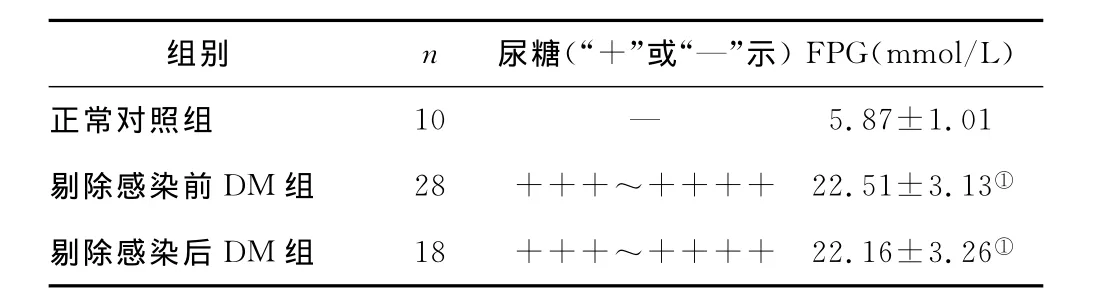
表2 剔除感染前后各组大鼠的FPG及尿糖水平Table 2 Level of FPG and urinary glucose in rats of all groups before and after the removal of infection
3.4 各组大鼠尿常规及24小时尿蛋白定量 与对照组相比,DM组大鼠尿常规中的红细胞、白细胞水平以及24小时尿蛋白定量均显著增高,具有统计学差异(P<0.05);与剔除感染前组相比,剔除感染后DM组大鼠尿常规中的红细胞、白细胞水平较低,差异具有统计学意义(P<0.05)。与剔除感染前相比,剔除感染后DM组大鼠24小时尿蛋白定量水平较低,但不具有统计学意义(P>0.05),结果见表3。

图2 A 剔除感染前后各组大鼠的体重及KHI水平Figure 2A Level of Weight and KHI in rats of all groups before and after the removal of infection

图2 B 剔除感染前后各组大鼠的肾功水平Figure 2B Level of renal function in rats of all groups before and after the removal of infection

表3 剔除感染前后各组大鼠的尿常规及24小时尿蛋白定量情况Table 3 Urine routine and 24-hour urinary protein excretion in rats of all groups before and after the removal of infection
3.5 各组大鼠的肾脏病理情况 解剖时发现正常对照组及DM非感染大鼠的肾脏与周围组织的解剖层次结构清晰,易于分离。DM感染大鼠的肾脏体积明显增大,肾脏与周围组织广泛粘连,表面凹凸不平,呈颗粒状,切开时发现肾脏上下极常存在单个或多个脓腔,内含乳白色液体,见图3。正常对照组的肾组织病理未见明显病变;DM非感染大鼠肾病理:系膜基质轻度增生,可见少许肾小管上皮细胞空泡变性;然而,同期的DM感染大鼠肾病理表现为系膜基质中度增生,Cap袢开放尚可,肾小管上皮细胞空泡变性及坏死,间质内可见大量淋巴细胞、中性粒细胞浸润,伴出血坏死以及脓肿形成(图4)。与正常对照组相比,DM组大鼠肾脏的系膜增生程度以及小管间质损害程度均较高,具有统计学差异(P<0.05)。同时,与剔除感染前组相比,剔除感染后DM组大鼠的肾脏系膜增生程度评分以及小管间质损害程度评分均较低,差异具有统计学意义(P<0.05),结果见表4。
4 讨论
DM患者由于存在血糖升高、蛋白质代谢紊乱、免疫功能低下以及机体抵抗力降低等诸多因素,因此DM患者极易发生各种感染。DM合并感染的发生率为32.7%~90.5%[5],其中泌尿系统感染占36.1%,呼吸系统感染占24.6%,其次为皮肤及软组织感染,

表4 剔除感染前后各组大鼠肾脏的病理评分Table 4 Renal pathological score of rats of all groups before and after the removal of infection
胃肠道及其他感染等[6]。在我们的研究中,DM组大鼠感染的发生率为35.7%,并且DM组大鼠常常合并多种感染发生,其中有2只为尿路感染合并肾脓肿及肺部感染,有3只为单纯性尿路感染,有6只为单纯性肾脓肿,有1只为单纯性肺部感染,而正常对照组则无感染的发生。DM模型中感染大鼠的死亡率为80%。发生肺脏感染的大鼠表现为肺脏的极度水肿,肺病理也表现为大量的炎症细胞浸润、脓肿及坏死形成等。发生尿路感染的大鼠表现,尿常规表现红细胞及白细胞计数的增加,解剖结果发现肾脏存在弥漫性的水肿和大量脓腔。同时,病理结果也证实感染大鼠肾脏组织中存在严重的炎症细胞浸润以及坏死脓肿形成等。
5 结论
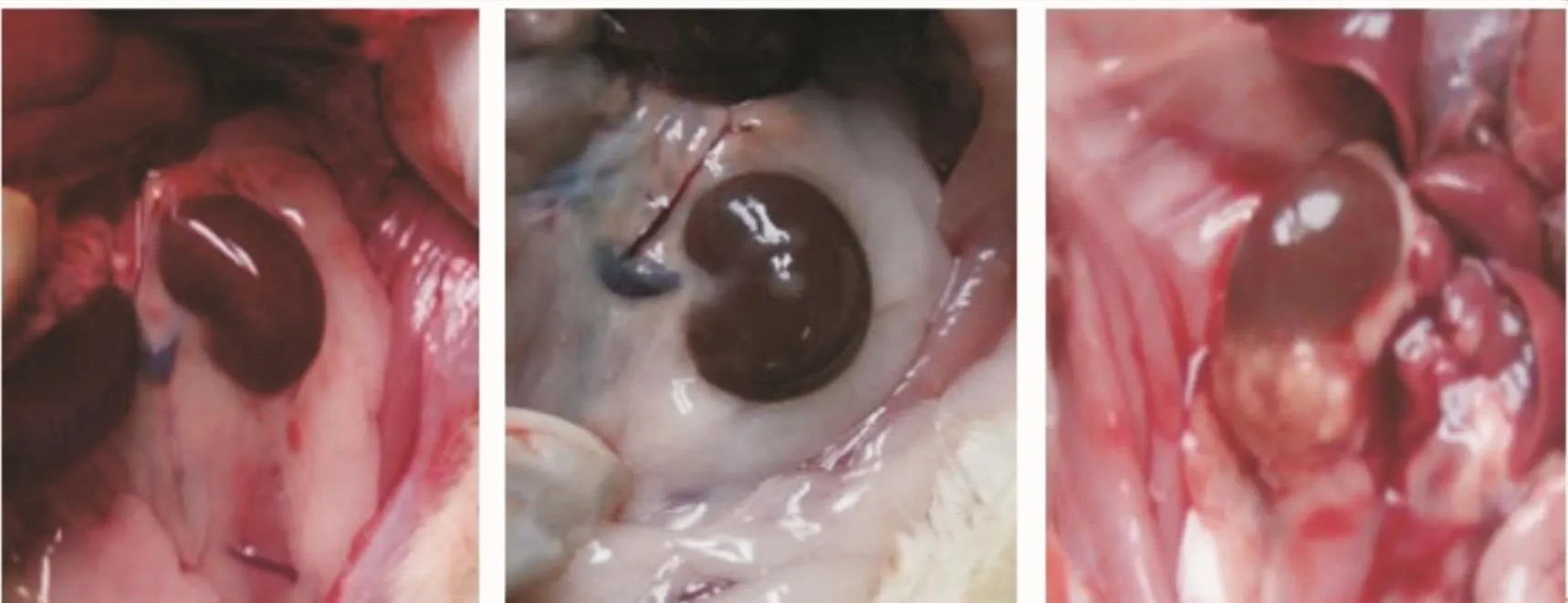
图3 各组大鼠肾脏外观Figure 3 Kidney appearance of rats of all groups
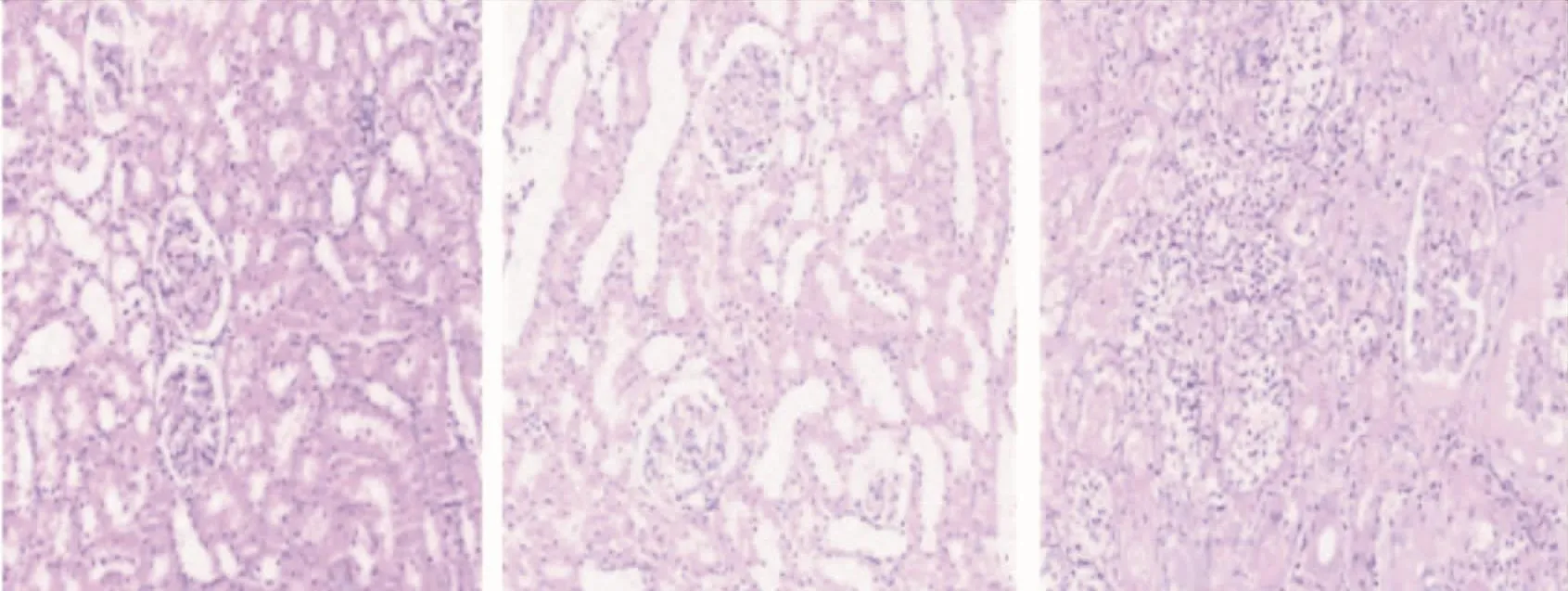
图4 各组大鼠肾脏病理Figure 4 Renal pathology of rats of all groups
我们的研究发现,剔除感染后DM组大鼠的进食量明显增加,而在KHI、肌酐及尿素氮水平、尿常规中的红细胞及白细胞方面以及肾脏系膜增生程度评分和小管间质损害程度评分方面均降低。并且,剔除感染后,DM组大鼠的24小时尿蛋白定量方面有所降低。DM大鼠与人类糖尿病一样同样容易发生感染,且感染部位以肾脏、尿路和肺部为主。DM足病患者尿蛋白的排泄量随着足部感染程度的加重而增多[7]。在慢性乙肝病毒感染及人免疫缺陷病毒感染患者中,活动性炎症可引起并加重尿蛋白排泄,同时适度控制感染会减少尿蛋白排泄[8]。由此推测,感染可能是加重肾病进展的一个重要危险因素。
[1] Sarabeth Graham,Yves Gorin,Hanna E,etal.Abundance of TRPC6protein in glomerular mesangial cells is decreased by ROS and PKC in diabetes[J].Am J Physiol Cell Physiol,2011,301:C304-C315.
[2] YANG Yu-xi,HUANG Song-min,YAN Xiao-yong,etal.Re-lationship Between Activation of Mannan-binding Lectin Complement and NF-kB in diabetic Nephrology[J].J Sichuan Univ(Med sci Edi),2011,42(4):490-493.
[3] 杨俏玲,何兰杰,李红兵,等.罗格列酮对糖尿病大鼠肾脏病理的影响及其机制探讨[J].宁夏医学院学报,2007,29(4):347-349.
[4] Yoshihiro Kuno,Masayuki Iyoda,Takanori Shibata,etal.Sildenafil,aphosphodiesterase type 5inhibitor,attenuates diabetic nephropathy in non-insulin-dependent Otsuka Long-Evans Tokushima Fatty rats[J].British Journal of Pharmacology,2011,162 1389-1400.
[5] 王清泉.糖尿病合并肺感染研究进展[J].现代中西医结合杂志,2007,16(32):4901-4902.
[6] 王晓黎,张 锦.糖尿病合并感染及其高危因素分析[J].中国微生态学杂志,2012,24(3):257-258.
[7] 刘 宏,张杉杉,顾雪明,等.糖尿病足病尿蛋白排泄及其与感染程度关系研究[J].中国实用内科杂志,2012,32(10):779-782.
[8] Kilic M,Taskin E,Sen Y,etal.Microalbuminuria in chronic hepatitis B infection[J].Indian Pediatr,2010,47(6):511-515.
