蛤仔橙色和白色背景壳色的遗传分析及杂种优势的研究
2014-02-17梁健董克逊闫喜武霍忠明吴云霞杨凤
梁健,董克逊,闫喜武,霍忠明,吴云霞,杨凤
(大连海洋大学水产与生命学院辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
在遗传学上,杂交 (hybridization)是指基因型不同的个体之间进行的交配。而在分子生物学上,把两条单链DNA或RNA的碱基配对称为杂交。一般情况下,两个近交系间的杂交会产生遗传上相同的后代,这些后代的有害基因座大多处于杂合状态,这样便会产生具有杂交活力的子一代,即表现出杂种优势[1]。杂交是育种工作的重要手段,目前在农作物 (水稻[2]、玉米[3]、小麦[4]、大豆[5])及陆生家禽类 (猪[6]、牛[7]、羊[8])中得到广泛应用。在水产动植物(鱼[9]、虾[10]、藻[11]、参[12])的品种改良和生产中也发挥了重要的作用,并取得了一定效果。近些年来,海洋双壳类贝壳颜色的多态现象得到了一些学者的重视并有一些相关报道[13-14]。蛤仔贝壳的壳面颜色变化各异,闫喜武等[15-16]、霍忠明等[17]对不同壳色品系的蛤仔进行了研究,发现其生长和存活存在一定的差异,而这种差异主要来源于遗传差异,这为不同壳色蛤仔间的杂交奠定了基础。本研究中,利用海洋橙和珍珠白两个蛤仔Ruditapes philippinarum品系为材料,开展了2×2的双列杂交试验,通过对不同壳色蛤仔间杂种优势的计算,准确地评估杂交效果,统计杂交后代的壳色分离比,进而分析壳色遗传机制,旨在为蛤仔种质的改良、新品种的培育提供理论基础。
1 材料与方法
1.1 材料
试验亲贝均为2龄的海洋橙品系第四代和珍珠白品系第五代蛤仔。海洋橙品系抗逆性强,壳面呈橙色,其表面有4条深色的不连续状放射条带;而珍珠白品系壳面呈白色,其左壳的背部有一条深色放射条带,但右壳表面无任何花纹或条带。2012年4月将两品系试验亲贝装入20目网袋 (40 cm×60 cm)中,在庄河贝类苗种场促熟,促熟期间,水温为11~24℃,盐度为26~29,pH为7.65~8.65。
1.2 方法
1.2.1 试验设计 于2012年7月,取性腺成熟的亲贝放于室内,将其阴干8 h,将阴干后的亲贝进行1 h的流水刺激,随后放入新鲜海水中,亲贝于3 h后逐渐产卵排精。挑出上述亲贝,其表面的精卵用淡水清洗干净后,放入塑料桶中,桶内装有1.0 L新鲜海水,10~15 min时亲贝开始产卵排精。收集橙色品系 (O)3个雌性个体的卵子于一个小桶中,3个雄性个体的精子于另一个小桶中。同样收集珍珠白品系 (W)的卵子、精子。采用2×2双列杂交的方式建立4个试验组 (表1),每个试验组均设2个平行。

表1 2×2双列杂交试验设计Tab.1 Design of 2×2 diallel cross experiment for Manila clam with various shell colors
1.2.2 幼虫及稚贝的培育 幼虫培育期间,水温为24~29 ℃,盐度为26~28,pH 为 7.68~8.62。每两天换水一次,每次换水为全量换水,换水的筛绢网单独使用以防交叉污染。幼虫期饵料为等鞭金藻Isochrysis galbana,每天投喂两次,投喂量为2500~4500 cells/mL;随着幼虫的生长,幼虫的培育密度由6~8个/mL逐渐减少为2~3个/mL。适当调整密度以保持各个试验组密度基本一致。待幼虫附着后,混合投喂等鞭金藻和小球藻Chlorella vulgaris(体积比为1∶1),投喂量为1×104~2×104cells/mL。
将40日龄的稚贝以每袋500粒分装于80目网袋 (40 cm×60 cm)进行中间育成,并对网袋中的稚贝做好对应的标记。稚贝培育期间,水温为19~25 ℃,盐度为27~29,pH 为7.8~8.4。根据稚贝的壳长更换适合的网袋,通过调整密度使各组密度基本保持一致。
1.3 数据处理
分别测量各试验组 3、6、9、12、15、30、60、90日龄时蛤仔的壳长和存活率。用100倍显微镜测量壳长区间小于300 μm的幼虫或稚贝,用40倍显微镜测量壳长区间为300 μm~2.0 mm的稚贝,用游标卡尺测量壳长大于2.0 mm的稚贝 (精确度为0.01 mm)。每次测量设置3个重复,每个重复随机测量30个幼虫个体。
幼虫存活率为单位体积内幼虫数与D形幼虫数的百分比;稚贝存活率为不同日龄存活稚贝的数量与变态稚贝数的百分比。
将测得的壳长换算成常用对数 (lg x)的形式以减小方差齐性的影响[18],将测得的存活率换算成反正弦函数 (arcsin x)的形式[19]。利用 SPSS 17.0软件对数据进行处理分析,采用单因素方差分析法 (One-way ANOVA)对各试验组数据进行差异性检验,显著性水平设为0.05。
参照郑怀平等[20]对杂种优势的计算,公式如下:
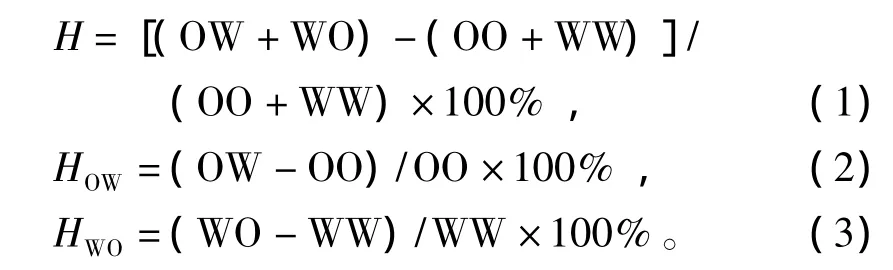
其中:OO、OW、WW、WO分别代表各试验组在相同日龄时的表型值 (壳长、存活);H为中亲杂种优势;HOW、HWO分别为双列杂交中正、反交组的单亲杂种优势。
参照 Cruz等[21]、Zhang 等[22]的方法,采用双因子分析模型检测卵源效应及配对策略对杂交组幼虫表型性状的影响,计算公式为
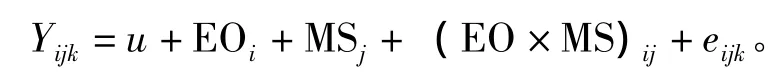
其中:Yijk为k个重复i个卵源j种配对方式下的表型值;u为常数;EOi为表型值的卵源效应 (母本效应);MSj为表型值的配对效应;(EO×MS)ij为卵源与配对策略的交互作用;eijk为随机误差。
2 结果与分析
2.1 浮游期幼虫的杂种优势
浮游期各试验组幼虫的壳长和生长优势见表2。其中WO组的壳长最大,OO组的壳长最小,二者之间有显著性差异 (P<0.05);OW组和WW组幼虫的壳长居中,与其他试验组无显著性差异(P>0.05)。这表明浮游期间,幼虫表现出了一定的中亲生长优势,正反交组的幼虫也表现出了较强的单亲生长优势,其中WO组的单亲生长优势更加明显一些。
浮游期各试验组幼虫的存活率和存活优势见表3。其中WW组的存活率最低,显著低于OO组和OW组 (P<0.05),除9日龄外与WO组无显著性差异 (P>0.05)。在此期间,幼虫存活率表现出一定的中亲存活优势,且WO组表现出一定程度的单亲存活优势,但OW组在3、6日龄时的存活优势为负数,在9日龄时才表现出微弱的单亲存活优势。
卵源 (EO)与配对策略 (MS)对浮游期幼虫生长与存活的方差分析结果见表4。幼虫生长的杂种优势主要受卵源与交配策略交互作用的影响,卵源的影响次之,交配策略的影响最小;幼虫存活的杂种优势主要受卵源的影响,交配策略的影响作用次之,卵源与交配策略交互作用的影响最小。

表2 浮游期各试验组幼虫的壳长和生长优势Tab.2 Shell length and growth heterosis of larvae in each experimental group during the pelagic stage
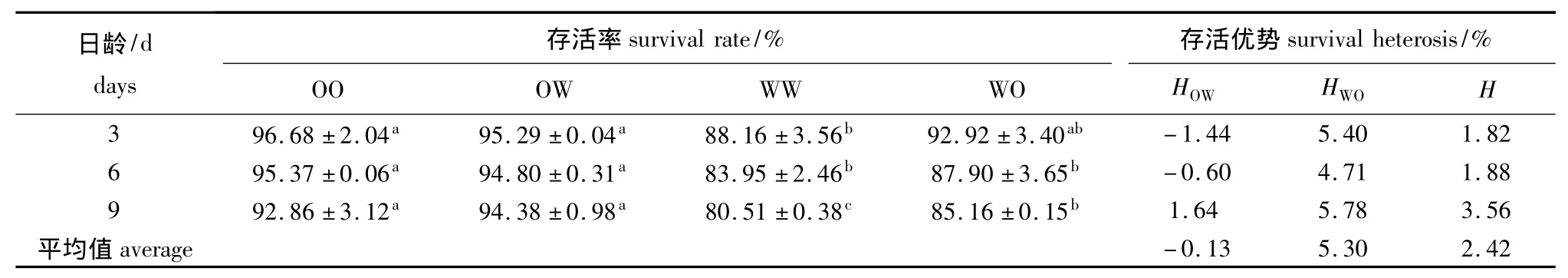
表3 浮游期各试验组幼虫的存活率和存活优势Tab.3 Survival rate and survival heterosis of larvae in each experimental group during the pelagic stage
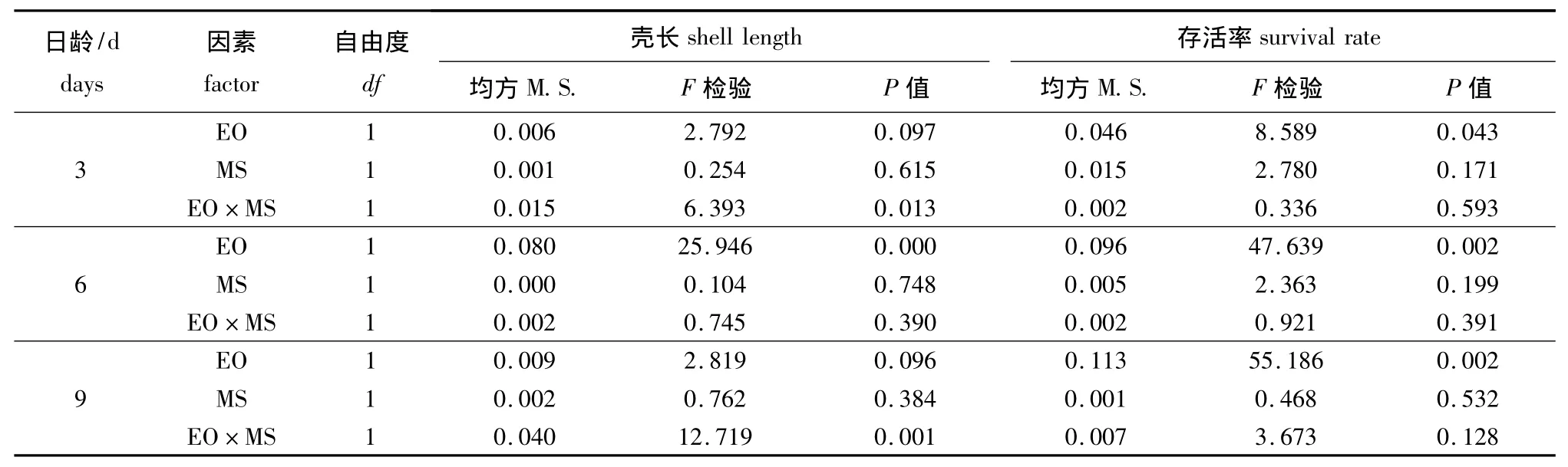
表4 卵源 (EO)与配对策略 (MS)对浮游期幼虫生长与存活率影响的方差分析Tab.4 Variance analysis of egg origin(EO)and mating strategy(MS)effects on shell length and survival during the pelagic stage
2.2 变态期幼虫的生长和存活
变态期各试验组幼虫的壳长和生长优势见表5。其中WO组的壳长最大,显著大于OO组 (P<0.05)。由于幼虫进入变态阶段,各日龄之间的壳长基本没有变化。此期间,幼虫表现出一定程度的中亲生长优势,且正反交组也显现出较强的单亲生长优势。
变态期各试验组幼虫的存活率和存活优势见表6。其中OW组的存活率最高,WW组最低,二者之间有显著性差异 (P<0.05)。幼虫的中亲存活优势和正反交组的单亲存活优势均为正值。
变态期各试验组幼虫的变态时间、变态率和其杂种优势结果见表7。变态时间基本在18 d左右,各试验组的变态率之间并无显著性差异 (P>0.05),但其幼虫变态率的中亲杂种优势和正反交组的单亲杂种优势分别为 10.57%、10.74%、10.41%,表现出较为强烈的杂种优势。
卵源 (EO)与配对策略 (MS)对变态期幼虫生长与存活的方差分析结果见表8。幼虫生长与存活的杂种优势主要影响因素均是卵源效应,其次是卵源与交配策略的交互作用,交配策略几乎未起到任何作用。
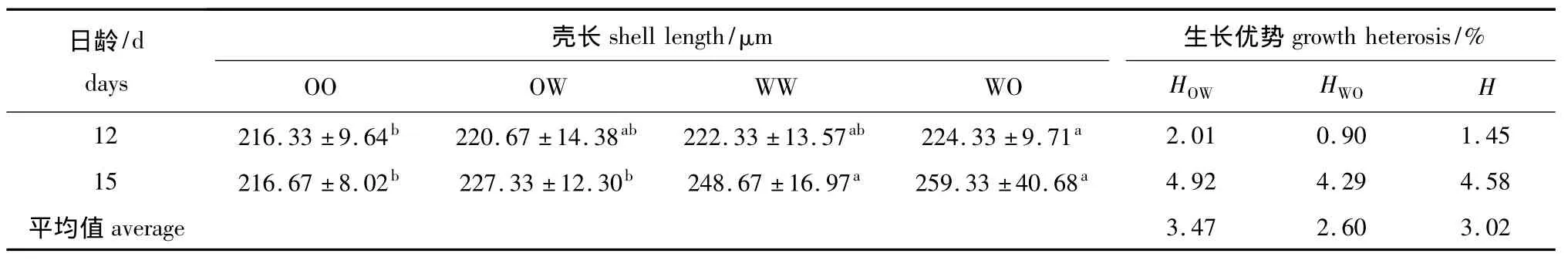
表5 变态期各试验组幼虫的壳长和生长优势Tab.5 Shell length and growth heterosis of larvae in each experimental group during the metamorphic stage

表6 变态期各试验组幼虫的存活率和存活优势Tab.6 Survival rate and survival heterosis of larvae in each experimental group during the metamorphic stage

表7 变态期各试验组幼虫的变态时间、变态率和杂种优势Tab.7 Metamorphic time,metamorphic rate and heterosis of larvae in each experimental group during the metamorphic stage
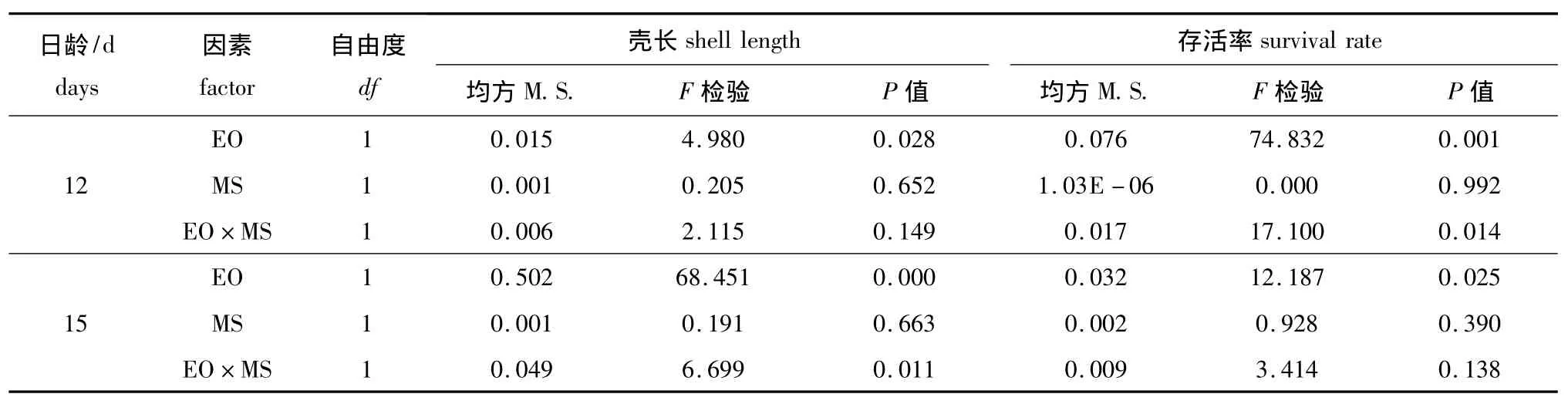
表8 卵源 (EO)与配对策略 (MS)对变态期幼虫生长与存活率影响的方差分析Tab.8 Variance analysis of egg origin(EO)and mating strategy(MS)effects on shell length and survival during the metamorphic stage
2.3 稚贝期稚贝的生长与存活
稚贝期各试验组稚贝的壳长和生长优势见表9。此期间,稚贝表现出一定程度的中亲生长优势,且WO组的单亲生长优势为正值,但OW组并未出现单亲生长优势。稚贝的中亲生长优势和WO组的单亲生长优势随日龄的增加呈下降的趋势。
稚贝期各试验组稚贝的存活率和存活优势见表10。各日龄中存活率最高的依然为OW组,最低的为WW组,二者之间有显著性差异 (P<0.05)。稚贝的中亲存活优势和正反交组的单亲存活优势均为正值。WO组的单亲存活优势最高,平均值为9.07%。
卵源 (EO)与配对策略 (MS)对稚贝期稚贝生长与存活率的方差分析结果见表11。稚贝生长的杂种优势主要影响因素是卵源效应,交配策略是影响稚贝生长的次要因素,卵源和交配策略的交互作用对稚贝生长的影响最小。而稚贝存活率的杂种优势主要影响因素是卵源效应,卵源和交配策略的交互作用为次要因素,交配策略的影响最小。
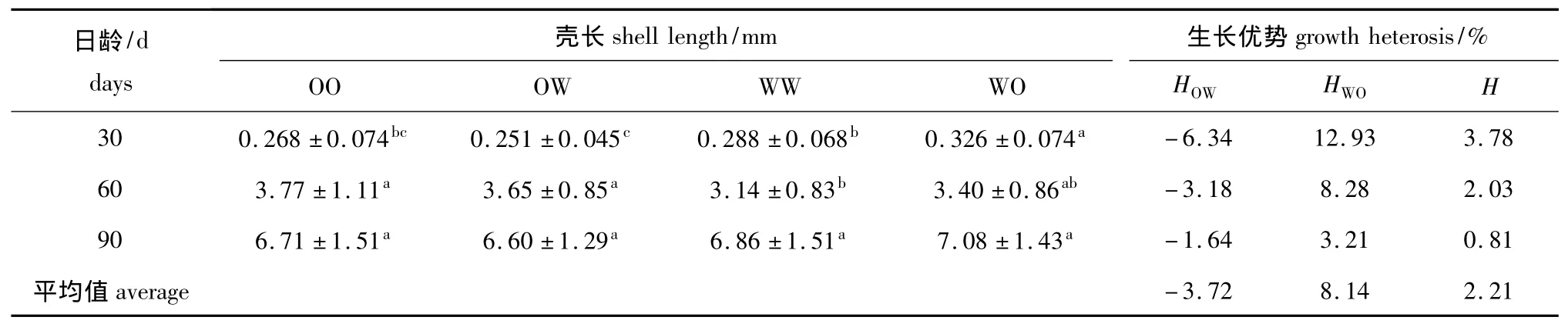
表9 稚贝期各试验组稚贝的壳长和生长优势Tab.9 Shell length and growth heterosis of juveniles in each experimental group during the juvenile stage
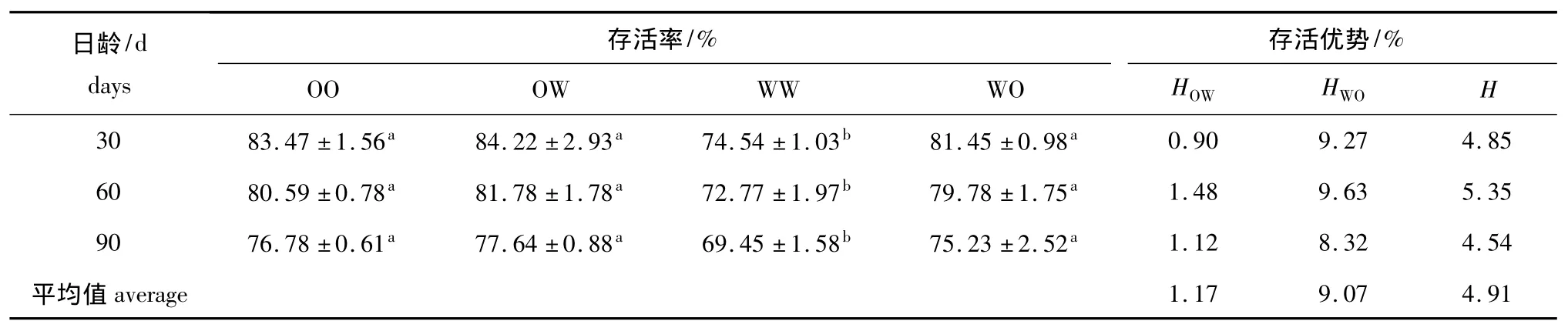
表10 各试验组稚贝期幼虫的存活率和存活优势Tab.10 Survival rate and survival heterosis of juveniles in each experimental group during the juvenile stage
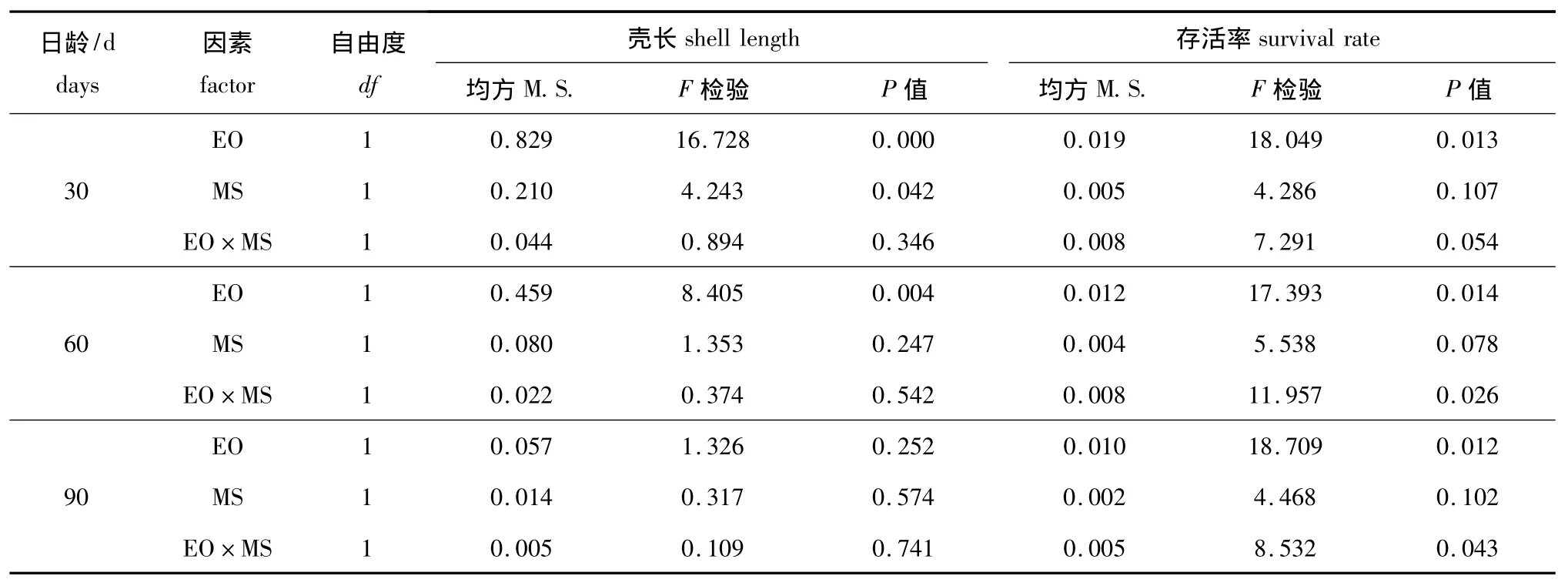
表11 卵源 (EO)与配对策略 (MS)对稚贝期幼虫生长与存活率影响的方差分析Tab.11 Variance analysis of egg origin(EO)and mating strategy(MS)effects on growth and survival during the juvenile stage
2.4 各试验组稚贝的壳色分离比
各试验组稚贝的壳色及其数量见表12。2个橙色品系自交系出现了2种不同的壳色分离 (图1),主要表现在壳面背景颜色上,出现了橙色和白色的分离,OO1分离比(橙色∶白色)为 3.11∶1,OO2为3.15∶1,符合3∶1的分离比 (表12),说明橙色对白色为显性,而橙色品系所特有的4条点状条带并未出现分离。珍珠白品系的2个自交系后代的壳面背景颜色均为白色,WW1出现不规则的条带,而WW2均带有珍珠白品系所特有的1条深色放射条带。说明在壳面背景颜色方面两试验组的亲本为纯合子,在壳面花纹或条带方面WW1的亲本为杂合子。
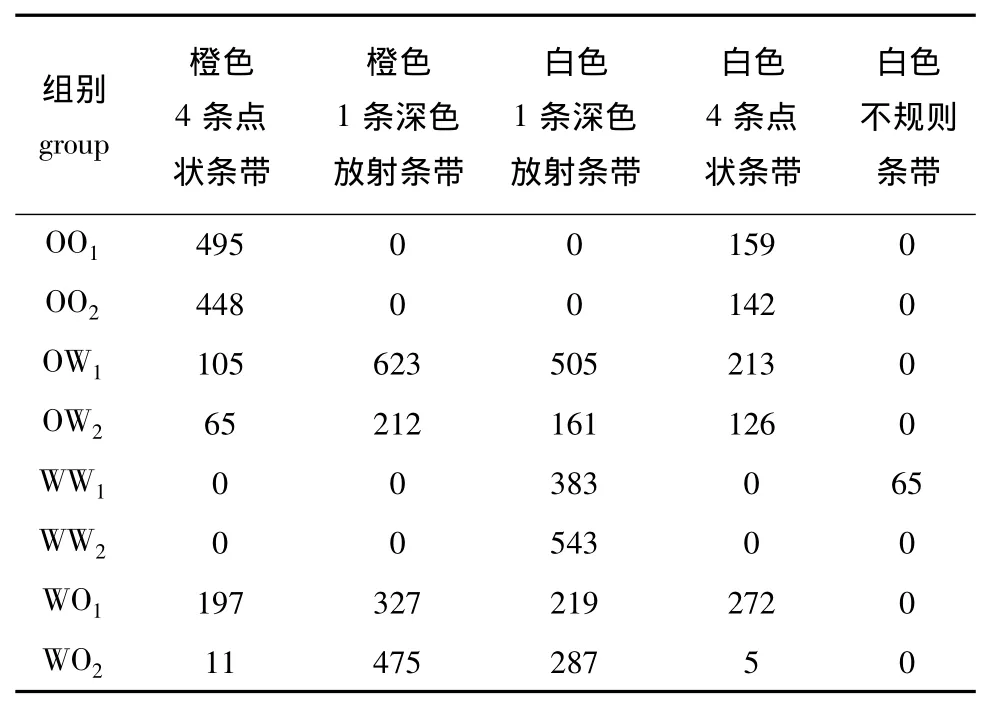
表12 各试验组稚贝的壳色及其数量Tab.12 Shell colors and numbers of juveniles in each experimental group

图1 壳面背景颜色为白色 (左)和橙色 (右)Fig.1 Shell colors of white(left)line and orange(right)line

图2 珍珠白 (左)和海洋橙 (右)对比Fig.2 White line(left)and orange line(right)
从壳面背景颜色上分析正反交组的后代,其表现出橙色和白色两种不同的壳色 (图3),试验组OW1、OW2和WO1的壳色分离比 (橙色∶白色)分别为1.01∶1、0.97∶1、1.07∶1,符合1∶1 的分离比 (表12)。从壳面花纹或条带上分析,OW1、OW2、WO1的壳色从左到右依次分别为白色4条点状条带、白色1条深色放射条带、橙色1条深色放射条带、橙色4条点状条带,而WO2的壳色从左到右分别为白色1条深色放射条带、橙色1条深色放射条带 (图3)。正反交组后代表现出2种条带类型:1条深色放射条带 (同珍珠白)和4条点状条带 (同海洋橙),但各试验组之间的分离比并不相同且差异很大,说明壳面花纹或条带的遗传机制比较复杂。

图3 试验组OW1、OW2、WO1、WO2的壳色Fig.3 Shell colors of OW1,OW2,WO1,and WO2lines
3 讨论
3.1 杂种优势
杂种优势主要是由于优良显性基因互补作用和群体中杂合子频率的增加,导致不良基因的作用得到抑制和减弱,从而使整个群体的平均显性效应和上位效应得到提高[23]。在动植物中主要表现在生活力、耐受力、抗病力和繁殖力等性能的提高,饵料转化率和生长速度等方面优于亲本。但有的时候,某些等位基因间的相互作用可能产生负的显性效应,导致基因所控制的性状表现出杂交群体表型值低于双亲表型值或双亲中一方的现象,即表现出“劣势”。闫喜武等[15-16]、霍忠明等[17]对不同壳色品系的蛤仔研究发现,其生长和存活率存在一定的差异,海洋橙品系存活率较高,具有较强的抗性,经过两代个体选择的选育,其生长性状也得到了显著提高;而珍珠白品系最大的优点是生长速度快,但其存活性状较差,抗性较弱。从本试验的生长结果来看,杂交组WO获得了一定程度上的单亲生长优势,杂交组OW在浮游期和变态期表现出生长优势,在稚贝期却表现出了生长劣势。但正反交组总体上获得了一定程度的中亲生长优势。这种正反交组之间及同一试验组不同日龄之间的生长优势表现程度不同的现象,与其他贝类不同遗传群体或品系间的杂交结果相同[24-26]。在存活率方面,正反交组的中亲存活优势和杂交组WO的单亲存活优势均表现出积极的一面。杂交组OW除了在3、6日龄时表现出一定的单亲存活劣势外,在其他日龄时均表现出存活优势。在变态期,正反交组的变态率表现出一定的中亲及单亲杂种优势。综合生长、存活率和变态率三方面来看,正反交组的杂种优势大小顺序为WO>OW。通过杂交的手段有效地提高了蛤仔杂交后代的存活率、变态率,增强了其对环境的抗性,进而为高产的新品种选育提供了基础。
3.2 卵源效应
卵源效应即母本效应,是指子代的某些外貌特征、生理性状和生产性能受到其母本直接影响的一种生理现象,其表现不仅受到其自身遗传基础的影响,还与其生活环境有着十分密切的关系。在动物早期的生长和存活等方面,母本效应是一个非常重要的影响因素[27]。母本效应包括细胞质遗传、母本营养环境等多个方面。母本营养环境主要影响个体的早期发育阶段,主要是由于母本个体的营养积累程度、卵径大小、携带的卵内营养物质不同所造成,这种影响会随着个体的发育逐渐减弱或消失。国外学者对比目鱼[28]、长牡蛎[29]、太平洋牡蛎[30]和海湾扇贝群体间[25]的研究发现,杂交个体生长和存活的母本效应在幼虫期显著存在,而随着个体的生长而消失。在本试验中,杂交组生长和存活的杂种优势主要受到母本效应的影响,且母本效应不仅存在于幼虫期,还贯穿于变态期和稚贝期,说明本试验中杂交组的母本效应主要受细胞质遗传所控制,这也与蛤仔其他杂交试验的结果相类似[31]。在本试验所用的亲本中,海洋橙品系具有较强的存活性,珍珠白品系具有较快的生长性,并且它们都已经过了多代的自繁,相关的优良基因得到了一定程度的纯化,因此,亲本把优良基因传递给子代并表达出来的可能性就大,子代杂种优势得到充分表达,并且这种由基因控制的杂种优势会伴随着生物体的整个生活史。
3.3 壳色分析
海洋双壳贝类的壳面颜色在过去一直被认为是分泌的产物,主要受环境的影响。但最近的研究发现,贝类的壳面颜色不仅与它们的生态行为、生长、存活性状有关,而且还能够稳定地遗传给后代[32-33]。Innes 等[13]和 Newkirk[14]通过杂交的方法研究了贻贝的壳色遗传机制,指出其壳色是由简单的遗传基因控制,棕色和黑色相对于其他颜色是显性。郑怀平等[20]对海湾扇贝壳色遗传的研究中指出,海湾扇贝的壳面背景颜色由单基因控制,橙色对白色为显性。在本试验中,2个橙色品系自交系出现了2种不同的壳面背景颜色,即橙色和白色的分离,分离比 (橙色∶白色)OO1为 3.11∶1,OO2为3.15∶1,符合3∶1的分离比,说明橙色对白色为显性,亲本的基因型为Ow。珍珠白品系的2个自交系后代的壳面背景颜色均为白色,说明其亲本为隐性纯合子,基因型为ww。这两种品系杂交后代的壳面背景颜色分离比 (橙色∶白色)基本符合1∶1,这种结果正好遵循孟德尔遗传定律,即Ow(橙色) ×ww(白色)的后代基因型为 Ow(橙色)和ww(白色),表型性状分离比 (橙色∶白色)为1∶1,壳面背景颜色是由简单的遗传基因控制。本研究中,从壳面花纹或条带的分析来看,杂交后代的条带分离比例并未有什么规律可言,这可能是由于壳面花纹或条带的遗传机制比较复杂,通过一代的杂交并不能分析出规律,需要对其进行更加深入地研究才能了解其遗传规律和本质。但通过对杂交后代出现白色4条点状条带、白色1条深色条带、橙色4条点状条带、橙色1条深色条带四种表现型可以分析出,壳面背景颜色和壳面花纹或条带的控制基因并不处于同一对同源染色体上,彼此之间不存在基因连锁或其他的联系。
[1]Winter P C,Hickey G I,Fletcher H L.谢雍,译.遗传学[M].北京:科学出版社,2006:204-205.
[2]Devanand P S,Rangaswamy M,Ikehashi H.Identification of hybrid sterility gene loci in two cytoplasmic male sterile lines in rice[J].Crop Science,2000,40(3):640-646.
[3]Ininda J,Njuguna J G M,Gichuru L,et al.Performance of threeway cross hybrids for agronomic traits and resistance to maize streak virus disease in Kenya[J].African Crop Science Journal,2006,14(4):287-296.
[4]Reynolds M,Manes Y,Izanloo A,et al.Phenotyping approaches for physiological breeding and gene discovery in wheat[J].Annals of Applied Biology an International Journal of the AAB,2009,155(3):309-320.
[5]Perez E O,Cianzio S R,Wiley H,et al.Insect-mediated crosspollination in soybean[Glycine max(L.)Merrill]:I.agronomic performance[J].Field Crops Research,2007,101(3):259-268.
[6]李琼华,覃小荣,殷进炎.陆川猪二元、三元杂交组合对提高商品猪生产性能的研究[J].广西畜牧兽医,2008,24(5):259-261.
[7]陈涛,杨光勇.三元杂交母牛回交试验研究[J].中国畜牧兽医,2008,35(8):141-142.
[8]贾存灵,魏泽辉,孔祥浩,等.萨陶寒三元杂交肉羊主要经济性状表型相关及回归分析[J].湖北农业科学,2008,47(2):203-206.
[9]楼允东,李小勤.中国鱼类远缘杂交研究及其在水产养殖上的应用[J].中国水产科学,2006,13(1):151-158.
[10]姚雪梅,黄勃,赖秋明,等.凡纳滨对虾自交系与杂交系早期生长和存活的比较[J].水产学报,2006,30(6):791-795.
[11]陈昌平,徐燕,纪德华,等.坛紫菜品系间杂交藻体选育及经济性状的初步研究[J].水产学报,2007,31(1):97-104.
[12]许芳.青岛杂交参新种集26种海参品质[J].水产科技情报,2009(3):155.
[13]Innes D J,Halev L E.Inheritance of a shell-color polymorphism in the mussel[J].Journal of Heredity,1977,68(3):203-204.
[14]Newkirk G F.Genetics of shell color in Mytilus edulis L.and the association of growth rate with shell color[J].Journal of Experimental Marine Biology and Ecology,1980,47(1):89-94.
[15]闫喜武,张国范,杨凤,等.菲律宾蛤仔莆田群体两个壳色品系生长发育的比较[J].大连水产学院学报,2005,20(4):266-269.
[16]闫喜武,张国范,杨凤,等.菲律宾蛤仔莆田群体与大连群体生物学比较[J].生态学报,2005,25(12):3329-3334.
[17]霍忠明,闫喜武,张跃环,等.菲律宾蛤仔(Ruditapes philippinarum)大连群体家系建立及生长比较[J].海洋与湖沼,2010,43(1):57-61.
[18]Neter J,Wasserman W,Kutner M.Applied linear statistical models[M].Chicago:McGraw-Hill Irwin,1985:1127.
[19]Rohlf F J,Sokal R R.Statistical tables[M].New York:W H Freeman and Company,1981:219.
[20]郑怀平,张国范,刘晓,等.海湾扇贝杂交家系与自交家系生长和存活的比较[J].水产学报,2004,28(3):267-272.
[21]Cruz P,Ibarra A M.Larval growth and survival of two catarina scallop(Argopecten circularis,Sowerby,1835)populations and their reciprocal crosses[J].Journal of Experimental Marine Biology and Ecology,1997,212:95-110.
[22]Zhang H B,Liu X,Zhang G F,et al.Growth and survival of reciprocal crosses between two bay scallops,Argopecten irradians concentricus Say and A.irradians irradians Lamarck[J].Aquaculture,2007,272(Suppl.1):88-93.
[23]包振民,万俊芬,王继业,等.海洋经济贝类育种研究进展[J].青岛海洋大学学报,2002,32(4):567-572.
[24]Hedgecock D,Mcgoldrick D J,Manahan D T,et al.Quantitative and molecular genetic analyses of heterosis in bivalve mollusks[J].J Exp Mar Biol Ecol,1996,203:49-59.
[25]Cruz P,Ibarra M.Larval growth and survival of two catarina scallop(Argopecten circularis,Sowerby,1835)populations and their reciprocal crosses[J].Journal of Experimental Marine Biology and Ecology,1997,212(1):95-110.
[26]Manzi J J,Hadley N H,Dillon R T.Hard clam,Mercenaria mercenaria,broodstocks:growth of selected hatchery stocks and their reciprocal crosses[J].Aquaculture,1991,94(1):17-26.
[27]张国范,郑怀平.海湾扇贝养殖遗传学[M].北京:科学出版社,2009:89.
[28]Solemdal P.Maternal effects—a link between the past and the future[J].Journal of Sea Research,1997,37(3/4):213-227.
[29]Soletchnick P,Huvet A,le Moine O,et al.A comparative field of growth,survival and reproduction of Crassostrea gigas,C.angulata and their hybrids[J].Aquatic Living Resources,2002,15(4):243-250.
[30]Hedgecock D.Hybrid vigor is pervasive in crosses among inbred lines of Pacific oysters[J].Journal of Shellfish Research,1996,15(2):511.
[31]闫喜武,张跃环,孙焕强,等.菲律宾蛤仔(Ruditapes philippinarum)海洋橙品系两个世代的杂交与近交效应[J].海洋与湖沼,2011,42(2):309-316.
[32]张跃环,闫喜武,姚托,等.菲律宾蛤仔2个壳色品系群体杂交的研究[J].南方水产,2008,4(3):27-32.
[33]闫喜武,张跃环,霍忠明,等.不同壳色菲律宾蛤仔品系间的双列杂交[J].水产学报,2008,32(6):864-875.
