宫颈癌组织白介素10和干扰素γ基因表达及其启动子区甲基化状态研究
2014-02-10杨艳艳金玉兰
马 冬,杨艳艳,赵 力,金玉兰,王 洋,李 鸥
宫颈癌患者机体内免疫微环境的变化已受到人们重视[1],其中辅助性T细胞(T helper,Th)亚群Th1/Th2的变化在恶性肿瘤免疫逃逸中十分重要[2]。组织特异性DNA甲基化谱是基因组的一个显著特征,近年来研究表明,基因甲基化异常与宫颈癌变有关[3],因此制定宫颈癌Th1、Th2相关细胞因子DNA甲基化谱对宫颈癌的早期诊断有重要意义。本研究通过检测宫颈癌患者宫颈组织中Th1/Th2型细胞因子干扰素γ(IFN-γ)和白介素10(IL-10)基因启动子区甲基化状态及转录活性,旨在探讨DNA甲基化与基因表达的关系及其在宫颈癌中的作用。
1 资料与方法
1.1 一般资料 选取2011年3月—2012年5月在唐山市工人医院住院部就诊的宫颈癌患者43例为宫颈癌组、宫颈上皮内瘤变(CIN)患者62例为CIN组,另选取同期行全子宫切除的子宫肌瘤患者43例为对照组。其中宫颈癌组年龄46~59岁,平均(49.8±5.2)岁;病理类型均为鳞癌,根据WHO标准分级,高分化鳞癌7例,中分化鳞癌23例,低分化鳞癌13例;根据FIGO(2000年)临床分期标准,I期27例,Ⅱ期13例,Ⅲ~Ⅳ期3例。CIN组年龄40~55岁,平均(48.6±5.1)岁;宫颈上皮内瘤变I期(CIN1)23例,宫颈上皮内瘤变Ⅱ/Ⅲ期(CIN2/3)39例。对照组年龄43~56岁,平均(50.6±5.2)岁。收集三组患者的宫颈组织标本,其中对照组标本来源于子宫肌瘤旁正常宫颈组织,CIN组和宫颈癌组标本分别来源于宫颈活检和手术治疗,均经病理检查确诊。取标本前患者均未行化疗、放疗或免疫治疗,收集后置于-80 ℃冰箱保存。
1.2 方法
1.2.1 DNA和总RNA提取 采用饱和酚-氯仿抽提法提取三组宫颈组织DNA,Trizol法提取总RNA,1%琼脂糖凝胶电泳鉴定DNA和总RNA完整性。
1.2.2 IL-10和IFN-γ基因启动子区甲基化检测 按照EZ DNA Methylation-GoldTMKit试剂盒说明书对DNA进行甲基化修饰及纯化。NCBI检索IL-10(AF418271)和IFN-γ(J00219)基因启动子区序列,Methyl Primer Express v1.0软件分析核对参考引物[4-5],亚硫酸氢盐测序法(Bisulfite sequencing PCR,BSP)检测IL-10基因启动子区域为-454~-66,包含6个甲基化位点(-110、-185、-320、-350、-352、-373),上游引物:5′-GTTAGTAAGGAGAAGTTTTGGG-3′,下游引物:5′-CATTCATTAAAAAACCACAAT-3′,扩增片段389 bp。BSP反应体系(50 μl):PCR Master Mix(美国Promega)47 μl,上、下游引物(10 μM)各0.5 μl,DNA模板2 μl。反应条件:95 ℃ 3 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s(30个循环),72 ℃ 5 min。甲基化特异性PCR(MSP)检测IFN-γ基因启动子区甲基化,甲基化引物为:上游5′-AAGAGTTAATATTTTATTAGGGCGA-3′,下游5′-TAAACTCCTTAAATCCTTTAACGAT-3′;非甲基化引物为:上游5′-TGAAGAGTTAATATTTTATTAGGGTGA-3′,下游5′-TAAACTCCTTAAATCCTTTAACAAT-3′,PCR产物片段156 bp。MSP反应体系(20 μl):PCR Master Mix 18 μl,上、下游引物(10 μM)各0.5 μl,DNA模板1 μl。反应条件:95 ℃ 3 min,94 ℃ 45 s、50 ℃ 60 s、72 ℃ 45 s(35个循环),72 ℃ 5 min。PCR产物经1.5%琼脂糖凝胶电泳后观察条带。甲基化结果判断:仅出现甲基化引物扩增154 bp片段产物判别为甲基化,仅出现非甲基化引物扩增156 bp片段产物判别为非甲基化,甲基化引物及非甲基化引物均扩增出条带为部分甲基化。
1.2.3 宫颈组织中IL-10和IFN-γ基因mRNA的表达 采用实时荧光定量PCR(RT-PCR)检测三组患者宫颈组织中IL-10和IFN-γ基因的mRNA表达水平[6]。RT-PCR反应:按M-MLV反转录酶系(美国GIBCO)说明书操作,加入100 ng随机引物和0.5~5.0 μg总RNA及缓冲剂(buffer)混匀后,37 ℃孵育1 h,70 ℃灭活15 min,cDNA保存于-20 ℃备用。20 μl PCR反应体系:12 μl buffer,上、下游引物各1 μl,cDNA产物2 μl,Taq酶1 μl,加超纯水至20 μl混合。反应程序:93 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共进行30个循环。
1.2.4 转录因子结合位点序列分析 转录因子的结合DNA序列位点的分析采用TFSEARCH软件、promoter scan软件和在线AliBaba 2.1分析工具。把目的序列粘贴在在线软件提供的粘贴框,按执行按钮即可,具体网址如下:http://mbs.cbrc.jp/research/db/TFSEARCH.html;http://www-bimas.cit.nih.gov/molbio/proscan/index.html;http://www.gene-regulation.com/pub/programs/alibaba2/index.html。

2 结果
2.1 三组宫颈组织IL-10和IFN-γ mRNA的表达 三组IL-10和IFN-γ mRNA水平比较,差异均有统计学意义(P<0.05),其中宫颈癌组和CIN组IL-10 mRNA水平均高于对照组,IFN-γ mRNA水平均低于对照组,差异有统计学意义(P<0.01,见表1)。
2.2 三组IL-10和IFN-γ基因启动子区甲基化分析 三组IL-10基因启动子区-320、-350、-352、-373位点甲基化率比较,差异均无统计学意义(P>0.05);三组IL-10基因启动子区-110、-185位点甲基化率比较,差异均有统计学意义(P<0.05),其中宫颈癌组和CIN组IL-10基因启动子区-110位点甲基化率均高于对照组,宫颈癌组IL-10基因启动子区-185位点甲基化率低于对照组,差异均有统计学意义(P<0.05,见表2)。不同组织提取DNA的IFN-γ基因启动子甲基化状态见图1。宫颈癌组IFN-γ基因启动子甲基化率为34.9%(15/43),CIN组IFN-γ基因启动子甲基化率为14.5%(9/62),对照组IFN-γ基因启动子甲基化率为4.6%(2/43)。三组IFN-γ基因启动子甲基化率比较,差异有统计学意义(χ2=14.250,P=0.001),其中宫颈癌组IFN-γ基因启动子甲基化率高于CIN组,CIN组高于对照组,差异均有统计学意义(χ2=5.970,P=0.015;χ2=12.390,P<0.001)。
Table1 Comparison of the level of IL-10 and IFN-γ mRNA among the 3 groups
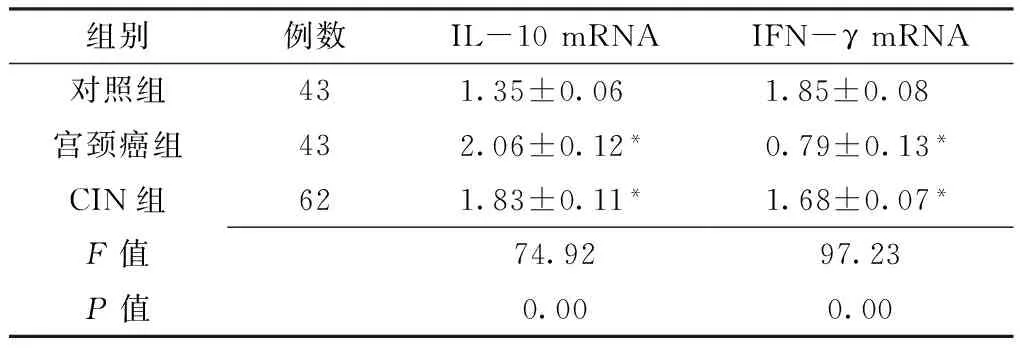
组别例数IL-10mRNAIFN-γmRNA对照组431.35±0.06 1.85±0.08 宫颈癌组432.06±0.12*0.79±0.13*CIN组621.83±0.11*1.68±0.07*F值74.9297.23P值0.000.00
注:与对照组比较,*P<0.01;IL-10=白介素10,IFN-γ=干扰素γ
表2 三组IL-10基因启动子区位点甲基化率比较〔n(%)〕
Table2 Comparison of methylation rates of IL-10 gene promoter among the 3 groups
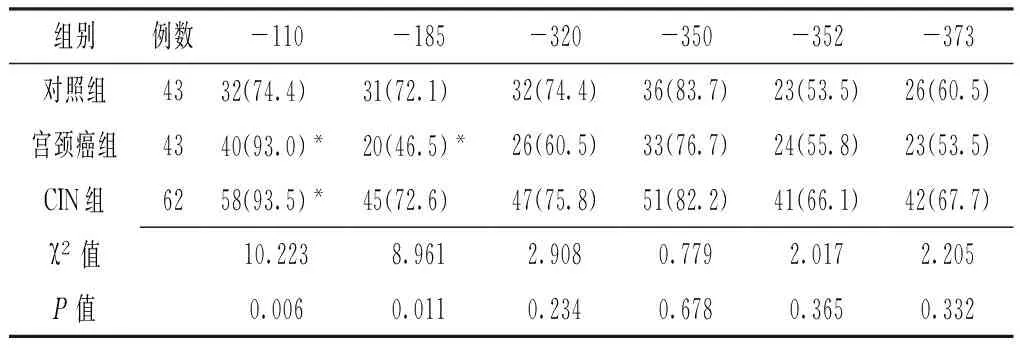
组别例数-110-185-320-350-352-373对照组4332(74.4) 31(72.1) 32(74.4)36(83.7)23(53.5)26(60.5)宫颈癌组4340(93.0)*20(46.5)*26(60.5)33(76.7)24(55.8)23(53.5)CIN组6258(93.5)*45(72.6) 47(75.8)51(82.2)41(66.1)42(67.7)χ2值10.2238.9612.9080.7792.0172.205P值0.0060.0110.2340.6780.3650.332
注:与对照组比较,*P<0.05
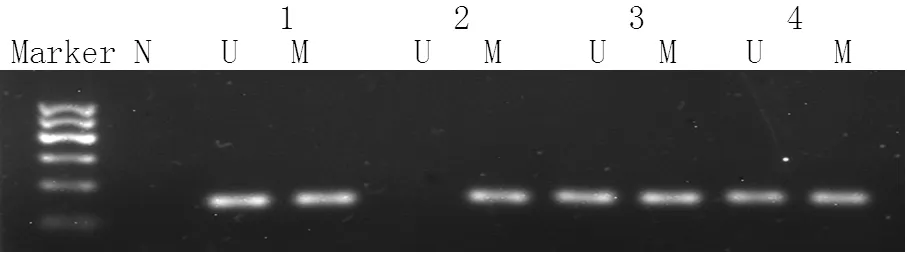
注:N=空白对照,U=非甲基化,M=甲基化,1=对照组,2=宫颈癌组,3=CIN1,4=CIN2/3
图1 MSP检测三组IFN-γ基因启动子甲基化状态
Figure1 Methylation of IFN-γ gene promoter by MSP among the 3 groups
2.3 甲基化对IL-10基因转录活性的影响 通过在线软件TFSEARCH发现IL-10基因启动子区可能包含ER、HSF、HSF或AP-4、CCAAT-box、STAT3或Ets-1共5个转录因子结合域(见图2)。

图2 IL-10基因启动子区与转录因子结合位点预测
Figure2 Prediction of IL-10 gene promoter and transcription factor binding sites
3 讨论
机体的抗肿瘤作用是以Th1介导的细胞免疫为主,而Th1向Th2漂移,将造成免疫抑制状态,机体的抗肿瘤免疫将受到严重干扰[7]。IFN-γ是Th1分泌的主要细胞因子,且可诱导前体T细胞向Th1分泌,是抗肿瘤免疫中较早出现的细胞因子;IL-10是一种有助于下调免疫反应的Th2型细胞因子,具有多种抑制抗肿瘤免疫应答的作用。IL-10升高,不利于抗肿瘤免疫。本研究结果显示,宫颈癌患者IL-10表达水平明显增强,IFN-γ表达水平明显降低,呈现出典型的Th2漂移现象,这可能是宫颈癌患者免疫监视功能低下的主要原因之一。
DNA甲基化主要在转录水平抑制细胞因子基因的表达[8],CpG岛甲基化与其所在基因的表达呈反比,即CpG岛甲基化程度越高,基因表达水平越低,反之则越高。本研究对IL-10和IFN-γ基因的甲基化状态进行分析,结果表明,宫颈癌患者IL-10基因启动子区-185位点甲基化率较低,而IFN-γ甲基化率异常增高,与Viana等[6]研究牙髓炎及Son等[4]研究乳腺癌相关报道一致,说明DNA甲基化导致基因表达异常,造成免疫功能低下,失去对癌细胞的免疫监视和清除。
DNA甲基化引起基因转录抑制的机制主要有3种[9],即直接作用模式(结合位点DNA甲基化导致相应转录因子不能识别与结合)、间接作用模式(序列特异性的甲基化DNA结合蛋白与启动子区甲基化CpG岛结合,募集一些蛋白,形成转录抑制复合物,从而阻止转录因子与启动子区的靶序列结合,进而影响基因转录)和改变染色质结构模式(DNA的甲基化致使染色质结构改变,抑制基因表达)。前期研究发现,宫颈癌组织IL-10基因CpG岛的甲基化率较低[10],且Szalmás等[11]在鳞状上皮细胞中发现IL-10基因的转录活性与转录因子STAT3、Sp1、Ets-1和CCAAT-box有关。因此,本研究采用BSP进一步明确精确位点的甲基化对IL-10基因转录活性的可能影响。通过DNA序列的转录因子结合位点预测,发现IL-10基因启动子区可能包含ER、HSF、HSF或AP-4、CCAAT-box、STAT3或Ets-1共5个转录因子结合域,其中-110、-185位点的甲基化率在宫颈癌组和对照组中具有显著差异,影响CCAAT-box、STAT3和Ets-1与之结合。有趣的是两位点甲基化率水平高低在宫颈癌组和对照组中正好相反,-110位点的甲基化上调可能影响转录因子STAT3或Ets-1相关功能,而-185位点甲基化下调可能影响转录因子CCAAT-box的结合活性增强,进而影响IL-10基因在宫颈癌中的表达水平升高。
综上所述,IL-10基因启动子区域-110、-185位点甲基化状态使其在宫颈组织中的分泌表达增高,IFN-γ甲基化率异常增高,导致其在宫颈组织中的分泌表达减少,宫颈癌患者处于Th2极化状态,与宫颈癌的发生有关。表观遗传对细胞因子基因表达的调控除DNA甲基化外,还包括组蛋白乙酰化[12]和染色质结构变化[13]等方式,但其在宫颈癌发生中的可能作用将是笔者下一步研究的重点,这将为诊断和免疫治疗宫颈癌的研究提供科学参考。
1 马翠,张为远.宫颈癌与免疫功能状态[J].中国妇幼保健,2009,24(25):3608-3611.
2 陈远崇,陈竹雨.结直肠癌患者血清Th1/Th2细胞因子水平变化及其临床意义研究[J].中国全科医学,2011,14(12):4136-4138.
3 Szalmás A,Kónya J.Epigenetic alterations in cervical carcinogenesis[J].Semin Cancer Biol,2009,19(3):144-152.
4 Son KS,Kang HS,Kim SJ,et al.Hypomethylation of the interleukin-10 gene in breast cancer tissues[J].Breast,2010,19(6):484-488.
5 Bonilla-Henao V,Martínez R,Sobrino F,et al.Different signaling pathways inhibit DNA methylation activity and up-regulate IFN-gamma in human lymphocytes[J].J Leukoc Biol,2005, 78(6):1339-1346.
6 Viana MB,Cardoso FP,Diniz MG,et al.Methylation pattern of IFN-γ and IL-10 genes in periodontal tissues[J].Immunobiology,2011,216(8):936-941.
7 Hedrich CM,Bream JH.Cell type-specific regulation of IL-10 expression in inflammation and disease[J].Immunol Res,2010,47(1/3):185-206.
8 Wilson AG.Epigenetic regulation of gene expression in the inflammatory response and relevance to common diseases[J].J Periodontol,2008,79(8 Suppl):1514-1519.
9 Berger SL.The complex language of chromatin regulation during transcription[J].Nature,2007, 447(7143):407-412.
10 马冬,蔚岩,王艳,等.IL-10基因启动子区CpG岛甲基化与宫颈癌的相关性研究[J].中国妇幼保健,2013,28(12):1956-1959.
11 Szalmás A,Bánáti F,Koroknai A,et al.Lineage-specific silencing of human IL-10 gene expression by promoter methylation in cervical cancer cells[J].Eur J Cancer,2008,44(7):1030-1038.
12 Wang Z,Zang C,Rosenfeld JA,et al.Combinatorial patterns of histone acetylations and methylations in the human genome[J].Nat Genet,2008,40(7):897-903.
13 Li B,Carey M,Workman JL.The role of chromatin during transcription[J].Cell,2007,128(4): 707-719.
