埃索美拉唑对人胃上皮细胞抗氧化损伤的保护作用及分子机制研究
2014-02-08刘朝霞阳学风
胡 杨,吴 清,刘朝霞,傅 念,阳学风
生理情况下,胃黏膜的完整性依赖于机体的损伤因素和防御机制之间的平衡。目前,虽然对引起胃黏膜损伤的因素有了较深的认识,但对参与胃黏膜防御的细胞和分子机制仍不明了。血红素氧合酶1(HO-1)是催化血红素降解为一氧化碳(CO)、亚铁离子和胆红素的限速酶,并在机体的抗炎症、抗氧化损伤中发挥重要作用[1]。研究显示,HO-1在胃上皮细胞质中成组性表达,而幽门螺杆菌感染后,HO-1表达水平显著增高[2],此外,维生素C对胃黏膜的保护作用可能与诱导HO-1表达有关,且HO-1的诱导表达可促进大鼠溃疡模型的愈合[3]。因此,以HO-1为出发点,寻求相应的诱导剂,对治疗胃黏膜损伤具有重要意义。埃索美拉唑是一种新型的质子泵抑制剂(PPI),通过抑制胃壁细胞的H+/K+-ATP酶来降低胃酸分泌,防止胃酸的形成,临床上用于治疗由高分泌胃酸引起的胃肠道黏膜疾病,如胃溃疡和反流性食管炎等疾病[4-5]。然而,近期也有研究显示多种酸泵拮抗剂对胃黏膜本身具有多效作用,包括抗凋亡作用、抑制活性氧(ROS)的形成和抑制巨噬细胞黏附素分子的表达。这类药物不仅用于治疗各种胃黏膜疾病,同时对Crohn病也有一定疗效。由于ROS在胃黏膜损伤中的作用日益受到重视,因此PPI对ROS的清除可能是其抗酸之外的胃黏膜保护效应的重要机制[6-7]。本研究旨在探讨埃索美拉唑对胃上皮细胞表达HO-1的影响。
1 材料与方法
1.1 主要试剂 埃索美拉唑购自Astrazeneca公司,SYBGREEN PCR Mix购自ABI公司,TRIZol购自Invitrogen公司,cDNA反转录试剂盒购自Fermentas公司,HO-1活性试剂盒购自上海GENMED公司,RIPA裂解液、ECL试剂盒购自Pierce公司,BCA试剂盒购自江苏碧云天生物技术公司,HO-1和β-actin多克隆抗体购自Santa Cruz公司,RPMI 1640培养基和胎牛血清购自 Gibco公司,放线菌素D(ActD)和放线菌酮(CHX)购自Sigma-Adrich公司。
1.2 细胞培养与处理 人胃上皮AGS细胞购自中科院上海细胞库,细胞用含10%胎牛血清的RPMI 1640培养基,在37 ℃ 5%二氧化碳(CO2)环境中培养。待细胞长至培养基颜色变黄,此时细胞基本满瓶,收集细胞,1 000 r/min离心5 min(离心半径12 cm),弃去培养基,无菌磷酸盐缓冲液(PBS)洗涤后,用无血清RPMI 1640培养液于6孔板中调整其密度为1×105/ml,37 ℃,5%CO2环境中培养24 h。实验分为对照组和埃索美拉唑组。其中对照组加入等量的RPMI 1640培养基。埃索美拉唑组加入0.1、0.5、1.0 μg/ml的埃索美拉唑(用0.9%氯化钠溶液溶解),根据不同的实验目的孵育相应时间后用于如下分析。
1.3 光泽精化学发光分析法测定ROS 接种于6孔板中的细胞经埃索美拉唑孵育8 h后,PBS洗涤,胰蛋白酶解并用PBS重悬浮。加入50 μmol/L光泽精和100 μmol/L还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)。为了观察HO-1对ROS的影响,埃索美拉唑加入前,AGS细胞首先与2,4-二甘油次卟啉锌(ZnDPBG)预孵育15 min。数据采用相对光单位(RLU)表示,计算公式为待测样品RLU/NAPDH处理组RLUmax×100%。
1.4 实时定量聚合酶链式反应(PCR)法检测mRNA的表达 细胞处理结束后,根据试剂盒操作说明提取总RNA(FUJIFILM)并反转录为cDNA,产物用RNA酶处理。设计特异性引物用于检测HO-1、环氧化酶(COX)-1和COX-2的表达量。HO-1正向引物:5′-GCTCAAAAAGATTGCCCAGA-3′;反向引物:5′-GCGGTAGAGCTGCTTGAACT-3′。COX-1正向引物:5′-CAAGGAAGCAGCCTCAGAGT-3′,反向引物:5′-AGGCCTGGAACTGAGTCAAA-3′。COX-2正向引物:5′-GCCATCTTTGGTGAAACCAT-3′,反向引物:5′-AGTGCTTGGCTTCCAGTAGG-3′。50 μl反应体系包括:25 μl 2×SYBR Green Master Mix〔200 nmol/L dATP、dGTP和dCTP;400 nmol/L dUTP;2 mmol/L氯化镁(MgCl2),0.25 U尿嘧啶-N-糖基化酶(UNG),0.625 U AmpliTaq Gold DNA聚合酶〕,25 pmol 正向和反向引物,2 μl cDNA。酶利用ABI Prism 5700对HO-1进行扩增。首先50 ℃ 2 min;95℃ 10 min;随后95 ℃ 15 s;60 ℃变性、延伸60 s,共40个循环。同时采用β-actin为内参。mRNA表达倍数改变采用2ΔCt表示,ΔCt=(Ct对照基因-Ctβ-actin)-(Ct待测基因-Ctβ-actin)。
1.5 Western blotting法检测HO-1蛋白表达水平 6孔板中细胞经PBS漂洗后,加入RIPA细胞裂解液裂解30 min,4 ℃,12 000 r/min离心15 min(离心半径12 cm),上清液即为细胞总蛋白。裂解液中的蛋白用Bradford试剂在分光光度计中测定595 nm处吸光度。50~70 μg总蛋白在5%~10%聚丙烯酰胺凝胶中电泳,并转移至聚偏氟乙烯(PVDF)膜上,经5%无脂牛奶封闭后,分别用一抗、二抗孵育。ECL发光,显影。
1.6 比色法测定HO-1酶活性 分别收集细胞于1.5 ml的EP管中,离心弃上清液,加1.5 ml的GENMED清理液A清洗细胞,随后加入100 μl GENMED裂解液B,超声裂解细胞。按试剂盒要求将EP管标志为背景管和样品管,按顺序分别加入GENMED 340 μl缓冲液C、20 μl GENMED反应液D、20 μl GENMED底物液E,背景管加入20 μl GENMED阴性液F,样品管加入20 μl待测样品。37 ℃温育60 min,加入400 μl GENMED终止液终止反应。取100 μl绿色相到96孔酶标板中,分别读取464 nm和530 nm波长的吸光度。同时测定各样品的蛋白浓度,计算HO-1酶活性。

2 结果
2.1 埃索美拉唑对NADPH诱导胃上皮细胞产生ROS的影响 AGS细胞与埃索美拉唑孵育8 h后,能显著抑制NADPH诱导的ROS产生。其中1.0 μg/ml埃索美拉唑能使ROS产生量降低(73.3±3.5)%(见图1)。
2.2 埃索美拉唑对AGS细胞HO-1 mRNA的影响 AGS细胞经0.1~1.0 μg/ml埃索美拉唑孵育8 h后,实时定量PCR结果显示,0.5 μg/ml埃索美拉唑处理后,HO-1 mRNA增高8.2倍;1.0 μg/ml埃索美拉唑处理后,HO-1 mRNA增高了38.4倍(见图2)。
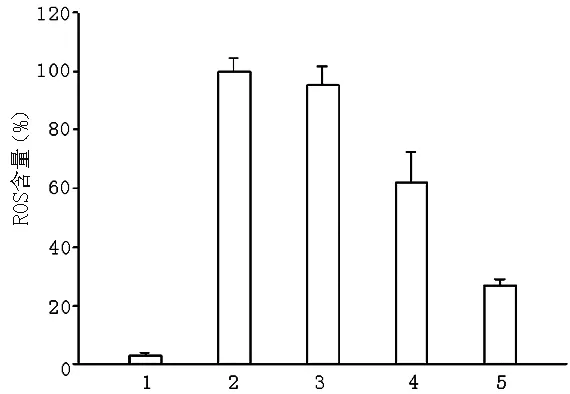
注:1对照组,2 NADPH组,3 NADPH+0.1 μg/ml埃索美拉唑组,4 NADPH+0.5 μg/ml埃索美拉唑组,5 NADPH+1.0 μg/ml埃索美拉唑组
图1 埃索美拉唑对NADPH诱导胃上皮细胞产生ROS的影响
Figure1 Effect of esomeprazole on NADPH-induced ROS production in gastric epithelial cells
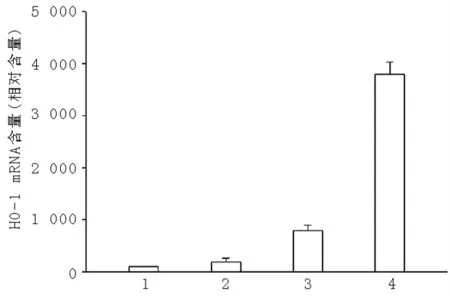
注:1 对照组,2 0.1 μg/ml埃索美拉唑组,3 0.5 μg/ml埃索美拉唑组,4 1.0 μg/ml 埃索美拉唑组
图2 埃索美拉唑对AGS细胞HO-1 mRNA的影响
Figure2 Effect of esomeprazole on HO-1 mRNA expression in gastric epithelial cells
2.3 埃索美拉唑对AGS细胞HO-1蛋白表达及酶活性的影响 不同浓度的埃索美拉唑刺激AGS细胞后,HO-1蛋白的表达量随其浓度的递增而增高,而内参β-actin在所有处理组中保持恒定(见图3A)。埃索美拉唑作用后,HO-1酶活性也随着其浓度的增加而增加(见图3B)。
2.4 埃索美拉唑对COX mRNA的影响及抑制剂处理后对HO-1表达的影响 埃索美拉唑处理后,AGS细胞内COX-1和COX-2 mRNA表达水平无变化(见图4A)。而AGS细胞首先经30 μmol/L萘普生和罗非昔布分别作用后,对HO-1表达无影响(见图4B)。

注:A埃索美拉唑对HO-1蛋白表达的影响,B埃索美拉唑对HO-1酶活性的影响;1 对照组,2 0.1 μg/ml埃索美拉唑组,3 0.5 μg/ml埃索美拉唑组,4 1.0 μg/ml 埃索美拉唑组
图3 埃索美拉唑对AGS细胞HO-1蛋白表达及酶活性的影响
Figure3 Effect of esomeprazole on HO-1 protein expression and enzymic activity in gastric epithelial cells
2.5 ActD与CHX对埃索美拉唑诱导HO-1表达的影响 AGS细胞用不同浓度的抑制剂ActD(见图5A)和翻译水平的抑制剂CHX(见图5B)进行预处理后,加埃索美拉唑刺激8 h,结果显示不同浓度的ActD和CHX抑制了HO-1的产生。
3 讨论
溃疡发生的根本原因是胃黏膜中损伤与修复因素失衡所致。在此过程中,ROS发挥重要作用。研究发现,来自中性氮氢化合物的O2-氧化成H2O2后穿过中性粒细胞膜渗入胃黏膜中,随后转化为HOCl-和HO-,产生更多的有毒物质。HOCl-与氨(NH3)反应产生毒性更高的物质——一氯氨(NH2Cl)。这些有毒的ROS可引起胃黏膜层损伤。持续的炎症促进了胃炎的进程,肠上皮化生,发育异常,甚至发生胃癌。另外,氧化应激能进一步诱导产生ROS以及更多的炎性因子[8]。奥美拉唑和兰索拉唑能有效降低胃黏膜细胞中ROS的含量。在本研究也显示埃索美拉唑也具有类似的效应,1.0 μg/ml埃索美拉唑处理胃上皮细胞后,HO-1 mRNA达到峰值。而人体服用埃索美拉唑片40 mg 2 h后,埃索美拉唑血浆中的浓度接近0.9 μg/ml[9],这与诱导HO-1表达所需要的浓度非常接近。HO-1是催化血红素降解为CO、Fe2+和胆红素的限速酶,并在机体的抗炎症、抗氧化损伤中发挥重要作用[2]。埃索美拉唑诱导产生的HO-1可能是其发挥胃上皮保护作用的重要因素,同时,HO-1产物胆红素和CO具有抗氧化、抗炎症、抗凋亡和舒血管活性,可拮抗各种损伤因素导致的胃黏膜损伤。此外,HO-1也具有一定的促进溃疡愈合的能力,并且在多种疾病(如胃炎)中表达量增高,因此可能是胃黏膜防御的重要生理因素。
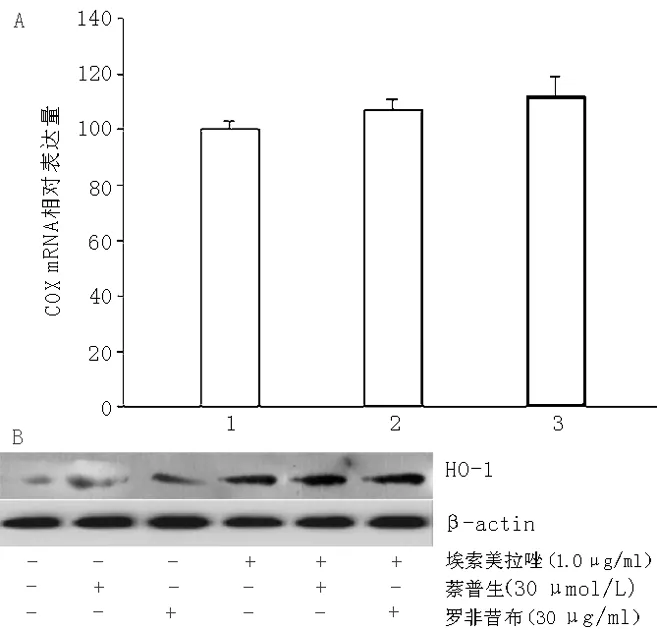
注:A埃索美拉唑对AGS细胞COX-1和COX-2 mRNA表达的影响,B COX抑制剂对HO-1表达的影响;1对照组,2 1.0μg/ml埃索美拉唑组COX-1,3 1.0 μg/ml埃索美拉唑组COX-2
图4 埃索美拉唑对COX mRNA的影响及抑制剂处理后对HO-1表达的影响
Figure4 Effect of esomeprazole on COX mRNA and HO-1 expression by inhibitors

图5 ActD与CHX对埃索美拉唑诱导HO-1表达的影响
Figure5 Effect of ActD and CHX on esomeprazole-induced HO-1 protein expression
前列腺素在PPI介导的胃黏膜保护作用中的作用目前仍有争议。研究显示,患者服用高剂量PPI 14 d可引起COX-2表达增高以及前列腺素产生[10]。在大鼠胃黏膜组织中,兰索拉唑对COX并无诱导作用[11]。也有研究显示,奥美拉唑对胃黏膜细胞诱导的前列腺素E2产生无诱导作用[12]。本研究采用COX-1和COX-2抑制剂萘普生和罗菲昔布处理AGS细胞后,发现埃索美拉唑对COX-1和COX-2 mRNA也无诱导作用。因此从这种意义上讲,埃索美拉唑诱导的HO-1产生对于各种类型的损伤,尤其是非甾体抗炎药(NSAID)胃病的防治可能具有重要意义。同时还发现,采用ActD和CHX处理后,埃索美拉唑诱导HO-1 mRNA表达降低。这表明HO-1基因表达与转录和蛋白从头合成以及转录因子或其他快速代谢短效肽有关。在随后的研究当中将进一步深入探讨其分子机制。
1 Deshane J,Chen S,Caballero S,et al.Stromal cell-derived factor 1 promotes angiogenesis via a heme oxygenase 1-dependent mechanism[J].J Exp Med,2007,204(3):605-618.
2 Krzysiek-Maczka G,Targosz A,Ptak-Belowska A,et al.Molecular alterations in fibroblasts exposed to Helicobacter pylori:a missing link in bacterial inflammation progressing into gastric carcinogenesis?[J].J Physiol Pharmacol,2013,64(1):77-87.
3 Becker JC,Grosser N,Boknik P,et al.Gastroprotection by vitamin C——a heme oxygenase-1-dependent mechanism?[J].Biochem Biophys Res Commun,2003,312(2):507-512.
4 Burness CB,Scott LJ.Acetylsalicylic acid/esomeprazole fixed-dose combination[J].Drugs Aging,2012,29(3):233-242.
5 Bardou M,Barkun AN,Hamza S,et al.Pharmacokinetic and clinical evaluation of esomeprazole and ASA for the prevention of gastroduodenal ulcers in cardiovascular patients[J].Expert Opin Drug Metab Toxicol,2012,8(9):1199-1208.
6 Cheng E,Zhang X,Huo X,et al.Omeprazole blocks eotaxin-3 expression by oesophageal squamous cells from patients with eosinophilic oesophagitis and GORD[J].Gut,2013,62(6):824-832.
7 Hashioka S,Klegeris A,McGeer PL.Proton pump inhibitors exert anti-inflammatory effects and decrease human microglial and monocytic THP-1 cell neurotoxicity[J].Exp Neurol,2009,217(1):177-183.
8 Gerloff K,Pereira DI,Faria N,et al.Influence of simulated gastrointestinal conditions on particle-induced cytotoxicity and interleukin-8 regulation in differentiated and undifferentiated Caco-2 cells[J].Nanotoxicology,2013,7(4):353-366.
9 陈刚.2种埃索美拉唑制剂的人体生物等效性研究[J].中国药房,2009,20(2):116-118.
10 Pasina L,Nobili A,Tettamanti M,et al.Co-prescription of gastroprotective agents in patients taking non-selective NSAIDs or COX-2 selective inhibitors:analysis of prescriptions[J].Int J Clin Pharmacol Ther,2010,48(11):735-743.
11 Natale G,Lazzeri G,Lubrano V,et al.Mechanisms of gastroprotection by lansoprazole pretreatment against experimentally induced injury in rats:role of mucosal oxidative damage and sulfhydryl compounds[J].Toxicol Appl Pharmacol,2004,195(1):62-72.
12 Romano M,Razandi M,Ivey KJ.Protection of gastric epithelial cell monolayers from a human cell line by omeprazole in vitro[J].Scand J Gastroenterol,1989,24(5):513-521.
