甜菜碱处理对枇杷果实采后冷害和活性氧代谢的影响
2014-01-30孙玉洁单体敏郑永华
孙玉洁,金 鹏*,单体敏,许 佳,郑永华
(1.南京农业大学食品科技学院,江苏 南京 210095;2.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
枇杷(Eriobotrya japonica Lindl.)是我国著名的特产水果,原产于中国东南部,主要分布在长江以南各省市,枇杷果肉酸甜适度,营养成分丰富,深受消费者喜爱。但枇杷成熟于初夏高温季节,采后生理代谢十分旺盛,极易腐烂变质,常温贮藏时还容易发生果实失水皱缩。由于枇杷果皮薄,采收和运输过程中易造成机械损伤,使果实变褐色,甚至腐烂[1],大大降低了商品价值。因此研究枇杷的有效贮藏保鲜技术具有重要的意义。
甜菜碱(glycine betaine,GB)是一种含羧基的季铵类生物碱,在植物、动物、细菌、真菌中均有广泛分布。甜菜碱在高等植物体内是一种重要的非毒性渗透调节物质,具有稳定生物大分子的结构和功能以及降低逆境条件下渗透失水对细胞膜、酶及蛋白质结构与功能的伤害,从而提高植物对各种胁迫因子的抗性[2]。甜菜碱在其生物合成反应中没有反馈抑制,所以对维持逆境胁迫下植物的代谢和生存具有重要的生理意义[3]。国内外已有研究表明甜菜碱能提高植物和果实的抗冷能力。张海英等[4]研究发现10 mmol/L甜菜碱处理能够使黄瓜果实维持较高的超氧化物歧化酶(superoxide dismutase,SOD)活性,降低O2-·产生速率,减轻黄瓜的冷害症状。此外,在冷藏辣椒果实中发现,5 mmol/L甜菜碱处理能提高过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)活性,减轻辣椒冷害发生[5]。本实验以‘解放钟’枇杷果实为试材,研究1、5、10、20 mmol/L甜菜碱处理对枇杷果实品质的影响,并选择最优处理组研究甜菜碱处理对枇杷果实活性氧代谢的影响,以期解释甜菜碱处理抑制枇杷果实冷害发生的机理,为甜菜碱处理在枇杷贮藏保鲜中的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
以‘解放钟’枇杷(Eriobotrya japonica Lindl.cv.Jiefangzhong)果实为材料,于2012年5月16日采收于福建莆田市常太镇枇杷生态果园,果实于正常食用成熟度(果肉硬度为2.0~2.2 N,总可溶性固形物(total soluble solid,TSS)含量为9.2%~9.4%)人工采收,采用泡沫网袋单果包装,装入纸箱中,当天运回南京实验室。选择大小基本相同、无病虫害、无机械损伤的果实。
甜菜碱、Follin试剂 美国Sigma公司;愈创木酚、对氨基苯磺酸、四氯化钛、抗坏血酸(ascorbic acid,ASA) 国药集团化学试剂有限公司;核黄素、甲硫氨酸中国惠兴生化试剂有限公司;氮蓝四唑(nitrotetrazolium blue chloride,NBT)南京基天生物技术有限公司;α-萘胺上海泗联化工厂;盐酸羟胺北京化工厂;磷酸氢二钠、磷酸二氢钠、醋酸、醋酸钠均为国产分析纯。
1.2 仪器与设备
TA-XT2i型质构仪 英国Stable Micro System公司;GL-20G-H型冷冻离心机 上海安亭科学仪器厂;DDS-11A 型电导率仪 上海第二分析仪器厂;UV-1600型分光光度计 上海美谱达仪器有限公司。
1.3 方法
1.3.1 样品处理
将挑选出的果实随机分为4 组,在20℃条件下,将处理组枇杷果实分别置于1、5、10、20 mmol/L甜菜碱溶液中,对照组置于蒸馏水中,浸泡5 min。处理完成后自然风晾干,然后将枇杷果实用0.01 mm厚聚乙烯塑料袋分装,每袋30个果实(约1 kg),每个处理10袋果实,袋口用普通橡皮筋绕两道,每组处理重复3次,于(1±1)℃、90%相对湿度条件下贮藏5 周。贮藏期间在每隔1周取样进行分析测定相关指标。
1.3.2 指标测定
1.3.2.1 果肉硬度的测定
用TA-XT2i质构仪测定果实去皮后硬度。探头直径为5 mm,下压距离为5 mm,每次测定10个果实,取平均值。
1.3.2.2 果肉出汁率的测定
将果实去皮去核后用直径6 mm的打孔器取肉柱,再切成薄厚均匀的片状,从中取6 片放入已称质量的塞有吸水纸的离心管(m1)中并称质量(m2),5 000×g离心10 min后取出果肉,再将带汁离心管称质量(m3)。按照公式(1)计算果肉出汁率:
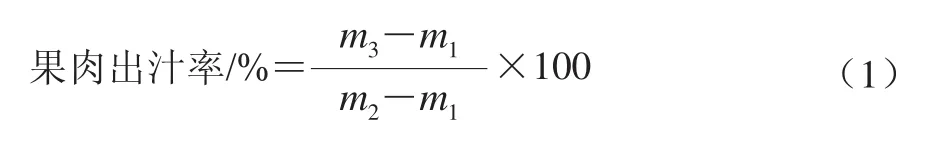
1.3.2.3 TSS和可滴定酸(titratable acidity,TA)含量的测定
TSS含量:采用手持折光仪测定,结果以%表示;TA含量:采用酸碱滴定法测定,用0.1 mol/L NaOH溶液滴定20 mL果汁至pH值为8.2,结果以苹果酸百分数含量表示。
1.3.2.4 相对电导率与丙二醛(malonaldehyde,MDA)含量的测定
相对电导率:取6个果实的果皮,去离子水洗涤后用吸水纸吸干水分,用6 mm打孔器取果皮小圆片放入刻度试管中,加入25 mL去离子水,摇匀后静置1 h,用DDS-11A型电导仪测定,之后将其煮沸30 min,待冷却后再测定,重复3次。前后两次读数的百分比即为相对电导率。
MDA含量:参照赵世杰等[6]的方法进行测定,结果以nmol/g表示,以鲜质量计。
1.3.2.5 果心褐变指数测定
取10个果实,沿果柄纵向切开,按褐变发生程度分为5个等级,即0级,无褐变;1级,轻微褐变,褐变面积小于5%;2级,轻度褐变,褐变面积为5%~25%;3级,中度褐变,褐变面积为25%~50%;4级,重度褐变,褐变面积大于50%。按照公式(2)计算褐变指数:

1.3.2.6 O2-·产生速率、H2O2含量的测定
O2-·产生速率:参照Elstner[7]的方法进行测定,结果以nmol/(min·g)表示,以鲜质量计。
H2O2含量:参照Patterson等[8]的方法进行测定,结果以μmol/g表示,以鲜质量计。
1.3.2.7 总酚、总黄酮含量的测定
总酚含量:采用Folin-Ciocalteu试剂法,参照Slinkard等[9]的方法进行测定,结果以mg/100 g表示,以鲜质量计。
总黄酮含量:参照弓志青等[10]的NaNO2-Al(NO3)3-NaOH比色法并稍作改进,1 mL酶液加5%亚硝酸钠溶液0.06 mL,混匀,加10%硝酸铝溶液0.06 mL,混匀,放置3 min,再加4%氢氧化钠溶液0.8 mL,用60%乙醇溶液稀释定容至2 mL,摇匀,放置10 min。以样品空白为对照,测定510 nm波长处的吸光度,计算总黄酮含量,结果以mg/100 g表示,以鲜质量计。
1.3.2.8 CAT、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、SOD、PPO、POD活性的测定
CAT活性:参照Cakmak等[11]的方法进行测定,略作改进。其中,3 mL酶活力测定反应液中含50 mmol/L pH 7.0磷酸缓冲液2.6 mL、酶液0.2 mL、0.75% H2O20.2 mL,混匀后测定吸光度,然后30℃保温10 min后再次测定吸光度。以每克鲜样酶促反应体系每分钟在240 nm波长处吸光度减少0.01为1个酶活性单位,结果以U/g表示酶活性,以鲜质量计。
APX活性:参照Nakano等[12]的方法进行测定,略作改进。其中,3 mL酶活力测定反应液中含50 mmol/L pH 7.0磷酸缓冲液2.5 mL、9 mmol/L抗坏血酸溶液0.1 mL、酶液0.4 mL、30% H2O20.01 mL。以每克鲜样酶促反应体系每分钟在290 nm波长处吸光度减少0.01为1个酶活性单位,结果以U/g表示酶活性,以鲜质量计。
SOD活性:参照Rao等[13]的方法进行测定,以每克鲜样酶促反应体系每分钟在560 nm波长处对NBT光化还原的抑制为50%为1个酶活性单位,结果以U/g表示酶活性,以鲜质量计。
PPO活性:参照Murr等[14]的方法测定,以每克鲜样酶促反应体系每分钟在410 nm处吸光度增加0.01为1个酶活力单位,结果以U/g表示,以鲜质量计。
POD活性:采用愈创木酚法,参照Kochba等[15]的方法测定,以每克鲜样酶促反应体系每分钟在470 nm波长处吸光度增加0.01为1个酶活力单位,结果以U/g表示,以鲜质量计。
1.4 统计方法
各指标测定均为3次重复。应用SPSS软件进行统计分析,差异由邓肯氏多重比较法在0.05的水平下进行检验。
2 结果与分析
2.1 不同浓度GB处理对枇杷果实品质的影响
如表1所示,不同浓度的GB处理均显著保持较低的枇杷果肉硬度(P<0.05),其中以10 mmol/L GB处理效果最明显。在贮藏第3周,不同浓度的GB处理枇杷果肉出汁率均显著高于对照果实(P<0.05),而贮藏第5周10 mmol/L GB处理枇杷果肉出汁率显著高于对照果实和其他浓度处理果实。枇杷果实在贮藏期间TSS和TA含量均不断下降,不同浓度的GB处理均有效抑制果实TSS含量的下降。在贮藏第3周和第5周,GB处理果实TSS含量均显著高于对照果实(P<0.05),但在贮藏第3周各处理之间无明显差别。GB处理果实TA含量无显著影响。这表明GB处理能较好地保持枇杷果实采后品质,其中以10 mmol/L GB处理效果最好,因此后面的生理代谢分析选用10 mmol/L GB处理。
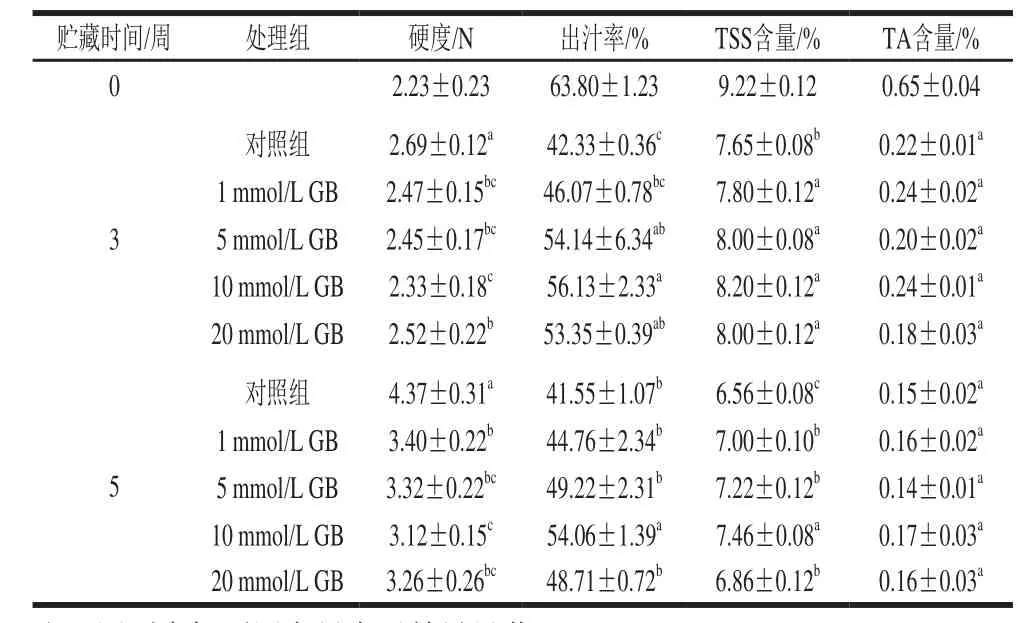
表1 GB处理对冷藏枇杷果实品质指标的影响Table1 Effect of GB treatment on quality parameters in cold-stored loquat fruits
2.2 GB处理对枇杷果实果心褐变的影响
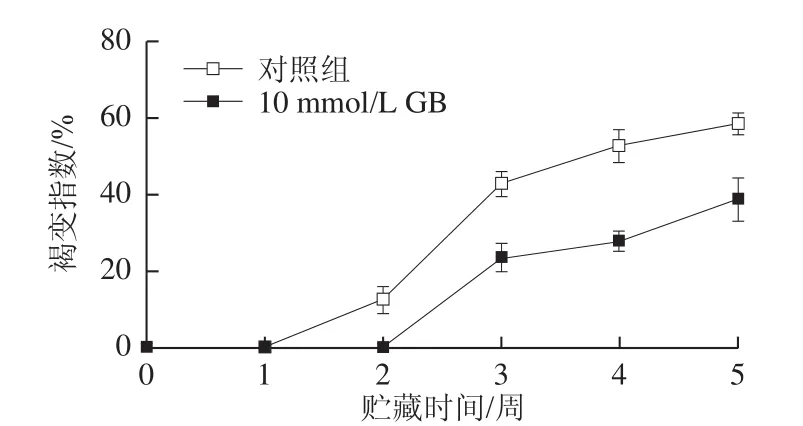
图1 GB处理对枇杷果实果心褐变的影响Fig.1 Effect of GB treatment on internal browning index in cold-stored loquat fruits
枇杷果实在1℃条件贮藏2 周后开始出现果心褐变症状,并且随着贮藏时间延长而不断上升。如图1所示,10 mmol/L GB处理显著抑制了果心褐变指数的上升(P<0.05),在贮藏3 周和5 周后,对照组果实果心褐变指数分别达到42.6%和58.3%,而经过GB处理的枇杷果实褐变指数仅为23.5%和38.6%。这表明GB处理有效地减缓了枇杷果实采后冷害的发生,从而延长果实贮藏寿命。
2.3 GB处理对枇杷果实相对电导率和MDA含量的影响
如图2所示,枇杷果实相对电导率和MDA含量在贮藏过程中不断增加,10 mmol/L GB处理显著抑制了相对电导率的上升(P<0.05),从而保持了细胞膜良好的完整性。MDA为细胞膜脂过氧化产物,在枇杷果实采后冷害过程中,其含量不断增加。从图2B可以看出,GB处理有效抑制了MDA的积累,表明GB处理对减轻枇杷果实细胞膜损伤起到了有效作用,这与GB处理减轻了果实的冷害密切相关。
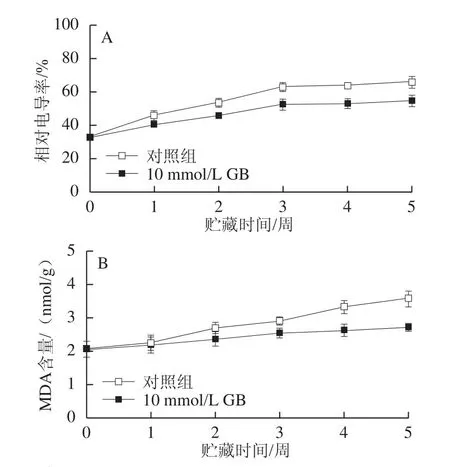
图2 GB处理对枇杷果实相对电导率(A)和MDA含量(B)的影响Fig.2 Effect of GB treatment on electric conductivity (A) and MDA content (B) in cold-stored loquat fruits
2.4 GB处理对枇杷果实CAT、APX、SOD活性的影响
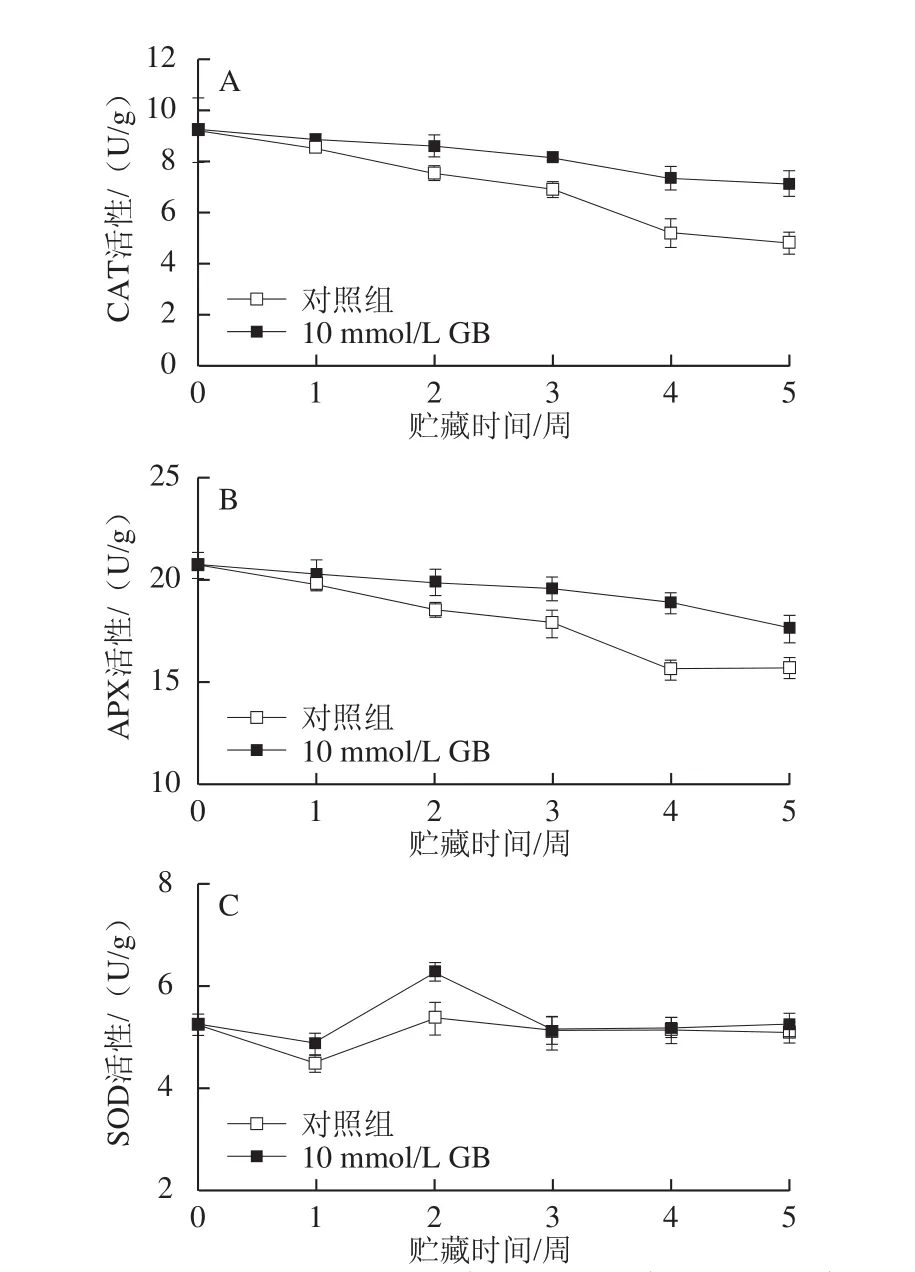
图3 GB处理对枇杷果实CAT(A)、APX(B)和SOD(C)活性的影响Fig.3 Effect of GB treatment on catalase activity (A), ascorbate peroxidase activity (B) and superoxide dismutase activity (C) in cold-stored loquat fruits
CAT、APX和SOD是果实组织中清除活性氧自由基的抗氧化酶类。枇杷果实在1℃贮藏期间,CAT活性逐渐下降(图3A),APX活性呈缓慢降低趋势(图3B),而SOD活性在贮藏第2周上升随后下降(图3C)。10 mmol/L GB处理显著保持了较高的CAT和APX活性。贮藏5 周后,GB处理的枇杷果实CAT和APX活性分别比对照果实高47.3%和12.2%。GB处理在贮藏第2周明显诱导提高了SOD活性(P<0.05),在贮藏第3周后,处理果实与对照果实SOD活性无显著差别。
2.5 GB处理对枇杷果实O2-·产生速率和H2O2含量的影响
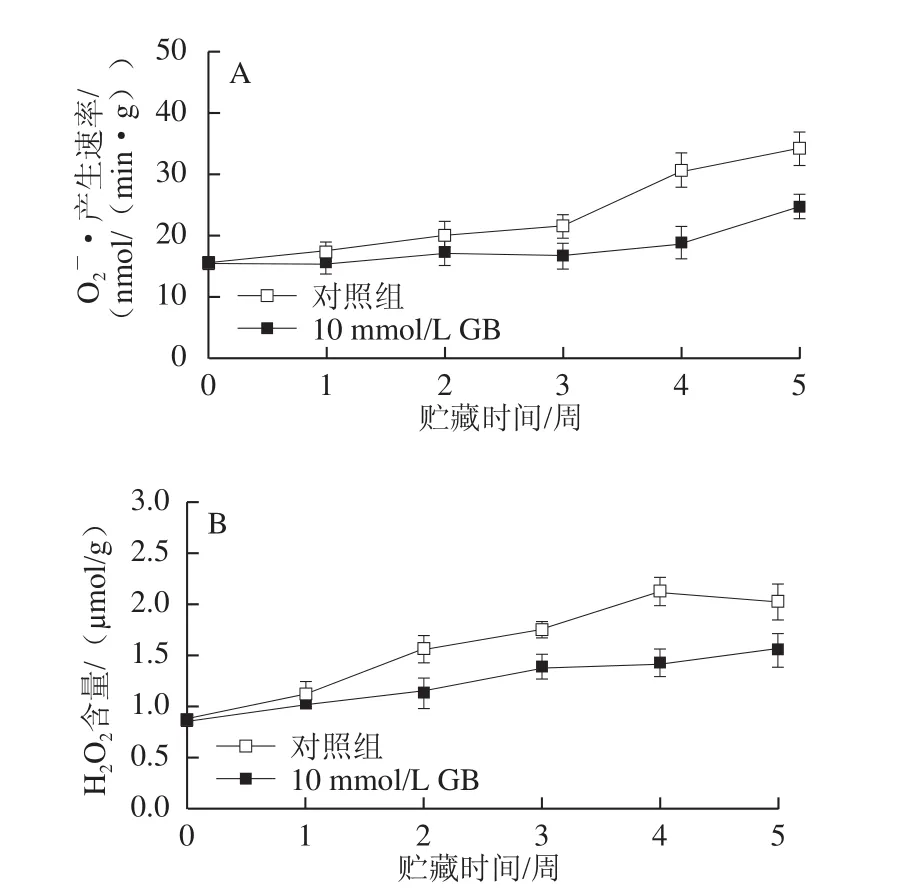
图4 GB处理对枇杷果实O-·产生速率(A)和HO含量(B)的影响222Fig.4 Effect of GB treatment on superoxide anion radical generation rate (A) and H2O2 content (B) in cold-stored loquat fruits
由图4可以看出,O2-·产生速率和H2O2含量在整个贮藏期间不断增加,10 mmol/L GB处理可显著抑制O2-·产生速率和H2O2含量的上升(P<0.05),减少这两种活性氧自由基在枇杷果实组织中的积累。枇杷果实贮藏5 周后,GB处理的枇杷果实的O2-·产生速率比对照组果实降低27.6%,H2O2含量比对照组果实降低23.2%。
2.6 GB处理对枇杷果实PPO、POD活性的影响
冷藏枇杷果实中PPO和POD活性随贮藏时间迅速上升,而GB处理能显著抑制这两种酶活性的升高(P<0.05)。在贮藏3 周和5 周后,GB处理的果实PPO活性分别比对照果实低13.1%和9.7%,而POD活性分别对照果实低19.1%和13.8%。由于PPO和POD可将酚类物质氧化为颜色更深的醌类物质,GB处理显著抑制枇杷果心褐变的发生,这与GB抑制了PPO和POD活性有关。
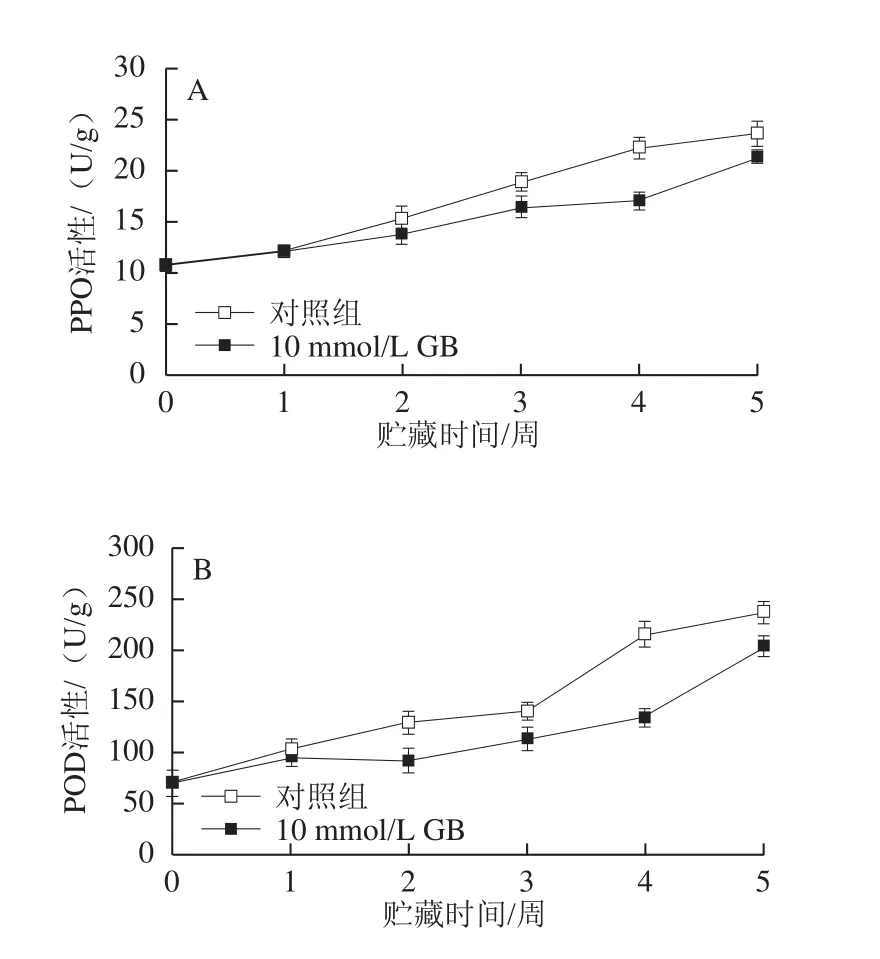
图5 GB处理对枇杷果实PPO(A)和POD(B)活性的影响Fig.5 Effect of GB treatment on polyphenol oxidase activity (A) and peroxidase activity (B) in cold-stored loquat fruits
2.7 GB处理对枇杷果实总酚和总黄酮含量的影响
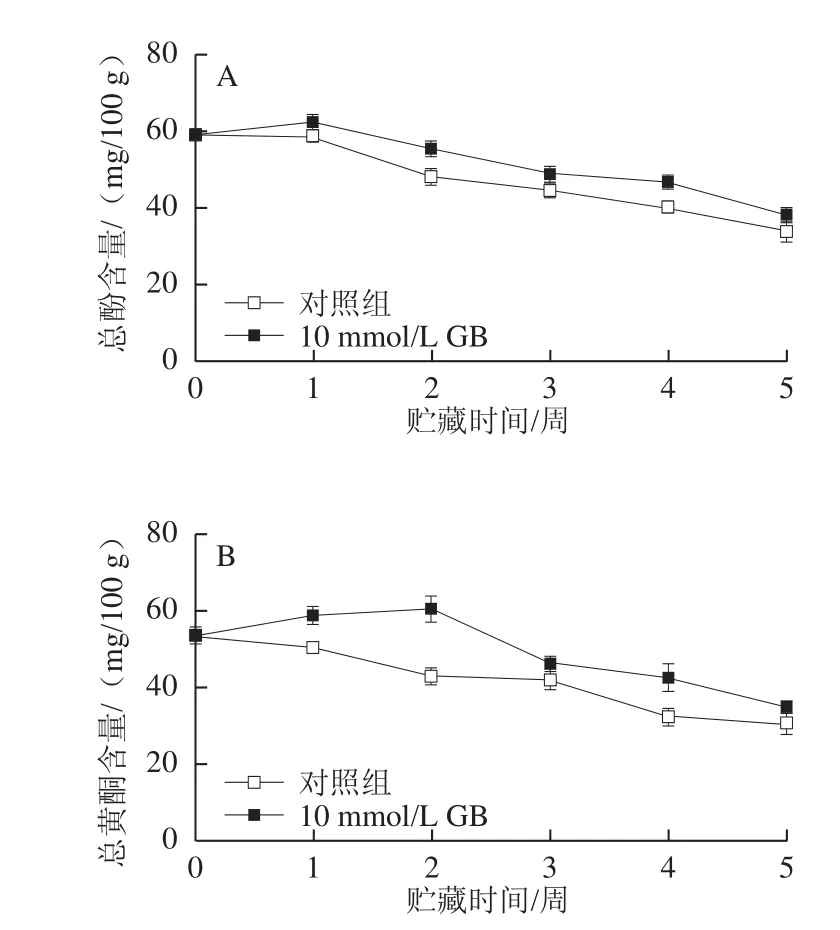
图6 GB处理对枇杷果实总酚含量(A)和总黄酮含量(B)的影响Fig.6 Effect of GB treatment on the contents of total phenolics (A) and total flavonoids (B) in cold-stored loquat fruits
由图6可以看出,枇杷果实的总酚和总黄酮含量随着贮藏时间的延长而逐渐下降。GB处理能显著抑制总酚和总黄酮含量的降低(P<0.05)。在贮藏第3周和5周,GB处理组的枇杷果实中总酚含量分别比对照组果实高9.8%和12.7%,总黄酮含量分别比对照组果实高10.4%和13.7%。这表明GB处理能保持枇杷果实中较高的抗氧化物质含量,对于提高枇杷果实的营养品质有积极作用。
3 讨 论
枇杷属于冷敏性水果,低温贮藏时果实组织易发生冷害,果心褐变是枇杷典型的冷害症状。研究采后处理技术提高枇杷果实对低温环境的抗性是近年来国内外保鲜技术领域的热点。GB作为细胞中重要的渗透调节物质,能提高植物对低温、干旱、高盐等逆境的抗性[3]。在黄瓜果实的研究中发现,外源GB可减轻黄瓜果实的冷害,增强脯氨酸的积累[4]。本研究表明采后GB处理能降低枇杷果实果心褐变发生,保持较好的采后品质。
果蔬组织内具有抗氧化酶体系,能减少O2-·和H2O2等活性氧的大量积累。CAT专一地作用于H2O2,将H2O2分解为水或氧气;APX能够经抗坏血酸-谷胱甘肽循环将H2O2分解为水分子[16],提高细胞抗氧化系统的还原势,从而减轻H2O2对植物造成的氧化伤害;而SOD能通过歧化反应清除O2-·,减少活性氧对细胞膜系统的伤害,这3种酶协调作用,使果实组织中的活性氧代谢保持在平衡状态。已研究证实采后热处理能提高枇杷果实抗氧化酶的活性,可以有效减少冷害的发生[17]。本研究结果表明,GB处理能保持枇杷果实较高的CAT和APX活性,减少活性氧自由基的含量。PPO和POD能氧化酚类物质,主要参与果蔬冷藏期间的褐变。Cai Chong等[18]报道低温预贮可抑制枇杷果实PPO活性,减轻果肉褐变。本研究发现GB处理抑制了枇杷果实PPO和POD活性,这与减轻冷害症状密切相关。
在低温条件的胁迫下,冷敏果实细胞膜首先响应低温胁迫,同时果肉组织发生的活性氧自由基积累,加剧细胞膜脂质过氧化作用。活性氧自由基能造成细胞质膜系统损伤,使细胞膜区域化遭到破坏,膜透性上升,膜脂过氧化产物MDA大量积累[19]。GB可调节细胞渗透势、保持细胞膨压的作用,可以与细胞膜水化层结合,稳定细胞膜的完整性和蛋白质复合物的四级结构[3]。已有研究表明,GB处理能提高草莓[20]和黄瓜[21]幼苗的抗冷性,维持活性氧代谢和渗透压平衡,减少对细胞膜的伤害。苏文潘等[22]研究表明7.5 mmol/L的GB处理能有效延缓香蕉幼苗膜透性的增加。Hayashi等[23]也发现在拟南芥种子的发芽培养基上添加5 mmol/L的GB能减轻低温对其生长的不良影响。此外,GB处理能够提高玉米叶片中可溶性蛋白的含量,增强组织的抗氧化防御作用,减少低温胁迫下氧化损伤导致的冷害[24-25]。本研究发现GB处理能够降低枇杷果实细胞膜渗透率,抑制MDA的积累,这表明GB对维持枇杷果实采后细胞膜的完整性和稳定性具有积极作用,GB通过保护细胞膜结构减轻枇杷果实采后冷害发生。这与王富贵等[26]报道的外源GB抑制黄瓜低温贮藏期间MDA积累的结论相似。这些结果说明采后GB处理主要通过提高枇杷果实冷藏期间抗氧化酶活性,减少活性氧自由基积累,保护细胞膜完整性,延缓膜脂过氧化作用,从而减轻果实的冷害症状。
[1]骆雨农, 姜芸, 郑桦彬, 等.枇杷保鲜技术研究进展[J].农产品加工,2012(8): 118-119.
[2]高雁, 娄恺, 李春, 等.外源甜菜碱与植物抗逆性[J].生物技术, 2009,19(2): 91-93.
[3]许锁链, 柯学, 陈凯, 等.甜菜碱与植物抗逆性机理的研究进展[J].安徽农学通报, 2010, 16(7): 52-53.
[4]张海英, 王有年, 韩涛, 等.外源甜菜碱对黄瓜果实冷藏期间延缓冷害的影响[J].中国农业科学, 2008, 41(8): 2407-2412.
[5]丁天, 庞杰, 王清, 等.外源甜菜碱对辣椒抗冷性的影响[J].广东农业科学, 2012(21): 52-55.
[6]赵世杰, 李德全.植物生理学实验手册[M].北京: 科学出版社, 1999: 305.
[7]ELSTNER E F.Inhibition of nitrite formation from hydroxylammonium-chloride: a simple assay for superoxide dismutase[J].Analytical Biochemistry, 1976, 70: 616-620.
[8]PATTERSON B D, MACRAE E A, FERGUSON I B.Estimation of hydrogen peroxide in plant extracts using titanium[J].Analytical Biochemistry, 1984, 139: 487-492.
[9]SLINKARD K, SINGLETON V L.Total phenol analysis: automation and comparison with manual methods[J].Ameircan Journal Enology and Viticulture, 1977, 28: 49-55.
[10]弓志青, 刘春泉, 李大婧.不同品种板栗贮藏过程中总酚与抗氧化活性研究[J].中国食品学报, 2011, 11(1): 45-50.
[11]CAKMAK I, STRBOE D, MARSCHNER H.Activities of hydrogen peroxide-scavenging enzymes in germinating wheat seeds[J].Journal of Experimental Botany, 1993, 44: 127-132.
[12]NAKANO Y, ASADA K.Hydrogen peroxide is scavenged by ascrobate specific peroxidase in spinach chloroplasts[J].Plant and Cell Physiology, 1989, 22: 867-880.
[13]RAO M V, PALIYATH G, ORMROD D P.Ultraviolet-B and ozoneinduced biochemical changes in antioxidant enzymes of Arabidopsis thaliana[J].Plant Physiology, 1996, 110: 125-136.
[14]MURR D P, MORRIS L L.Influence of O2and CO2on odiphenol oxidase activity in mushrooms[J].Journal of American Society for Horticultural Science, 1974, 99: 155-158.
[15]KOCHBA J, LAVEE S, SPIEGE R P.Difference in peroxidase activity and isoenzymes in embryogenic and non-embryogenic‘Shamouti’ orange ovular callus lines[J].Plant and Cell Physiology,1977, 18: 463-467.
[16]GARA L D, de PINTO M C, TOMMASI F.The antioxidant systems reactive oxygen species during plant-pathogen interaction[J].Plant Physiology and Biochemistry, 2003, 41(10): 863-870.
[17]芮怀瑾, 尚海涛, 汪开拓, 等.热处理对冷藏枇杷果实活性氧代谢和木质化的影响[J].食品科学, 2009, 30(14): 304-308.
[18]CAI Chong, XU Changjie, LI Xian, et al.Low temperature conditioning reduceds postharvest chilling injury in loquat fruit[J].Postharvest Biology and Technology, 2006, 41: 252-259.
[19]CAO Shifeng, ZHENG Yonghua, WANG Kaituo, et al.Methyl jasmonate reduces chilling injury and enhances antioxidant enzyme activity in postharvest loquat fruit[J].Food Chemistry, 2009, 115(4):1458-1463.
[20]RAJASHEKAR C B, ZHOU H, MARCUM K B, et al.Glycine betaine accumulation and induction of cold tolerance in strawberry(Fragaria×anan-assa Duch.) plants[J].Plant Science, 1999, 148:175-183.
[21]李芸瑛, 梁广坚, 李永华, 等.外源甜菜碱对黄瓜幼苗抗冷性的影响[J].植物生理学通讯, 2004, 40(6): 673-676.
[22]苏文潘, 李茂富, 黄华孙.甜菜碱对低温胁迫下香蕉幼苗细胞膜保护酶活性的影响[J].广西农业科学, 2005, 36(1): 21-23.
[23]HAYASHI H, ALIA A, SAKAMOTO A, et al.Enhanced germination under high-salt conditions of seeds of transgenic Arabidopsis with a bacterial gene for choline oxidase[J].Journal of Plant Research, 1998,111: 357-362.
[24]FAROOQ M, AZIZL T, HUSSAIN M, et al.Glycine betaine improves chilling tolerance in hybrid maize[J].Journal of Agronomy and Crop Science, 2008, 194: 152-160.
[25]HOQUE M A, BANU M N, NAKAMURA Y, et al.Proline and glycine betaine enhance antioxidant defense and methylglyoxal detoxification systems and reduce NaCl-induced damage in cultured tobacco cells[J].Journal of Plant Physiology, 2008, 165: 813-824.
[26]王富贵, 韩涛, 张海英, 等.外源甜菜碱处理对黄瓜冷藏期间活性氧代谢的影响[J].食品科学, 2013, 34(8): 313-316.
