正加速度暴露后大鼠心室肌LC3发生高表达变化
2014-01-27赵疆东王永春孙喜庆第四军医大学航空航天医学系航空航天生物动力学教研室陕西西安7003空军航空医学研究所北京004
赵疆东,王永春,石 菲,詹 皓,孙喜庆第四军医大学 航空航天医学系航空航天生物动力学教研室,陕西西安 7003;空军航空医学研究所,北京 004
现代高性能战斗机在机动飞行中所产生的正加速度(+Gz)具有G值高、增长率快、持续时间长并可反复出现等特点,其加速度过载已超出飞行员的生理耐受限度,成为威胁飞行人员生命安全的主要因素[1]。在航空飞行中,+Gz对飞行员机体各个系统均产生不良影响,尤其是对心脑系统的影响最为显著[2]。研究表明,+Gz暴露可造成大鼠心室肌超微结构损伤,能量代谢紊乱,左心室收缩功能明显下降并可引起大鼠心室肌细胞凋亡[3-4]。自噬是凋亡之外的第二种程序性细胞死亡方式,在进化中高度保守,从酵母、果蝇到脊椎动物和人都可以找到参与自噬的同源基因[5]。微管相关蛋白轻链3(LC3)是自噬反应过程中的标志性蛋白之一[6]。自噬与凋亡之间存在交互影响,且都在细胞存亡方面起重要作用。阻断凋亡能使细胞从凋亡转到自噬性细胞死亡,过度自噬极度损害大量蛋白和细胞器,导致细胞死亡[7]。以往研究已证实,+Gz暴露可引起大鼠心室肌凋亡蛋白表达的增高,然而,+Gz暴露是否可引起心室肌细胞自噬的激活及其作用尚未见报道[4]。本文采用RT-PCR和Western blot方法,观察了+Gz暴露后大鼠左心室肌中自噬相关基因LC3的表达变化,旨在为进一步研究自噬在+Gz暴露致心室肌损伤中的作用提供理论依据。
对象和方法
1 实验动物及模型建立 健康成年雄性SD大鼠(由第四军医大学实验动物中心提供)18只,8周龄,体质量(198.0±18.02) g。随机分为对照组(6只)和+10 Gz 5min暴露组(12只)。暴露组分别于+Gz暴露后6 h和24 h时取大鼠心室肌组织进行检测。
2 +Gz暴露方法 采用动物离心机进行+Gz暴露。大鼠置于自制的有机玻璃盒中(内径13 cm×4 cm×3 cm),头朝向离心机轴心,玻璃盒固定于离心机上。离心机半径为2 m,由计算机进行加速度程序控制。+Gz组大鼠暴露条件:G值为+10 Gz,增长率为1 G/s,峰值作用时间均为5 min。对照组大鼠置于离心机室,但不受加速度作用。
3 RT-PCR检测LC3 mRNA的表达 利用Trizol提取试剂盒提取各组大鼠心室肌组织总RNA,并检测浓度及纯度。运用TaKaRa反转录试剂盒进行RT-PCR反应将总RNA反转录成cDNA,再进行PCR反应检测mRNA表达,引物序列见表1,反应体系为:94℃,30 s;54℃,50 s;72℃,1 min,共35个循环。将PCR产物进行琼脂糖凝胶电泳检测。柱形图中将对照组LC3/GAPDH的比值设为1。
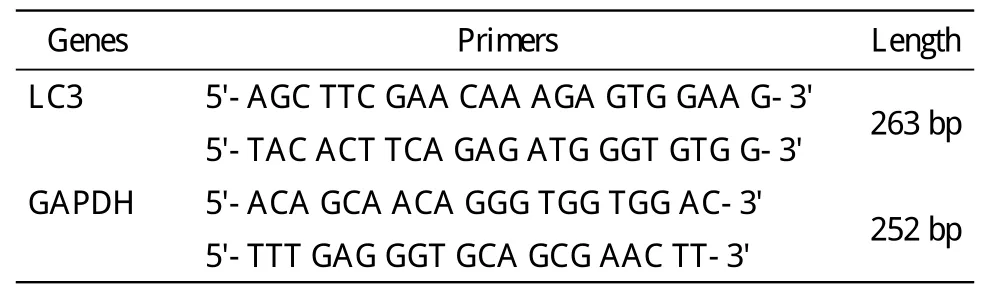
表1 RT-PCR引物序列Tab. 1 Primer sequences for RT-PCR
4 Western blot检测LC3 蛋白表达 利用RIPA裂解液提取各组大鼠心室肌组织蛋白,用BCA试剂盒进行蛋白定量,常规SDS-PAGE电泳、转膜和封闭后加入LC3抗体(1∶1 000),4℃孵育过夜。TBST洗膜,再加入HRP标记的二抗(1∶5 000),37℃孵育1 h,最后采用ECL化学发光法进行发光,经凝胶成像系统扫描目的条带后分析。以GAPDH作为内参照。柱形图中将对照组(LC3-Ⅱ/LC3-Ⅰ)/GAPDH的比值设为1。
5 统计学分析 相同条件的实验均重复3次,采用Graphpad Prism软件进行结果分析,根据RT-PCR和Western blot结果中各目的条带及内参照的灰度值计算比值。实验数据以-x±s表示,采用SPSS17.0软件进行统计学分析处理,单因素方差分析(One-Way,ANOVA),P<0.05为差异有统计学意义。
结 果
1 +Gz暴露后大鼠心室肌组织LC3 mRNA的表达变化 与对照组相比,+10 Gz暴露后6 h大鼠心室肌组织LC3 mRNA的表达显著增加(P<0.01),暴露后24 h其表达量仍显著增加(P<0.01)。见图1。此结果表明,高+Gz暴露可促使心室肌自噬相关基因LC3 mRNA的表达增加,且暴露后24 h自噬表达仍然显著。
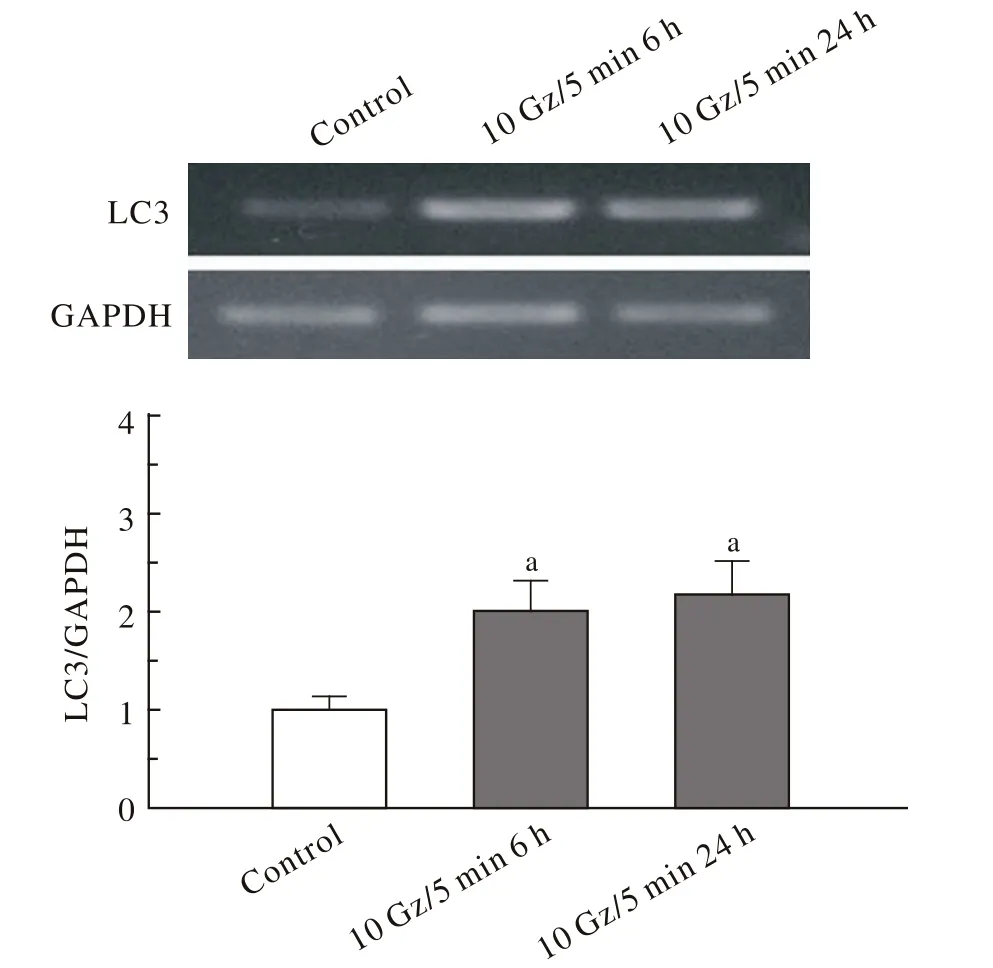
图 1 + Gz暴露后大鼠心室肌组织LC3 mRNA的表达Fig. 1 Expression of LC3 m RNA in ventricular muscle tissue sample from rats after exposure to +Gz(a P<0.01, vs control group)
2 +Gz暴露后大鼠心室肌组织LC3蛋白的表达变化 与对照组相比,+10 Gz暴露后6 h大鼠心室肌组织LC3蛋白的表达显著增加(P<0.05),暴露后24 h其表达量仍显著增加(P<0.05)。见图2。+Gz暴露后LC3蛋白的表达变化与LC3 mRNA的检测结果基本一致,表明+Gz暴露可能诱导大鼠心肌自噬的激活。
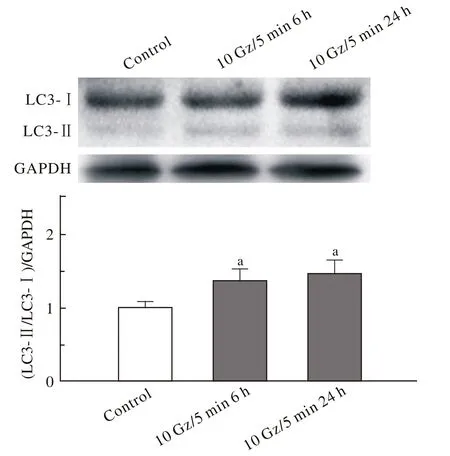
图 2 +Gz暴露后大鼠心室肌组织LC3蛋白的表达Fig. 2 Exp ression of LC3 p rotein in ven tricu lar m uscle tissue sample from rats after exposure to +Gz(a P<0.01, vs control group)
讨 论
持续性+Gz暴露对机体影响广泛,它对人体的循环系统、呼吸系统和神经系统等都有着不同程度的损害[8]。孙喜庆等[9]研究发现,+Gz可使麻醉兔心脏泵血功能显著降低,且随着G值的升高,其变化越大。周瑛等[3-4]研究表明,+6 Gz/3 min重复暴露1周可引起大鼠心室肌超微结构轻微改变,表现为心室肌肌丝排列基本整齐,肌浆网轻度扩张,细胞连接扩大,间质水肿,微血管扩张;而+10 Gz/3 min重复暴露1周可造成大鼠心室肌超微结构的明显改变,表现为心室肌细胞水肿,核内异染色质边集,肌浆网明显扩张,线粒体反应性增生,空泡化,闰盘连接完全破坏,并可引起大鼠心肌细胞凋亡。
近年来的研究表明,自噬参与许多心脏疾病的发生和进展过程,如心室肌肥大、心室肌细胞凋亡、心室肌缺血/再灌注损伤、心室肌细胞重塑、扩张性心肌病等[10-12]。自噬是凋亡之外的第2种程序性细胞死亡方式,在进化中高度保守,它是指从粗面内质网的无核糖体附着区脱落的双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢需要和某些细胞器的更新。自噬在饥饿、缺氧、细胞内应激、激素或生长发育信号等条件下均可诱导产生[13]。在疾病的不同阶段,自噬发挥着不同的作用,或保护心脏,或促进疾病的发展,这与自噬发生的基因调控机制密切相关[14-15]。
自噬和凋亡均可引起细胞死亡,两者之间存在交互影响。自噬可通过降解受损蛋白、减弱DNA损伤等途径抑制凋亡[16]。同时,自噬又能为凋亡小体的形成和吞噬作用提供能量,从而促进凋亡的发生[17]。本课题组以往研究已发现+Gz暴露可引起大鼠心室肌细胞凋亡,但+Gz暴露后是否会发生心室肌自噬及其在心室肌损伤中的作用尚未见任何报道。
本实验观察了+Gz暴露后大鼠心室肌自噬相关基因LC3的表达变化,结果表明,+10 Gz/5 min暴露后6 h大鼠心室肌组织LC3的表达显著增加,暴露后24 h其表达量仍然显著增加。结果提示,高+Gz可能诱导大鼠心室肌自噬的激活。其原因可能与+Gz暴露引起的剧烈血流动力学变化、心脏机械牵张和强烈的应激反应等因素有关。+Gz暴露时,全身血液向下半身转移,心脏和大血管向下移位、变形,并且血液充盈度明显减少,心室肌收缩力减弱,每搏量减少,心率增快,心脏做功量大大增加,而冠状动脉供血相对不足,最终引起心输血量减少,主动脉压下降,心脏供血不足[18]。然而,有关+Gz引起自噬发生的机制还有待进一步研究。
总之,本研究表明,+10 Gz/5 min暴露可诱导大鼠心室肌自噬相关基因LC3的高表达,提示高+Gz应激可能诱导了心室肌自噬的激活。有关自噬在+Gz致心脏损伤中的作用尚需深入探索。
1 孙喜庆.航空航天生物动力学[M] .西安:第四军医大学出版社,2005:31-32.
2 Chen LE, Wu F, Xin Y, et al. Effect of high sustained +Gz stress on myocardial mitochondrial ultrastructure, respiratory function, and antioxidant capacity in rats[J]. J Physiol Sci, 2013, 63(6):457-464.
3 周瑛,孙喜庆,王冰,等.重复+Gz暴露后大鼠心室肌的形态学改变[J].中华航空航天医学杂志,2006,17(4):257-259.
4 周瑛,王冰,王永春,等.重复+Gz暴露后大鼠心室肌的细胞凋亡现象[J].中国应用生理学杂志,2010,26(3):275-277.
5 Levine B, Klionsky DJ. Development by self-digestion : molecular mechanisms and biological functions of autophagy[J]. Dev Cell,2004, 6(4): 463-477.
6 Shibata M, Yoshimura K, Tamura H, et al. LC3, a microtubuleassociated protein1A/B light chain3, is involved in cytoplasmic lipid droplet formation[J]. Biochem Biophys Res Commun, 2010, 393(2): 274-279.
7 杨乐,邹晓静.心肌自噬研究进展[J].内科急危重症杂志,2010,16(5):265-268.
8 郑军,巴特金,付兆君,等.反复+Gz暴露对自发性高血压大鼠靶器官损害的组织学观察[J].解放军医学院学报,2013,34(9):950-952,956.
9 孙喜庆, 蔡建辉, 刘勇, 等. +Gz作用下兔心脏功能的改变[J].航天医学与医学工程, 1997, 10(4):250-253.
10 Kanamori H, Takemura G, Goto K, et al. The role of autophagy emerging in postinfarction cardiac remodelling[J]. Cardiovasc Res,2011, 91(2): 330-339.
11 Shimomura H, Terasaki F, Hayashi T, et al. Autophagic degeneration as a possible mechanism of myocardial cell death in dilated cardiomyopathy[J]. Jpn Circ J, 2001, 65(11): 965-968.
12 De Meyer GR, Martinet W. Autophagy in the cardiovascular system[J]. Biochim Biophys Acta, 2009, 1793(9):1485-1495.
13 Yan L, Vatner DE, Kim SJ, et al. Autophagy in chronically ischemic myocardium[J]. Proc Natl Acad Sci U S A, 2005, 102(39):13807-13812.
14 Zhao Y, Xue T, Yang X, et al. Autophagy plays an important role in sunitinib-mediated cell death in H9c2 cardiac muscle cells[J].Toxicol Appl Pharmacol, 2010, 248(1): 20-27.
15 Gustafsson AB, Gottlieb RA. Autophagy in ischemic heart disease[J].Circ Res, 2009, 104(2):150-158.
16 Bernales S, McDonald KL, Walter P. Autophagy counterbalances endoplasmic reticulum expansion during the unfolded protein response[J]. PLoS Biol, 2006, 4(12):e423.
17 Inbal B, Bialik S, Sabanay I, et al. DAP kinase and DRP-1 mediate membrane blebbing and the formation of autophagic vesicles during programmed cell death[J]. J Cell Biol, 2002, 157(3): 455-468.
18 郑军,肖晓光,姚克纯,等.不同水平+GZ暴露后飞行员心脏功能的变化[J].中华航空航天医学杂志,2004,15(2):65-69.
