PRRSV对I型IFN的调节作用研究进展
2014-01-20杨宗照
杨宗照
(浙江省杭州市畜牧兽医局,浙江杭州 310020)
PRRSV对I型IFN的调节作用研究进展
杨宗照
(浙江省杭州市畜牧兽医局,浙江杭州 310020)
猪繁殖与呼吸综合征病毒(PRRSV)是近年来发现的严重危害养猪业的一种病原,在猪体内它常以持续感染的形式存在。干扰素(IFN)特别是I型干扰素在抗病毒方面起重要作用,它的产生主要分为TLR等几个途径。论文综述PRRSV对I型IFN的产生途径的调节作用,即对TLR依赖性、RIG与MDA5依赖性、JAKSTAT等干扰素信号转导途径、细胞凋亡途径的抑制和对NF-κB的上调或下调作用。
IFN;PRRSV;免疫调节
猪繁殖与呼吸综合征病毒(PRRSV)引起猪繁殖与呼吸障碍,它在猪体内常以持续感染的形式存在。该病毒基因组为单股正链RNA,全长15 kb,包含ORF1a、ORF1b、ORF2a、ORF2b、ORF3~7、ORF5a。其中ORF1a、ORF1b编码2个大的多聚蛋白:pp1a、pp1a/b,它们被酶解为14个非结构蛋白(Nsp)。ORF2a、ORF2b、ORF3~7、ORF5a编码8个结构蛋白:糖蛋白GP2、E、GP3、GP4、GP5、M、N、ORF5a蛋白[1]。
干扰素(IFN)是机体抵抗病毒感染的一种重要细胞因子。通过对IFN产生过程的调节是病毒逃避宿主抗病毒感染反应的一种途径。
1 干扰素的分类和信号转导途径
IFN通常分为I、II型。I型是其中起抗病毒作用的主力,并分为许多亚型。人I型IFN分为IFN-α、IFN-β、-ω、-κ、-ε。II型干扰素只有IFN-γ。最近还发现了III型干扰素,IFN-λ。IFN的产生需要一系列的信号转导途径,刺激IFN的转录表达,最终产生IFN蛋白。这些途径最初步骤需要病原等异物上的配体与宿主细胞上的受体相互识别。受体主要有Toll样受体(TLR)、视黄酸(维甲酸)诱导基因蛋白I(RIG-I)样受体,前者分布在一些细胞和细胞器的表面,后者分布在细胞质中。TLR又分为13种,其中TLR3、-7、-8、-9对于控制病毒感染的作用最大,不同的受体识别不同的抗原。
I型干扰素的产生主要分为4条信号转导途径[2]:TLR3依赖性信号转导;TLR4依赖性信号转导;TLR7、-9依赖性信号转导;RIG-I和MDA-5(黑色素瘤分化相关蛋白)依赖性信号转导。这些途径的差别主要在起始阶段。
2 PRRSV对干扰素产生途径的调节
PRRSV感染后以一种低病毒含量的形式持续存在,在持续感染后期,病毒复制被限制在淋巴组织和其他一些免疫器官如扁桃体、淋巴结等,也可以在公猪精子中持续存在。病毒持续存在一般与免疫反应过差有关,包括中和抗体的产生和先天性免疫反应。
在PRRSV感染后猪没有典型的I型IFN反应,感染猪的IFN-α含量很低。尽管肺泡内PRRSV复制比较活跃,但是IFN-α在感染猪的肺内检测不出来。IFN的抑制在MARC-145和猪肺泡巨噬细胞(PAM)上表现也很明显,PRRSV抑制IFN主要是抑制了RIG-I途径中的IPS-1(干扰素启动子促进因子-1)[3]。
2.1 PRRSV与TLR
TLR3、TLR7对PRRSV比较重要。TLR3在肾、十二指肠、脾、肝中高度表达,而TLR7在骨髓、肠、脾、肝、肺、肠系膜淋巴结、气管、胸腺、肾脏和皮肤中适度表达。TLR9在猪派伊尔小结中表达,单核树突状细胞中也可以表达。在没有刺激的情况下,PAM细胞TLR3、TLR7、TLR8表达量比骨髓来源的未成熟树突状细胞(immaturedendriticcells,imDC)高。poly(I:C)刺激PAM可以促进TLR3表达,但是抑制TLR7、TLR8的表达。PRRSV在感染imDC细胞6h时下调TLR3、TLR7、TLR8,在24hpi后恢复正常[4]。有研究表明,在MARC-145上,用双链RNA激发TLR3大量表达则PRRSV被抑制,相反用小干扰RNA抑制TLR3的表达增加了PRRSV的感染量,可见TLR3对于抗PRRSV感染有重要作用。
2.2 PRRSV与RIG、MDA5途径
PRRSV可以激发NF-κB和AP-1,但是不激发IRF-3(干扰素调节因子3),显著阻止合成的双链RNA诱导的IFN-β。进一步的试验表明,PRRSV感染显著灭活IPS-1(RIG-I的配体);相比而言PRRSV感染只是部分降低了TRIF(TLR3的特异性衔接蛋白),说明PRRSV对RIG途径的影响很大[3]。
PRRSV的4种Nsp有抑制活力:Nsp1、Nsp2、Nsp4、Nsp11。Nsp1含有最强的抑制IFN-β启动子的能力,其抑制机制部分上是由于它促进核内CBP(CREB结合蛋白)的降解,抑制了IRF3与CBP的结合,这样破坏了IFN的转录。
Nsp2也下调I型IFN,Nsp2是个膜锚定蛋白,含有半胱氨酸蛋白酶(CP)活力和一种解离活力, CP活力抑制了IRF3磷酸化和核移位,解离活力是它对ISG和NF-κB有作用。
Nsp11也参与了RIG-I信号抑制,与Nsp1存在于胞浆和核仁不同的是,Nsp11的表达主要在胞浆,表明它的主要功能在胞浆。Nsp11含有一个叫做NendoU结构域,有内切酶功能。NendoU包含有2个亚基,A和B。A为功能基, B为维持Nsp11构象的基团。Nsp11阻止了IRF3和Iκ-B的磷酸化,这导致IRF3和NF-κB核转移的抑制,从而IFN的产生被抑制。在Nsp11表达的细胞和PRRSV感染细胞内IPS-1被降解了,这很可能是Nsp11对IRF3和NF-κB起作用的基础。(图1)。
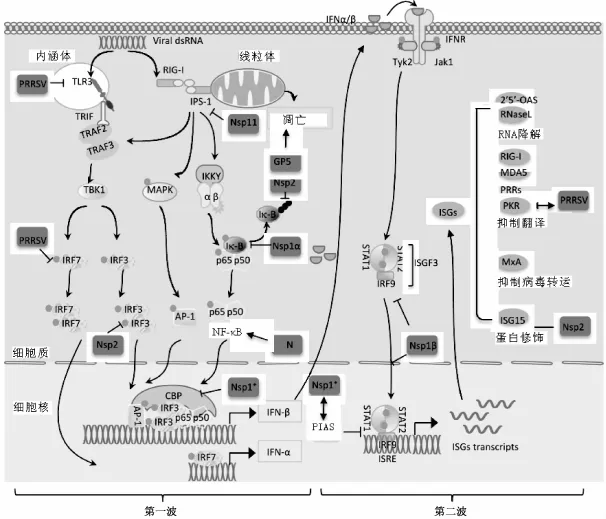
图1 PRRSV对IFN产生的调节作用
2.3 PRRSV与NF-κB
2.3.1 上调NF-κB
NF-κB不但在免疫方面起作用,还调节细胞增殖和生存。病毒往往阻止NF-κB的激活来逃避宿主免疫,但是有研究表明在PRRSV感染后36~48 hNF-κB会上调,其作用与活病毒含量、复制相关。因为紫外线灭活不会上调此反应,PRRSV感染猪浆细胞样树突状细胞后再用猪传染性胃肠炎病毒(TGEV)刺激与只用TGEV刺激相比PRRSV促进了NF-κB的磷酸化。NF-κB被激活可能会有利于使病毒复制和宿主细胞增殖与凋亡的调控达到一种平衡状态[5]。
PRRSVN蛋白可以激活NF-κB,并呈现剂量依赖性,N蛋白30~73处氨基酸是激活NF-κB作用功能区,并分布着核定位区和核仁定位区,核定位区对N形成同源二聚体也很重要,N-N二聚体可以嵌入NF-κB激活结构域中,这意味着N-N二聚体可能与NF-κB激活相关。
2.3.2 Nsp1α、Nsp2对NF-κB的下调作用
Nsp1α能够抑制NF-κB的激活。Nsp1α可以抑制Iκ-Bα的磷酸化,阻止TNFα引起的NF-κB核转移。Nsp1α是Nsp1的N端,含有木瓜蛋白酶样半胱氨酸蛋白酶(PCP酶)的结构域。Shi等[6]通过点突变证实了Zn指结构是抑制IFN-β所必需的。Nsp1α缺失C末端14个氨基酸后(这样第2个Zn指也缺失了),显示不能抑制IFN,因此结果显示Nsp1αZn指结构很可能参与NF-κB途径的抑制。
Nsp2的卵巢肿瘤(ovariantumor,OUT)结构域能够解离泛素或从底物中解离ISG15,因为泛素化与RIG-1和TLR信号有关,像配体蛋白的召集、Iκ-Bα的降解。Nsp2很可能通过它的OTU区抑制I型IFN的产生。Nsp2可以干扰磷酸化的Iκ-B多聚泛素化,引起Iκ-B降解失败,从而下调NF-κB。
2.4 PRRSV抑制JAK-STAT和ISG途径
PRRSV抑制I型IFN信号不只是在IFN产生期,而且是包括IFN分泌后。在MARC-145细胞内,在用ISG15、ISG56mRNA作为指示物显示,感染PRRSV24h后JAK-STAT路径被抑制, PRRSV阻止了ISGF3移到核内。TGEV刺激pDC,发现STAT1的核转移被PRRSV抑制了,起作用的是Nsp1β(不是Nsp1α),它抑制了STAT1的磷酸化和ISGF3的核转移。抑制ISGF3的核转移是因为Nsp1β导致了karyopherin-α1(KPNA1)的降解[7]。ISG15是个泛素样分子,可以可逆地与蛋白结合介导先天性抗病毒免疫。Nsp2OTU结构域有去泛素样活力,OTU可以水解ISG15,阻止ISG15干扰素调节功能。
综合起来,在PRRSV感染的早期,Nsp1、2、11促进病毒基因转录和蛋白翻译,同时抑制I型IFN的产生和IFN的诱导途径。在病毒感染后期(36~48hpi),NF-κB路径被激活来有利于病毒在宿主体内的持续存在。
2.5 凋亡和病毒
IFN与其他细胞因子一起防御着机体,在这个过程中也伴随着宿主细胞程序性死亡和体内病毒量的减少。凋亡细胞在PRRSV感染猪的组织中已经检出,但也有研究表明凋亡细胞不感染PRRSV。有报道GP5蛋白诱导凋亡是通过作用于Bcl-2的下游起作用。凋亡功能区位于GP5蛋白N端(有119个氨基酸)。还有研究提出旁观者细胞发生凋亡,因为根据微阵列法发现与对照相比PRRSV感染只是促进了极小的促凋亡基因转录发生。使用猪肺泡巨噬细胞和单核来源的树突状细胞显示是病毒感染的时期决定了PRRSV感染细胞是走向凋亡还是抑制凋亡,感染后8h倾向于抗凋亡,但是所有的感染细胞最终凋亡和坏死而死亡。病毒蛋白的表达是诱导强烈的抗凋亡作用的必需因素。非结构蛋白可能也参与其中,因为在巨噬细胞中结构蛋白能检出前抗凋亡效果已经存在[8]。I型IFN产生和细胞凋亡都是机体对抗病毒的防御机制,并有一些共同途径,因此PRRSV可能主动干扰凋亡,部分机制可能是由于它抑制了I型IFN的产生,尤其是在PRRSV感染的早期阶段。
IPS-1是I型IFN诱导和细胞凋亡的共同步骤,它既能导致I型IFN表达,也能与线粒体作用,促进细胞凋亡。Nsp11能降解IPS-1mRNA,从而引起I型IFN诱导的抑制,但还不知道IPS-1降解是否也抑制细胞凋亡。SARS-CoVNsp15(PRRSV Nsp11内切酶的同源物),可以抑制IPS-I诱导的凋亡,推测PRRSVNsp11也可抑制凋亡。
3 小结与展望
先天免疫尤其是I型IFN信号路径是宿主对抗病毒感染的第一道防线,PRRSV通过对IFN多个环节的调节(包括调控TLR、IRG-I及JAKSTAT介导的I型IFN产生的信号路径及凋亡)来达到利于其在宿主体内生长的目的。N蛋白显示激活NF-κB路径,这与它的核定位功能、二聚体化有关。Nsp1、2、11与病毒干扰免疫调节有关,它们生物学功能的结构域或基序也有了研究。Nsp1在核内干扰IRF3介导的IFN的产生,在胞浆中干扰NF-κB路径。Nsp1亚单位Nsp1β通过在不同细胞类型中封闭不同的反应步骤抑制JAK-STAT路径。Nsp2通过其PCP2活性封闭了IRF3的活化,抑制Iκ-B降解,通过OTU结构域减少泛素化和ISG化。Nsp11通过NendoU结构域降解IPS-1 mRNA,阻止下游IRF3和NF-κB的活化。GP5蛋白促进了细胞的凋亡。
高致病性蓝耳病毒株感染猪PAM细胞中TLR3、7、8mRNA的量比普通毒株明显升高[9]。用pDC细胞,不同的PRRSV分离株在对下调IFN的能力不同[10]。如在不同的细胞类型上,诱导IFN-β有明显的差异。长白猪上来源的PAM与其他品种猪相比抑制或者延迟了PRRSV的生长。
PRRSV毒力与免疫调节的关系比较复杂导致控制该病比较困难,IFN活性调节位点的鉴别和使用突变的PRRSV感染性克隆来去除该病毒引起的免疫抑制功能也许是研制更加有效PRRSV疫苗的途径之一。
[1] DeaS,GagnonCA,MardassiH,etal.Currentknowledgeonthe structuralproteinsofporcinereproductiveandrespiratorysyndrome(PRRS)virus:ComparisonoftheNorthAmericanandEuropean isolates[J].ArchVirol,2000,145(4):659-688.
[2] 徐歆,余东游,李卫芬.I型干扰素诱生机理的研究进展[J].中国预防兽医学报,2010,32(10):824-828.
[3] LuoR,XiaoS,JiangY,etal.Porcinereproductiveand respiratorysyndromevirus(PRRSV)suppressesinterferon-beta productionbyinterferingwiththeRIG-Isignalingpathway[J]. MolImmunol,2008,45(10):2839-2846.
[4] ChaungHC,ChenCW,HsiehBL,etal.Toll-LikeReceptor expressionsinporcinealveolarmacrophagesandDendriticCells inrespondingtopolyICstimulationandporcinereproductive andrespiratorysyndromevirus(PRRSV)infection[J].Comp ImmunolMicrobiolInfectDis,2010,33(3):197-213.
[5] Calzada-NovaG,SchnitzleinWM,Husmann,RJ,etal. NorthAmericanporcinereproductiveandrespiratorysyndrome virusesinhibittypeIinterferonproductionbyplasmacytoid dendriticcells[J].JVirol,2011,85(6):2703-2713.
[6] ShiX,ZhangX,WangF,etal.Thezinc-fingerdomainwas essentialforporcinereproductiveandrespiratorysyndromevirus nonstructuralprotein-1αtoinhibittheproductionofinterferon-β[J].JInterferonCytokineRes,2013,33(6):328-334.
[7] WangR,NanY,YuY,etal.Porcinereproductiveand respiratorysyndromevirusNsp1βinhibitsinterferon-activated JAK/STATsignaltransductionbyinducingkaryopherin-α1 degradation[J].JVirol,2013,87(9):5219-5228.
[8] CostersS,LefebvreDJ,DelputtePL,etal.Porcine reproductiveandrespiratorysyndromevirusmodulatesapoptosis duringreplicationinalveolarmacrophages[J].ArchVirol, 2008,153(8):1453-1465.
[9] ZhangL,LiuJ,BaiJ,etal.ComparativeexpressionofTolllikereceptorsandinflammatorycytokinesinpigsinfectedwith differentvirulentporcinereproductiveandrespiratorysyndrome virusisolates[J].VirolJ,2013,10(1):135.
[10] BaumannA,MateuE,MurtaughMP,etal.Impactof genotype1and2ofporcinereproductiveandrespiratory syndromevirusesoninterferon-αresponsesbyplasmacytoid dendriticcells[J].VetRes,2013,44(1):33.
(责任编辑:卢福庄)
S852
A
0528-9017(2014)02-0281-03
文献著录格式:杨宗照.PRRSV对I型IFN的调节作用研究进展[J].浙江农业科学,2014(2):281-283,287.
2013-12-18
杨宗照(1973-),男,河南南召人,高级兽医师,主要从事动物疫病实验室诊断与研究工作。
