马齿苋多糖对高脂饮食联合链脲佐菌素诱导的糖尿病小鼠的作用及机制
2014-01-18张传军吕艳荣
梁 彦,张传军,吕艳荣
(1.吉林农业科技学院食品工程学院,吉林 吉林 132101;2.吉林省扶余县环境保护局,吉林 松原 131200)
马齿苋多糖对高脂饮食联合链脲佐菌素诱导的糖尿病小鼠的作用及机制
梁 彦1,张传军1,吕艳荣2
(1.吉林农业科技学院食品工程学院,吉林 吉林 132101;2.吉林省扶余县环境保护局,吉林 松原 131200)
目的:研究马齿苋多糖对高脂饮食联合链脲佐菌素诱导的糖尿病小鼠模型的作用及其机制。方法:采用高脂饮食联合链脲佐菌素诱导的方法建立Ⅱ型糖尿病模型,考察马齿苋多糖对糖尿病小鼠的血糖水平、葡萄糖耐受、胰岛素水平、胰岛素敏感指数、血脂指标以及超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性和丙二醛(malondialdehyde,MDA)含量的影响。结果:马齿苋多糖可明显改善血糖水平,提高对葡萄糖的耐受性,增加胰岛素水平和胰岛素敏感指数,且可以降低模型小鼠血脂的含量,同时能够增加小鼠胰腺中SOD、CAT的活性及降低MDA的含量。结论:马齿苋多糖具有降血糖与降血脂作用,可能与其抗氧化作用有关。
马齿苋;多糖;糖尿病;血糖;血脂;抗氧化
糖尿病(diabetes mellitus,DM)是一种以高血糖为特点的,因胰岛素分泌不足或功能下降所导致的疾病,最终可以引起糖、脂和蛋白质代谢损伤。在2025年,全世界糖尿病患者的数量将会增加到38亿,而其中的95%为Ⅱ型糖尿病[1]。目前,糖尿病的治疗方法包括胰岛素治疗和口服降血糖药物,但是这些方法在临床应用过程中也可以导致某些副作用,例如高剂量的应用胰岛素和口服降血糖药物可以引起低血糖、肝脏损伤、乳酸中毒和腹泻等[2-3]。因此,寻找天然的、低毒的抗糖尿病药物是非常必要的。目前为止,已有大量的天然药物被研究和用于糖尿病的治疗,并显示出了较好的效果[4-5]。
马齿苋(Portulaca oleracea L.)又称马齿草、马苋菜、五行草等,为药食两用植物。主要活性成分包括多糖、黄酮、生物碱和不饱和脂肪酸等[6]。近年来,植物多糖的生物学活性备受关注,成为人们的研究热点。马齿苋多糖(polysaccharides form Portulaca oleracea L.,POPs)为马齿苋的主要活性成分之一,具有增强免疫、抗氧化、抗衰老和抗肿瘤等作用[7-10]。马齿苋多糖的抗糖尿病作用报道较少,其研究的动物模型均是单纯的用四氧嘧啶来诱导,并不能很好的模拟人类Ⅱ型糖尿病的特点,并且没有涉及其降糖机制[11-12]。本研究以高脂饮食联合小剂量链脲佐菌素(streptozocin,STZ)诱导的糖尿病小鼠模型为研究对象,探讨马齿苋多糖的降血糖及降血脂作用,并对其机制进行探讨。
1 材料与方法
1.1 材料与试剂
马齿苋药材购与本地药材市场,经吉林农业科技学院生药教研室鉴定为马齿苋科植物马齿苋(Portulaca oleracea L.)。
STZ 美国Sigma公司;血糖试剂盒 北京康化试剂公司;胰岛素试剂盒 天津九鼎生物技术有限公司;葡萄糖 北京化学试剂厂;甘油三酯(triglyceride,TG)检测试剂盒 长春汇力生物技术有限公司;总胆固醇(total cholesterol,TC)检测试剂盒 北京北化康泰临床试剂有限公司;SOD检测试剂盒、MDA检测试剂盒、CAT检测试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
GC-2100型γ放射免疫计数仪 中国科大中佳公司;DY89-I型组织匀浆机 上海天呈科技有限公司;5417R型低温超高速离心机 德国Eppendorf公司;HCB-S1型磁力搅拌器 上海道京仪器有限公司;UV-1750型紫外-可见分光光度计 岛津国际贸易(上海)有限公司;New Classic ML分析天平 梅特勒-托利多中国公司。
1.3 方法
1.3.1 马齿苋多糖的提取[13-14]
全草清洗后在60 ℃条件下烘干,过40目筛后加40倍蒸馏水→90℃沸水浴4 h→用6层纱布过滤→滤液离心(4 000 r/min,20 min)→取上清液于90 ℃水浴浓缩,浓缩前后体积比为4∶1→加入3倍体积预冷的无水乙醇沉淀→3 000 r/min离心15 min→取沉淀物溶于适量蒸馏水中→用滤纸过滤除去蛋白质等杂物→再用100%乙醇二次沉淀→离心得沉淀物→沉淀物自然风干→得马齿苋多糖。
1.3.2 动物模型的建立及分组
雄性、清洁级ICR小鼠(18~22 g),购买于吉林大学实验室动物中心。小鼠饲养于温度为(22±1)℃和相对湿度为40%~70%的条件下,12 h光照循环,自由饮食和饮水。高脂饲料含有22%脂肪,48%碳水化合物和20%蛋白质;标准饲料含有5%脂肪,53%碳水化合物和20%蛋白质。
小鼠随机分为两组,一组8只,标准饮食;一组60只,高脂饮食。4周后,高脂饮食组的小鼠腹腔注射STZ(柠檬酸缓冲液配制),剂量为30 mg/kg(以体质量计,下同)。4周后测量血糖水平,血糖水平高于7.8 mmol/L的高脂饮食联合STZ诱导的小鼠随机分为5组,每组8只。一组作为糖尿病组(diabetic control,DC),一组灌胃给予5 mg/(kg·d)的格列本脲作为阳性对照组(positive control,PC),其余3组分别灌胃给予50、100、200 mg/(kg·d)的马齿苋多糖(分别为LPOPs、MPOPs、HPOPs组)。标准饮食组灌胃给予等体积的生理盐水,作为正常对照组(normal control,NC)。
POPs和格列本脲,灌胃给予,每天1次,共28 d。实验动物在处死前禁食12 h,取血后离心,存放于-80℃。胰腺被迅速的分离,收集和储存于液氮中,用于进一步分析。
1.3.3 空腹血糖的测定及口服葡萄糖耐受实验
在为期4周的给药周期内,每周尾静脉取血测量1次空腹血糖(fasting blood glucose,FBG)。口服葡萄糖耐受试验(oral glucose tolerance test,OGTT)在最后1周进行,12 h禁食后,实验动物口服2 g/kg(以体质量计)的葡萄糖溶液。按照说明书中的操作用葡萄糖氧化酶法测量0、30、60、90、120 min的葡萄糖水平。
1.3.4 胰岛素水平和胰岛素敏感指数测定
胰岛素水平(fasting serum insulin,FINS)用商品化的放射免疫试剂盒进行测定。实验按照说明书上描述的方法进行。浓度标准曲线与样品平行。胰岛素敏感指数测定(insulin sensitivity index,ISI)根据FBG和FINS的含量进行计算,计算公式如下:

1.3.5 TG和TC含量测定
OGTT完成24 h后,小鼠被处死,收集血液,用商品化的试剂盒对各组动物的TG和TC含量进行测定。
1.3.6 胰腺组织中SOD、CAT活性和MDA含量的测定
取小鼠胰腺组织,在预冷的生理盐水中漂洗,冲去表面血液,然后滤纸拭干,称质量后放入烧杯中。加入预冷的pH 7.4 Tris-HCl匀浆液,迅速用手术剪刀剪成碎块,进行匀浆操作,然后在4℃条件下离心,吸取上清液,存于-80℃备用。按照试剂盒中描述的方法对小鼠胰腺组织中SOD、CAT的活性和MDA的含量进行测定。
1.4 统计学分析
用SPSS17.0软件对数据进行单因素方差分析,所得结果以表示,P<0.05为有显著性差异。
2 结果与分析
2.1 马齿苋多糖的提取
马齿苋多糖的提取率(以干基计)为13.2%。
2.2 小鼠一般状态观察
NC组小鼠状态良好,皮毛光泽,体质量稳定持续上升,动作自如,反应灵敏,未见动物死亡。DC组小鼠,经腹腔注射STZ后,精神状态较差,皮毛失去光泽,身体消瘦,体质量持续下降,动作迟缓,反应迟钝,饮水量和食物摄入量均显著增加,出现2例小鼠死亡情况。POPs组有类似DC组表现,但程度较轻,其中LPOPs组有1例小鼠死亡,MPOPs、HPOPs组未见动物死亡。PC组小鼠精神状态好于POPs组,未见动物死亡。
2.3 马齿苋多糖对糖尿病小鼠FBG的影响

图1 马齿苋多糖对糖尿病小鼠FBG的影响Fig.1 Effects of POPs on FBG of diabetic mice
如图1所示,同DC组不同,NC组有一个正常的血糖水平。糖尿病小鼠的血糖水平能被各剂量组的POPs显著抑制(P<0.05),其降糖效果按照LPOPs、MPOPs和HPOPs的顺序递增。POPs对高脂饮食联合STZ诱导的糖尿病小鼠的血糖水平有着积极的作用。
2.4 马齿苋多糖对糖尿病小鼠OGTT的影响

图2 马齿苋多糖对糖尿病小鼠OGTT的影响Fig.2 Effects of POPs on OGTT of diabetic mice
如图2所示,在OGTT实验中,模型组的血糖峰值出现在口服胰岛素60 min后,其他各组血糖的峰值出现在口服胰岛素30 min时,口服胰岛素30 min后,低、中、高剂量的POPs均可以显著抑制血糖增加,口服胰岛素120 min后血糖仍然高于最初水平。这种抑制效果将会持续,直到血糖恢复到最初水平。在各POPs处理组中,高剂量组比低剂量组有更好的葡糖耐受性,按照LPOPs、MPOPs、HPOPs的顺序递增。
2.5 马齿苋多糖对糖尿病小鼠FINS和ISI的影响

图3 马齿苋多糖对糖尿病小鼠FINS的影响Fig.3 Effects of POPs on FINS of diabetic mice

图4 马齿苋多糖对糖尿病小鼠ISI的影响Fig.4 Effects of POPs on ISI of diabetic mice
如图3、4所示,POPs可剂量依赖性的增加糖尿病小鼠的FINS和ISI。同DC组相比,给予100 mg/kg和200 mg/kg的POPs可以使FINS显著提升(P<0.05),而给予50 mg/kg的POPs无显著变化(P>0.05)。当给予格列本脲或POPs后,同DC组相比ISI均显著增加(P<0.05)。
2.6 马齿苋多糖对糖尿病小鼠TG和TC的影响
为了进一步评估POPs的抗糖尿病作用,本实验研究了其对小鼠血液中TG和TC含量的影响,同DC组相比,低、中、高剂量组的POPs均可显著降低TG和TC的水平(P<0.05)。TG含量分别下降了7.54%、13.4%和15.9%,TC含量分别下降了12.1%、17.9%和24.4%。

图5 马齿苋多糖对糖尿病小鼠TG和TC的影响Fig.5 Effects of POPs on TG and TC of diabetic mice
2.7 马齿苋多糖对糖尿病小鼠胰腺组织中SOD、CAT的活性和MDA含量的影响
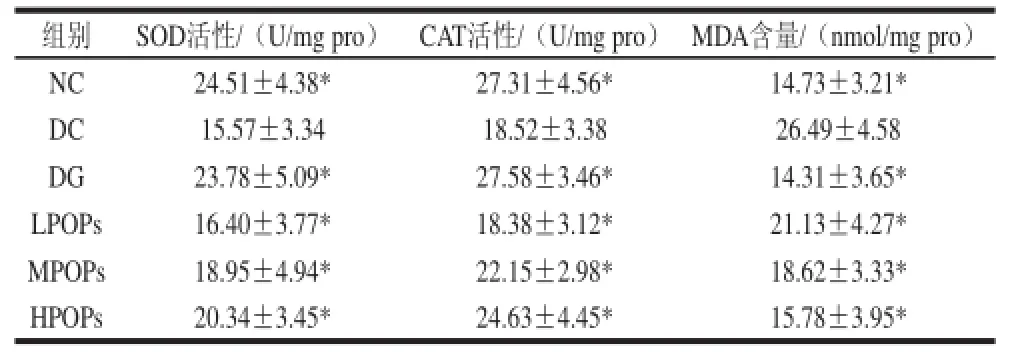
表1 马齿苋多糖对糖尿病小鼠胰腺组织中SOD、CAT的活性和MDA含量的影响Table 1 Effects of POPs on SOD and CAT activities and MDA content in pancreas of diabetic mice
如表1所示,当给予POPs后,同DC组相比,糖尿病小鼠胰腺组织中SOD和CAT活性显著性增高(P<0.05),但要低于NC组。格列本脲组和POPs组胰腺组织中MDA的含量同DC组相比均显著性降低(P<0.05)。结果表明,POPs对高脂饮食联合STZ诱导的糖尿病小鼠有显著的抗氧化作用。
3 讨 论
虽然糖尿病及其并发症的分子机制并没有完全阐述清楚,但是越来越多的证据表明活性氧在糖尿病及其并发症的发展过程中起着重要作用[15]。大量的临床证据也显示了糖尿病的发生与氧化应激密切相关,活性氧产物的增多或氧化损伤可以促进糖尿病的发生[16]。而植物多糖的抗氧化作用已被多项研究所证实[17-19],因此,可以初步判断POPs的降血糖及降血脂作用与其抗氧化作用有关。本研究探讨了POPs对模型小鼠胰腺组织抗氧化能力的影响,以SOD、CAT和MDA为评价指标。SOD是生物体内清除自由基中最为重要的抗氧化酶,在各种生物体内广泛存在,其能清除活性氧保护细胞免受氧化损伤[20]。研究表明,由活性氧引发的疾病多达60多种,而SOD可以阻断活性氧对细胞造成的各种损伤,并有修复已损伤细胞的功能。CAT的含量在整个过氧化物酶中约占40%,为过氧化物酶体的标志酶,其作用是催化过氧化氢使其分解成水和分子氧。CAT广泛分布于各类组织中,CAT可以迅速清除细胞的毒性代谢产物,从而对机体起到保护作用。MDA为脂质过氧化产物,可以反应机体内脂质过氧化的程度,间接反应细胞受损害的程度[21]。本实验给予模型小鼠马齿苋多糖4周后,可以显著提升糖尿病小鼠胰腺组织中SOD和CAT活性,减少MDA含量。研究结果证实,马齿苋多糖可通过提高模型小鼠抗氧化物酶的活性和降低脂质过氧化物的含量,从而增强自由基清除能力和降低ROS的产生,起到抗氧化应激、防止氧化损伤的效果,最终达到降血糖及降血脂作用。
本研究表明了马齿苋多糖具有一定的降血糖与降血脂作用,其可能与POPs的抗氧化作用有关,但具体作用机理还有待深入研究。
[1] ZIMMET P, ALBERIT K G, SHAW J, et al. Global and societal implications of the diabetes epidemic[J]. Nature, 2001, 414(13): 782-787.
[2] LUO Qiong, CAI Yizhong, YAN Jun, et al. Hypoglycemic and hypolipidemic effects and antioxidant activity of fruit extracts from Lycium barbarum[J]. Life Sciences, 2004, 76(2): 137-149.
[3] RAZ I, ELDOR R. Rational therapy for diabetes: early recognition of adverse effects and avoidance of disruptive false alarms[J]. Diabetes-Metabolism Research and Reviews, 2012, 28: 321-324.
[4] HUO Y, WINTERS W D, YAO D L, et al. Prevention of diet-induced type 2 diabetes in the C57BL/6J mouse model by an anti-diabetic herbal formula[J]. Phytotherapy Research, 2003, 17: 48-55.
[5] SUNG H K, SUN H H, SE Y C, et al. Anti-diabetic effect of cinnamon extract on blood glucose in db/db mice[J]. Journal of Ethnopharmacol, 2006, 104: 119-123.
[6] 丁怀伟, 姚佳琪, 宋少江, 等. 马齿苋的化学成分和药理活性研究进展[J]. 沈阳药科大学学报, 2008, 25(10): 831-836.
[7] 王晓波, 刘殿武, 丁月新, 等. 马齿苋多糖对小鼠腹腔巨噬细胞免疫功能作用[J]. 中国公共卫生, 2005, 21(4): 462-463.
[8] 余庆皋, 王晓春, 熊志青. 马齿苋的不同部位在体内外抗氧自由基作用的比较研究[J]. 实用预防医学, 2007, 14(2): 346-348.
[9] 牛广财, 朱丹, 金英子, 等. 马齿苋多糖对小鼠的抗衰老作用[J]. 中国农学通报, 2006, 22(10): 35-37.
[10] 晓波, 姜红, 王本华, 等. 马齿苋多糖对肿瘤细胞的体内外抑制作用[J].中国公共卫生, 2005, 21(12): 1485-1486.
[11] 范玉生, 李青旺, 高大威, 等. 马齿苋多糖对四氧嘧啶糖尿病小白鼠的降糖作用[J]. 黑龙江畜牧兽医, 2008(9): 86-88.
[12] 李玉萍, 刘志勇, 谢国秀, 等. 马齿苋多糖抗糖尿病作用的实验研究[J].天然产物研究与开发, 2008, 20(10): 813-815.
[13] 朱晓宦, 吴向阳, 仰榴青, 等. 马齿苋粗多糖的提取及清除羟自由基活性作用[J]. 江苏大学学报: 医学版, 2007, 17(1): 57-60.
[14] 朱丹, 牛广财, 孟宪军, 等. 马齿苋多糖提取工艺的研究[J]. 中国农学通报, 2006, 22(8): 119-122.
[15] LEE H B, YU M R, YANG Y Q. Reactive oxygen species-regulated signaling pathways in diabetic nephropathy[J]. Journal of the American Society of Nephrology, 2003, 14: 241-245.
[16] SUSZTAK K, RAFF A C, SCHIFFER M. Glucose-induced reactive oxygen species cause apoptosis of podocytes and podocyte depletion at the onset of diabetic nephropathy[J]. Diabetes, 2006, 55: 225-233.
[17] LI R J, QIU S D, CHEN H X. The immunotherapeutic effects of Astragalus polysaccharide in type 1 diabetic mice[J]. Biological & Pharmaceutical Bulletin, 2003, 30: 470-476.
[18] SUNIL C, DURAIPANDIYAN V, AGASTIAN P, et al. Anti-diabetic effect of plumbagin isolated from Plumbago zeylanica L. root and its effect on GLUT4 translocation in streptozotocin-induced diabetic rats[J]. Food and Chemical Toxicology, 2012, 50: 4356-4363.
[19] MAO X Q, WU Y, WU K. Astragalus polysaccharide reduces hepatic endoplasmic reticulum stress and restores glucose homeostasis in a diabetic KKAy mouse model[J]. Acta Pharmacologica Sinica, 2007, 28: 1947-1956.
[20] YAMAMOTO H, ZHAO P, INOUE X. Origint of two isoprenoid units in alavandulyl moiety of sophoraflavanone G from Sophora fl avescens cultured cell[J]. Phytochemistry, 2002, 60: 263-267.
[21] WALLACE D C. Animal models for mitochondrial disease[J]. Methods Molecular Biological, 2002, 19: 53-54.
Effect and Mechanism of Polysaccharides from Portulaca oleracea L. on STZ-Induced Diabetic Mice Fed High-Fat Diet
LIANG Yan1,ZHANG Chuan-jun1,LÜ Yan-rong2
(1. College of Food Science and Engineering, Jilin Agricultural Science and Technology College, Jilin 132101, China; 2. Environment Protection Agency of Fuyu, Songyuan 131200, China)
Objective: To study the anti-diabetic effect and mechanism of polysaccharides form Portulaca oleracea L. (POPs) in STZ-induced diabetic mice fed a high-fat diet. Methods: Diabetic mice induced by streptozocin (STZ) and highfat diet were administered with POPs and the effects of POPs on FBG, OGTT, FINS, blood lipid, SOD, CAT and MDA were investigated. Results: POPs could improve the content of FBG and enhance FINS level. Meanwhile, POPs significantly suppressed the increase in blood glucose after 30 min. Blood lipid of diabetic mice also decreased after POPs treatment. Furthermore, POPs showed an obvious antioxidant effect through increasing SOD and CAT activities and decreasing MDA content in pancreas. Conclusion: POPs have obvious anti-diabetic and anti-hyperlipidemia effects on diabetic mice and the antioxidant effect may be a possible reason for the anti-diabetic effect.
Portulaca oleracea L.; polysaccharides; diabetes mellitus; blood glucose; blood lipid; antioxidant
R285.5
A
1002-6630(2014)03-0217-04
10.7506/spkx1002-6630-201403044
2013-03-11
吉林省教育厅“十二五”科学技术研究项目(20130333);“吉林省教育厅酿造技术高等学校工程研究中心”资助项目(吉农院合字2012第606号);吉林农业科技学院重点学科培育项目(2013223)
梁彦(1970—),女,副教授,硕士,主要从事食品营养研究与保健食品开发。E-mail:641219596@qq.com
