苦荞异槲皮苷对人胃癌细胞SGC-7901增殖及凋亡的影响
2014-01-18李玉英赵淑娟白崇智张立伟王转花
李玉英,赵淑娟,白崇智,张立伟,王转花,*
(1. 山西大学 化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.山西省中医药研究院中心实验室,山西 太原 030012)
苦荞异槲皮苷对人胃癌细胞SGC-7901增殖及凋亡的影响
李玉英1,赵淑娟1,白崇智2,张立伟1,王转花1,*
(1. 山西大学 化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.山西省中医药研究院中心实验室,山西 太原 030012)
从苦荞中提取制备异槲皮苷,研究其对人胃癌细胞SGC-7901增殖、凋亡、迁移和细胞周期的影响。将异槲皮苷作用于人胃癌SGC-7901细胞和人肾上皮细胞系293T,通过噻唑蓝法检测异槲皮苷对其增殖的影响;4’,6-二脒基-2-苯基吲哚(4’,6-diamino-2-phenyl indole,DAPI) 荧光染色法观察细胞核的形态学变化;划痕擦伤迁移实验检测异槲皮苷对SGC-7901细胞迁移能力的影响;流式细胞术检测异槲皮苷对SGC-7901细胞凋亡及细胞周期的影响。结果表明:苦荞异槲皮苷可以抑制SGC-7901细胞的增殖,并呈时间和剂量依赖性,当用100 ømol/L异槲皮苷作用细胞48 h后,对SGC-7901细胞的增殖抑制率达到35.92%, 而对人肾上皮细胞系293T的增殖抑制率仅为 3.15%;DAPI荧光染色法观察异槲皮苷处理细胞后,染色体凝聚,有凋亡小体产生;划痕擦伤实验显示,异槲皮苷能抑制SGC-7901细胞的迁移;流式细胞术检测结果表明,异槲皮苷可使G1和S期细胞减少,G2/M期细胞增多,且细胞凋亡率明显增加。综上所述,苦荞麦异槲皮苷能够诱导SGC-7901细胞发生凋亡,阻断细胞周期并抑制细胞增殖和迁移。
异槲皮苷;人胃癌细胞SGC-7901;细胞周期;凋亡;细胞迁移
苦荞是我国传统的药食两用作物,尤其是黑苦荞,营养价值极高,所含营养成分比较复杂,主要有生物类黄酮、活性蛋白质、脂肪酸、氨基酸、微量元素等[1],其中黄酮类物质的含量较高,并具有极其广泛的生理和药理活性,如抗氧化、清除自由基、抗突变、降血糖、抗炎症、调节免疫等功能[2-4]。人体不能自身合成黄酮类化合物,主要从植物中摄取。苦荞黄酮主要成分为芦丁,其次还有槲皮素和异槲皮苷等,由于其所在部位不同及提取方法各异,其含量也有所差异,其中异槲皮苷(isoquercetin)是存在于苦荞中的一种次生代谢产物,主要存在于苦荞种子、花及麸皮中。到目前为止,已有一些文献论述了异槲皮苷抗氧自由基作用[5],但是关于它抗肿瘤作用的报道较为少见。胃癌是严重危害人类健康的恶性肿瘤之一,在世界范围内其发病率和死亡率均较高,而失控性生长和增殖及细胞凋亡受阻是恶性肿瘤细胞的重要特征[6-7],因此,抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡将有利于胃癌的预防和治疗,其应用前景广阔。本研究将苦荞异槲皮苷作用于人胃癌 SGC-7901细胞,并以人肾上皮细胞系293T作为对照组,研究其对肿瘤细胞生长及迁移的抑制作用,以及其对细胞周期及凋亡的影响等,以期为其抗胃癌的分子机制及应用开发提供参考。
1 材料与方法
1.1 材料、试剂与仪器
苦荞麦种子为贵州威黑荞,由山西省农科院农作物品种资源研究所提供;人胃癌细胞株 SGC-7901和人肾上皮细胞系293T购自中国科学院上海生命科学院细胞库。
DMEM培养液 美国HyClone公司;无支原体胎牛血清 杭州四季青公司;胰酶、二甲基亚砜(dimethyl sulfoxide,DMSO) 北京索莱宝科技有限公司;四甲基偶氮唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、DAPI、核糖核酸酶A(ribonuclease A,RNase A)和碘化丙啶(propidium iodide,PI) 美国Sigma公司;膜联蛋白V-异硫氰酸荧光素(annexinV-FITC)细胞凋亡检测试剂盒 美国Bio-Vision公司;其他试剂均为国产分析纯。
流式细胞仪 美国Elite ESP公司;酶联免疫检测仪美国Bio-Rad公司;激光共聚焦显微镜 日本Olympus公司;电子天平 上海天平仪器厂。
1.2 方法
1.2.1 苦荞异槲皮苷样品制备
苦荞异槲皮苷样品制备按照文献[8-10]进行,以70%的乙醇为溶剂,固液比为1∶20(m/V),采用索氏提取法进行加热回流提取,粗提液进一步经酶解后经高效液相色谱分析证明,其中的主要成分异槲皮苷纯度达96.7%以上,相对分子质量为464.38。
1.2.2 细胞培养
人胃癌细胞株SGC-7901和人肾上皮细胞系293T在含10%的胎牛血清、100 U/mL青霉素和100 øg/mL链霉素的DMEM培养液中生长,并置于37℃、5% CO2相对饱和湿度的孵育箱中培养,细胞呈贴壁生长,取对数生长期的细胞进行实验。
1.2.3 噻唑蓝法检测细胞的存活率
选取对数生长期SGC-7901细胞和人肾上皮细胞系293T,以1×104cells/孔接种于96孔培养板中,每孔加100 øL培养基,37℃、5% CO2过夜培养至细胞完全贴壁,加入不同浓度(25~200 ømol/L)异槲皮苷[8]分别培养24、48、72 h后,每孔加20 øL MTT继续培养4 h后,弃上清每孔加入150 øL DMSO,室温低速振荡10 min,待结晶物溶解后,于酶标免疫测定仪测定波长490 nm处的吸光度(A)值。实验用0.1% DMSO作为对照。每组设5个复孔,实验重复3次。实验组均与对照组相比,并用t检验进行统计学分析。
肿瘤细胞的生长抑制率/% = (1-A实验组/A空白对照组)×100
1.2.4 DAPI染色检测细胞核的形态学变化
将对数期SGC-7901细胞接种于6孔板中,培养过夜待细胞贴壁且生长良好,加入终浓度为100 ømol/L的异槲皮苷, 对照组用等体积的0.1% DMSO代替,37 ℃培养24 h后收集细胞,用预冷的磷酸缓冲溶液洗涤后重悬于固定液中30 min,之后将悬液低速离心,收集沉淀,用同样缓冲溶液洗涤2次后将细胞悬液滴到载玻片上,用2 øg/mL的DAPI避光染色15 min,荧光显微镜下观察细胞核的形态学变化。
1.2.5 划痕法检测SGC-7901细胞的迁移能力
细胞划痕法是测定肿瘤细胞迁移的方法之一。在12孔板背后画直线做标记,取对数生长期的SGC-7901细胞(1×106cells/mL)接种于12孔板,待细胞贴壁后,弃去培养基,磷酸缓冲液洗细胞2次,用10 øL移液器枪头在培养孔的中央沿纵轴方向划一直线,磷酸缓冲液漂洗细胞2次,以去除漂浮细胞。加入终浓度为100 ømol/L的异槲皮苷,对照组设为等体积的0.1% DMSO, 培养0~24 h,于倒置显微镜下观察划痕处细胞的生长情况。每组检测5个视野,每组3个复孔,实验重复3次。
1.2.6 流式细胞术检测细胞凋亡率
将对数期SGC-7901细胞接种于6孔板中,培养过夜待细胞贴壁后,加入终浓度为100 ømol/L的异槲皮苷,对照组设为等体积的0.1% DMSO,37 ℃分别培养24 h后,胰酶消化收集细胞,PBS洗2次,400 øL 1×Binding buffer重新悬浮细胞后,分别加入5 øL的Annexin V-FITC和5 øL的PI并使其混匀,室温、避光的条件下孵育30 min,流式细胞仪检测细胞凋亡率。
1.2.7 细胞周期的检测
将对数期SGC-7901细胞接种于6孔板中,培养过夜待细胞贴壁后,加入终浓度为100 ømol/L的异槲皮苷,对照组设为等体积的0.1% DMSO,37 ℃培养24 h后,用胰酶消化收集细胞,于70%乙醇中4 ℃固定1 h,1 200 r/min离心5 m i n,弃去乙醇,并用P B S洗2次,加P I(10 mg/mL)染液悬浮细胞,然后在避光条件下37 ℃孵育30 min,流式细胞仪检测细胞周期的变化。
1.3 统计学分析
2 结果与分析
2.1 异槲皮苷抑制肿瘤细胞的MTT法检测

图1 不同浓度的异槲皮苷作用不同的时间对SGC-7901细胞增殖的影响Fig.1 Effect of isoquercetin concentration on cell proliferation of SGC-7901 cells during different treatment times
由图1的MTT法检测结果可知,苦荞异槲皮苷浓度为25~200 ømol/L时,能够抑制人胃癌细胞的增殖,随着浓度的增加和时间的延长,异槲皮苷对SGC-7901细胞的抑制作用也逐渐增强,即呈现时间和剂量依赖性。
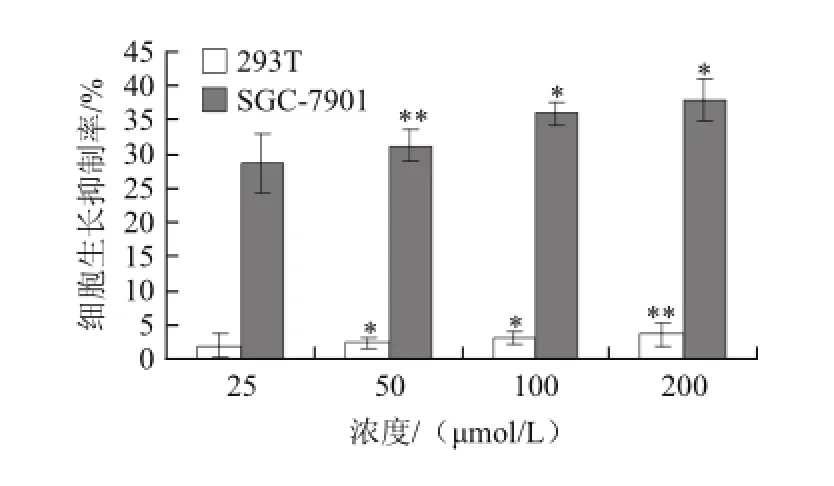
图2 异槲皮苷对SGC-7901和293T细胞增殖的影响Fig.2 Inhibitory effect of isoquercetin on the growth of SGC-7901 and 293T cells
由图2可知,苦荞异槲皮苷各浓度对人肾上皮细胞系293T的增殖影响很小。100 ømol/L异槲皮苷作用细胞48 h后,对SGC-7901细胞的增殖抑制率达到35.92%,而对人肾上皮细胞系293T的增殖抑制率仅为3.15%。实验组与对照组相比较,均呈现显著性差异。
2.2 SGC-7901细胞核的形态学变化检测

图3 荧光显微镜观察细胞核的形态学变化(×100)Fig.3 Morphological changes of nuclei in SGC-7901 cells under fluorescence microscope (×100)
由图3可知,经异槲皮苷作用后的细胞核形态与对照组相比发生了显著变化,对照组细胞的细胞核染色均匀,并呈现均匀的低强度荧光;当用100 ømol/L异槲皮苷作用SGC-7901细胞24 h后,染色体凝集,并有凋亡小体产生。实验结果表明,经异槲皮苷作用的SGC-7901细胞出现了凋亡信号。
2.3 异槲皮苷对SGC-7901细胞迁移能力的影响

图4 划痕擦伤实验检测SGC-7901细胞迁移Fig.4 Migration of SGC-7901 cells in scratch-recovering tests
在体外培养的单层细胞上划痕致伤,然后加入药物观察其抑制肿瘤细胞迁移的能力。由图4、表1可知,分别培养细胞12 h和24 h后,SGC-7901细胞发生迁移,对照组细胞分别迁移了4.9 øm和10.5 øm,而加入100 ømol/L异槲皮苷作用后,细胞分别迁移了2.8 øm和 6.1 øm, 细胞的迁移能力较对照组减弱,当用100 ømol/L异槲皮苷作用细胞12 h和24 h时,其抑制率分别为42.8%和41.9%,由此可见,苦荞异槲皮苷可以抑制SGC-7901细胞的迁移。

表1 异槲皮苷作用SGC-7901细胞后的迁移距离(x ±s, nn==33)Table 1 Migration distance of SGC-7901 cells in the presence of isoquercettiinn ((x ±s,, n == 33))
2.4 SGC-7901细胞的凋亡检测
为了检测异槲皮苷对胃癌细胞凋亡的影响,分别用0.1%的DMSO和100 ømol/L异槲皮苷作用于SGC-7901细胞24 h,用Annexin V/FITC 和 PI染色,收集细胞用流式细胞仪检测。由图5可知,对照组早期凋亡率为0.5%,晚期凋亡率为1.3%,用100 ømol/L的异槲皮苷处理细胞后的早期凋亡率为6.0%,晚期凋亡率为23.0%,凋亡率均较对照组明显升高,可见异槲皮苷可以诱导SGC-7901细胞发生凋亡。

图5 流式细胞术检测异槲皮苷对SGC-7901细胞凋亡的影响Fig.5 Effect of isoquercetin from F. tataricum on apoptosis of SGC-7901 cells examined by flow cytometric analysis
2.5 异槲皮苷对SGC-7901细胞周期的影响
流式细胞术检测异槲皮苷对SGC-7901细胞周期的影响,结果如图6所示,用100 ømol/L的异槲皮苷作用SGC-7901细胞24 h后,与对照组相比,细胞在G2/M期的比率增加,而在G1和S期的细胞比率减少,由此推断,苦荞异槲皮苷可能通过阻断细胞周期于G2/M期,从而抑制细胞的增殖。

图6 流式细胞术检测异槲皮苷对SGC-7901细胞周期分布的影响Fig.6 Effect of isoquercetin from F. tataricum on cell cycle distribution of SGC-7901 cells examined by flow cytometric analysis

表2 异槲皮苷对SGC-7901细胞周期的影响分析Table 2 Effect of isoquercetin fromF. tataricum on cell cycle distribution of SGC-7901 cells
3 讨 论
胃癌是消化系统常见的恶性肿瘤之一,发病率和死亡率均较高,严重威胁着人们的健康,近年来,胃癌的发病率呈现上升的趋势。由于其早期诊断困难、手术机会低、对放射及化疗均不敏感,而植物来源的抗肿瘤药具有种类多、毒副作用小、不良反应少的特点,因此从植物中寻找高效的抗肿瘤药物已成为一种新的研究思路。从荞麦中分离出的天然黄酮类小分子物质异槲皮苷具有成本低、毒副作用小的特点,提示异槲皮苷可以作为抑制胃癌细胞生长的一个辅助性药物,在胃癌的药物治疗方面具有潜在应用价值。
细胞凋亡是机体细胞在正常生理或病理状态下发生的一种自发的程序化的死亡过程,它的发生受到机体的严密调控,许多抗癌药物都是通过触发肿瘤细胞凋亡通路而达到抑制肿瘤生长的目的[11-12]。本研究用一定浓度的异槲皮苷作用于胃癌细胞SGC-7901,结果发现细胞形态学改变,细胞核中染色体凝集,有凋亡小体产生。
肿瘤细胞的侵袭、转移是肿瘤恶性生物学行为的主要特征,是一个复杂的多步骤的生物学过程[13-15],恶性肿瘤的侵袭、转移是引起肿瘤患者治疗失败和死亡的主要原因之一。而迁移是肿瘤细胞转移过程中必不可缺的环节之一,细胞迁移是多步骤协同作用的结果[16],它不仅是细胞进行很多重要生理活动的基础,同时也是肿瘤发生等病理过程中的重要步骤和关键环节。本研究发现异槲皮苷处理后,可以有效抑制SGC-7901细胞迁移,其具体机制有待进一步研究。
细胞周期的调节是一个复杂的过程,阻滞细胞增殖周期进程会引起凋亡,而凋亡也常伴有细胞生长阻滞[17-18]。细胞在一定的条件下,可使细胞周期进程阻断,导致有丝分裂异常或停滞,使癌细胞无法继续分裂,致使癌细胞的生长受到抑制[19-20]。当用一定浓度的苦荞异槲皮苷处理SGC-7901细胞后经流式细胞仪检测,发现其细胞周期分布存在异常,处于G1期和S期的细胞数比例减少,而处于G2/M期的细胞比率增加,提示异槲皮苷可能通过阻滞细胞在G2/M期来抑制细胞增生。
本研究采用噻唑蓝和流式细胞仪等,检测了异槲皮苷对 SGC-7901 细胞的增殖抑制及诱导凋亡作用,噻唑蓝法检测结果表明异槲皮苷可以抑制SGC-7901细胞的增殖,并具有时间和剂量依赖性;异槲皮苷作用 SGC-7901细胞后,可见染色体凝集,并出现凋亡小体等典型的细胞凋亡的形态学变化。流式细胞仪检测发现,异槲皮苷作用SGC-7901 细胞24 h后, 它可以阻断细胞周期,诱导细胞发生凋亡。由此推断,阻断细胞周期和诱导肿瘤细胞发生凋亡可能是异槲皮苷抗肿瘤作用的重要机制,而本实验为进一步研究异槲皮苷的抗肿瘤作用及苦荞保健、药用价值的开发可提供有参考意义的实验依据。
[1] TSAI H, DENG H, TSAI S, et al. Bioactivity comparison of extracts from various parts of common and tartary buckwheats: evaluation of the antioxidant- and angiotensin-converting enzyme inhibitory activities[J]. Chemistry Central Journal, 2012, 6(1): 78. doi:10.1186/1752-153X-6-78.
[2] TAUR J S, RODRIGUEZ-PROTEAU R. Effects of dietary avonoids on the transport of cimetidine via P-glycoprotein and cationic transporters in Caco-2 and LLC-PK1 cell models[J]. Xenobiotica, 2008, 38(12): 1536-1550.
[3] 闫斐艳, 崔晓东, 李玉英, 等. 苦荞麦黄酮对人食管癌细胞EC9706增殖的影响[J]. 中草药, 2010, 41(7): 1142-1145.
[4] HANNEKEN A, LIN F F, JOHNSON J, et al. Flavonoids protect human retinal pigment epithelial cells from oxidative stress-induced death[J]. Invest Ophthalmol Via Sci, 2006, 47(7): 3164-3177.
[5] LI Yanqin, ZHOU Fengchao, GAO Fan, et al. Comparative evaluation of quercetin, isoquercetin and rutin as inhibitors of a-glucosidase[J]. J Agric Food Chem, 2009, 57: 11463-11468.
[6] BASKIN-BEY E S, GORES G J. Caspase-8, death-receptor signaling, and hepatocarcinogenesis: the fas and the furious[J]. Gastroenterology, 2005, 129(5): 1790-1792.
[7] LEUNG H W, LIN C J, HOUR M J, et al. Kaempferol induces apoptosis in human lung non-small carcinoma cells accompanied by an induction of antioxidant enzymes[J]. Food Chem Toxicol, 2007, 45(10): 2005-2013.
[8] 崔晓东, 王转花. 苦荞芦丁水解酶的最适作用条件及Cu2+对酶活性的抑制[J]. 食品科学, 2012, 33(7): 223-227.
[9] 肖诗明, 张忠, 李勇, 等. 苦荞麦麸皮中黄酮的提取工艺条件研究[J].食品科学, 2006, 27(1): 156-158.
[10] 王敏, 高锦明, 王军, 等. 苦荞茎叶粉中总黄酮酶法提取工艺研究[J].中草药, 2006, 37(11): 1645-1648.
[11] RAMOS A M, ALLER P. Quercetin decreases intracellular GSH content and potentiates the apoptotic action of the antileukemic drug arsenic trioxide in human leukemia cell lines[J]. Biochem Pharmacol, 2008, 75(10): 1912-1923.
[12] YOKOTA J. Tumor progression and metastasis[J]. Carcinogenesis, 2000, 21(8): 497-503.
[13] CHEN Wenshu, WANG Xia, ZHUANG Jianguo, et al. Induction of death receptor 5 and suppression of survivin contribute to sensitization of TRAIL-induced cytotoxicity by quercetin in non-small cell lung cancer cells[J]. Carcinogenesis, 2007, 28 (10): 2114-2121.
[14] EBERT B, SEIDEL A, LAMPEN A. Phytochemicals induce breast cancer resistance protein in Caco-2 cells and enhance the transport of benzo[a]pyrene-3-sulfate[J]. Toxicol Sci, 2007, 96(2): 227-236.
[15] BURZ C, BERINDAN-NEAGOE I, BALACESCU O, et al. Apoptosis in cancer: key molecular signaling pathways and therapy targets[J]. Acta Oncol, 2009, 48 (6): 811-821.
[16] SKUPIEN K, OSZMIANSKI J, TARASIUK J, et al. in vitro antileukaemic activity of extracts from berry plant leaves against sensitive and multidrug resistant HL60 cells[J]. Cancer Lett, 2006, 236 (2): 282-291.
[17] MORISAKI T, UCHIYAMA A, YUZUKI D, et al. Interleukin 4 regulates G1cell cycle progression in gastric carcinoma cells[J]. Cancer Res, 1994, 54(4): 1113-1118.
[18] LIM D Y, JEONG Y, TYNER A L, et al. Induction of cell cycle arrest and apoptosis in HT-29 human colon cancer cells by the dietary compound luteolin[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 292(6): 66-75.
[19] WANG Ping, ZHANG Ke, ZHANG Qing, et al. Effects of queretin on the apoptosis of the human gastric carcinoma cells[J]. Toxicol in Vitro, 2012, 26(2): 221-228.
[20] van ZANDEN J J, WORTELLBOER H M, BIJLSMA S, et al. Quantitative structure activity relationship studies on the avonoid mediated inhibition of multidrug resistance proteins 1 and 2[J]. Biochem Pharmacol, 2005, 69(4): 699-708.
Effect of Isoquercetin from Fagopyrum tataricum on the Proliferation and Apoptosis of Human Gastric Carcinoma Cell Line SGC-7901
LI Yu-ying1, ZHAO Shu-juan1, BAI Chong-zhi2, ZHANG Li-wei1, WANG Zhuan-hua1,*
(1. Key Laboratory for Chemical Biology and Molecular Engineering, Ministry of Education, Shanxi University, Taiyuan 030006, China; 2. Central Laboratory of Shanxi Academy of Traditional Chinese Medicine, Taiyuan 030012, China)
Isoquercetin was extracted from Fagopyrum tataricum and investigated for its effect on cell proliferation, apoptosis and migration of human gastric carcinoma cell line SGC-7901. Cell proliferation was examined by using MTT assay. The morphological changes of SGC-7901 were observed by DAPI nuclear staining. The effect of Fagopyrum tataricum isoquercetin on cell migration was investigated by scratch-recovering tests in cell culture plates, as well as its effect on cell apoptosis by flow cytometry. As a result, MTT assay showed that the isoquercetin could inhibit the viability of SGC-7901 cells in time- and dose-dependent manners. SGC-7901 cell growth was inhibited by 35.92% or more at isoquercetin concentration of 100 μmol/L for 48 h, compared to only 3.15% for 293T cells under the same conditions of concentration and culture duration. DAPI nuclear staining showed chromosomal condensation and the production of apoptotic bodies. Scratch-recovering tests indicated that the isoquercetin could suppress cell migration. Flow cytometry showed that the number of cells at the G1phase and S phase decreased and increased at the G2/M phase and the apoptotic cell population exhibited a signifi cant increase. Taken together, isoquercetin from F. tataricum can induce apoptosis, arrest cell cycle and inhibit cell proliferation and migration of SGC-7901 cells.
isoquercetin; human gastric carcinoma cell line SGC-7901; cell cycle; apoptosis; cell migration
R965
A
1002-6630(2014)03-0193-05
10.7506/spkx1002-6630-201403039
2013-03-20
国家自然科学基金项目(31171659);山西省自然科学基金项目(2011011035-4);山西省高校科技开发项目(2012004)
李玉英(1969—),女,副教授,博士,研究方向为生物活性物质与蛋白质工程。E-mail:lyy9030@sxu.edu.cn
*通信作者:王转花(1956—),女,教授,博士,研究方向为生物活性物质与蛋白质工程。E-mail:zhwang@sxu.edu.cn
