红莲外皮原花青素的纯化与分析
2014-01-18李绮丽彭芳刚刘德明刘珍宝吴卫国
李绮丽,彭芳刚,刘德明,刘珍宝,吴卫国,*
(1.湖南农业大学食品科技学院,食品科学与生物技术湖南省 重点实验室,湖南 长沙 410128;2.湖南省农业科学院农产品加工研究所,湖南 长沙 410125;3.湖南农业大学 作物种质创新湖南省重点实验室,分析测试中心国家重点实验室,湖南 长沙 410128;4.中南大学药 学院,湖南 长沙 410013)
红莲外皮原花青素的纯化与分析
李绮丽1,2,彭芳刚1,刘德明3,刘珍宝4,吴卫国1,*
(1.湖南农业大学食品科技学院,食品科学与生物技术湖南省 重点实验室,湖南 长沙 410128;2.湖南省农业科学院农产品加工研究所,湖南 长沙 410125;3.湖南农业大学 作物种质创新湖南省重点实验室,分析测试中心国家重点实验室,湖南 长沙 410128;4.中南大学药 学院,湖南 长沙 410013)
原花青素作为多酚的一大类广泛存在于天然植物中。红莲外皮原花青素粗提取物采用大孔树脂AB-8和聚酰胺柱进行两次纯化。纯化物通过红外光谱(infrared spectrum,IR)和电子喷雾离子化质谱(electrospray ionization-mass spectroscopy,ESI-MS)对成分进行分析,并通过反相液相色谱-质谱(reverse phase high-performance liquid chromatography- mass spectroscopy,RP-HPLC-MS/MS)联用对组分进行分 离鉴定。结果表明:纯化物中有9种原花青素单体和低聚体,其中包括儿茶素和表儿茶素(m/z 289)、棓儿茶素(m/z 305),4种原花青定二聚体的同分异构体(m/z 577)和2种原花青定四聚体的同分异构体(m/z 1 153)。
莲子;原花青素;红外光谱;液质联用
莲子是睡莲科水生草本植物莲(Nelumbo nucifera Gaertn.)的成熟种子,在我国及东南亚作为传统已开拓的食材和中药材已为人所熟知。近年来,随着种植规模的逐年增加,莲子的产量也迅速增长,年产量可达到10万t左右。目前市售的莲子干品通常已经除去红色外皮,因此莲子产率的增长也伴随着莲子皮的产量增加,每年莲子皮的产量可达到5 000 t左右。而这些莲子皮一般只是用于动物饲料,甚至是作为废弃物处理掉,造成了资源的极大浪费。通过对莲子皮的初步成分分析,发现其中富含原花青 素这种具有多种生物功能活性的天然成分。因此,若能从莲子表皮中提取分离原花青素,并开展应用研究将是一项非常有意义的工作。
原花青素是一类黄烷醇单体及其聚合体的多酚化合物,具有C6-C3-C6的结构特征。按结构单元的不同,原花青素主要可以分为表儿茶素/儿茶素构成的原花青定、表棓儿茶素/棓儿茶素构成的原翠雀定和表阿福豆素/阿福豆素)构成的原天竺葵定。按连接方式的不同,有由C-C和C-O-C两类键相连构成的双链型A型原花青素和由C4-C8或C4-C6连接构成的单链型B型原花青素。依据聚合度大小可分为单体黄烷如儿茶素、表儿茶素、棓儿茶素和表棓儿茶素等,低聚原花青素(聚合度(degree of polymerization,DP)为2~4)和高聚原花青素(DP≥5)[1-2]。通常从植物中提取出的原花青素都是不同聚合度的聚合 体组成的复杂混合物。研究表明,原花青素的功能活性与单体组成、单体之间连接键的形式以及DP的大小都有很大的关系[3-5]。因此对莲子皮原花青素提取纯化物的组成成分进行分析是十分必要的。
对于原花青素的定性分析,本实验首先采用红外光谱来初步判断纯化物中的化学基团,并确定物质大致组成信息(原花青定或原翠雀定)[6-7]。同时,运用反相液相色谱和液质联用(high performance liquid chromatography-electrospray ionization-mass spectrometry,HPLC-ESI-MS)技 术,根据液相和质谱信息来对产物组分的分子质量大小 和结构信息进行推导,从而初步确定各组分的分子结构式[8-12]。
1 材料与方法
1.1 材料与试剂
红莲外皮粉来源于湖南湘潭粒粒珍有限公司。红莲经打磨加工后剩下的莲子外皮粉末在工厂经收集,转移至实验室,过100目筛,40 ℃烘箱干燥至水分含量(5.0±0.2)%,在冷藏室(7±2) ℃条件下保存。
儿茶素、表儿茶素、棓儿茶素标准品(纯度>98%) 美国Sigma公司;丙酮、乙酸乙酯、乙醚、正丁醇、盐酸等均为分析纯,甲醇、乙腈、冰乙酸均为色谱纯 天津市光复精细化工研究所。
1.2 仪器与设备
AB-8大孔树脂、聚酰胺树脂(30~60目) 天津市光复精细化工研究所;6700红外光谱分析仪 美国Nicolet公司;LC 1200液相色谱仪、6530四极杆-飞行时间质谱-1290UHPLC联用仪 美国安捷伦公司。
1.3 方法
1.3.1 莲子皮原花青素的提取
取莲子外 皮粉过100目筛,按料液比1∶54(m/V)、丙酮体积分数67%、pH 2.7、提取温度 37 ℃、提取时间90 min的条件进行提取。用柠檬酸调节pH值。加塞,放入恒温振荡器中,于130 r/min转速下提取。待提取液冷却,抽滤,收集上清液旋转蒸发回收丙酮得提取物浓缩液。浓缩液经过乙酸乙酯反复萃取3次,回收乙酸乙酯,萃取物冷冻干燥成粉末备用。
1.3.2 原花青素纯化物的制备
乙酸乙酯萃取物首先 经过AB-8大孔树脂柱层析纯化,50%丙酮溶液洗脱并回收得大孔树脂纯化物。取20 mg大孔树脂纯化物加入40 mL蒸馏水配制成0.5 mg/mL溶液,以16 Bv/h的流速上20 mL的聚酰胺层析柱进一步纯化,分别用4 Bv(80 mL)体积分数分别为10%、30%、50%的丙酮溶液分级洗脱,分开收集10%丙酮洗脱物(M1)、30%丙酮洗脱物(M2)、50%丙酮洗脱物(M3)旋转蒸发,浓缩液冷冻干燥以备分析之用。
1.3.3 红外光谱扫描
将红莲外皮大孔树脂纯化物与溴化钾按2%比例混合研磨压片,在红外光谱仪中先对纯溴化钾薄片进行背景扫描,然后再对含有样品的KBr薄片进行扫描,扫描波数为4 000~400 cm-1,测定其红外光谱。
1.3.4 反相液相色谱扫描分析
反相液相色谱扫描分析在安捷伦LC 1200液相色谱仪上进行。色谱柱为C18(250 mm× 4.6 mm),流动相为:A 0.25%乙酸溶液,B乙腈。梯度洗脱如下:7%~20% B,40 min;20% B平衡5 min,直到下次进样。流速为0.8 mL/min,280 nm双通道紫外-可见检测器检测。
1.3.5 高效液相色谱-电喷雾电离质谱分析
HPLC-ESI-MS分析在安捷伦UHPLC(1290)-Q/ TOF(6530)MS系统上进行。ESI-MS条件:扫描方式:负离子扫描,碎片电压135 V,毛细管电压2 500 V雾化压力30 psi,干燥气体温度350 ℃,质谱离子范围50~3 000 D。
2 结果与分析
2.1 红莲外皮原花青素近红外光谱分析
红莲外皮原花青素提取物经大孔树脂纯化后得浅红色粉末。将粉末通过傅里叶变换红外光谱仪扫描,得红外光谱图1。

图1 红莲外皮原花青素红外光谱图Fig.1 IR spectrum of chromatographically eluted proanthocyanidins
由图1可知,3 425 cm-1处的强吸收峰,是原花青素分子中羟基的伸缩振动,2 923 cm-1处苯环的C-H伸缩振动,1 619、1 517、1 449 cm-1处是苯环骨架C=C的特征伸缩振动峰,1 282、1 201 cm-1处是酚羟基伸缩振动及面内弯曲振动,1 146 cm-1处是C环中的C-H伸缩振动,1 103、1 064 cm-1处是原花青素分子中C-C的伸缩振动,818 cm-1处的吸收峰可能是由于苯环上有3个相邻的H存在产生的,771 cm-1处芳香环的不饱和C-H面外变形振动。对于原花青素基本结构单元构成的分析,主要集中在1 000~1 650 cm-1和700~850 cm-1这2个特征骨架振动波数区域。1 520~1 540 cm-1间只有一个单峰,说明莲子皮原花青素提取物主要是由儿茶素的结构单元构成的原花青定聚合物。另外,在730~780 cm-1范围内,原花青素纯化物的红外谱图在770~780 cm-1处有一个单峰,730 cm-1处没有吸收峰,进一步确定原花青素是以原花青定为主的聚原花青素[13]。
2.2 红莲外皮原花青素反相液相色谱扫描分析
通过聚酰胺的进一步纯化,用3个不同体积分数丙酮溶液洗脱得到0%丙酮洗脱物(M1)、30%丙酮洗脱物(M2)、50%丙酮洗脱物(M3)3个洗脱片段。3个片段的液相色谱图见图2。

图2 聚酰胺柱分级洗脱片段的RP-HPLC分析Fig.2 RP-HPLC analysis of fractions eluted with aqueous acetone solvents
红莲外皮原花青素由于聚合度的不同,分子的大小及所含羟基的数目会有很大的差别,从而导致其极性也有很大差异。因此采用分级洗脱的方法,即用不同体积分数(不同极性)是对提取物的成分加以分离和鉴定是常用的方法。聚酰胺柱分级洗脱的原理就是聚酰胺分子中含有非极性的脂肪键和极性的酰胺基团。当流动相为极性较强的溶剂(如水、丙酮等)时,聚酰胺作为非极性的固定相,其层析行为类似反相分配层析,故极性较大的吸附物容易被洗脱。随着洗脱剂的极性降低,极性较小的化合物就会相继被洗脱下来[14]。本实验选用丙酮溶液进行洗脱。因为水的极性比丙酮大,故随着丙酮体积分数的增大,其极性则会逐渐降低。由图2可知,不同体积分数不同极性下洗脱下来的原花青素片段有一定的差别,但具体组分还有待做进一步的液质联用分析才能确定。
2.3 LC-MS结果分析
对M1、M2、M33个片段进行液质联用分析,根据准分子离子m/z进行选择离子检测,红莲外皮聚酰胺纯化物中原花青素的基本组成的初步分析见表1。
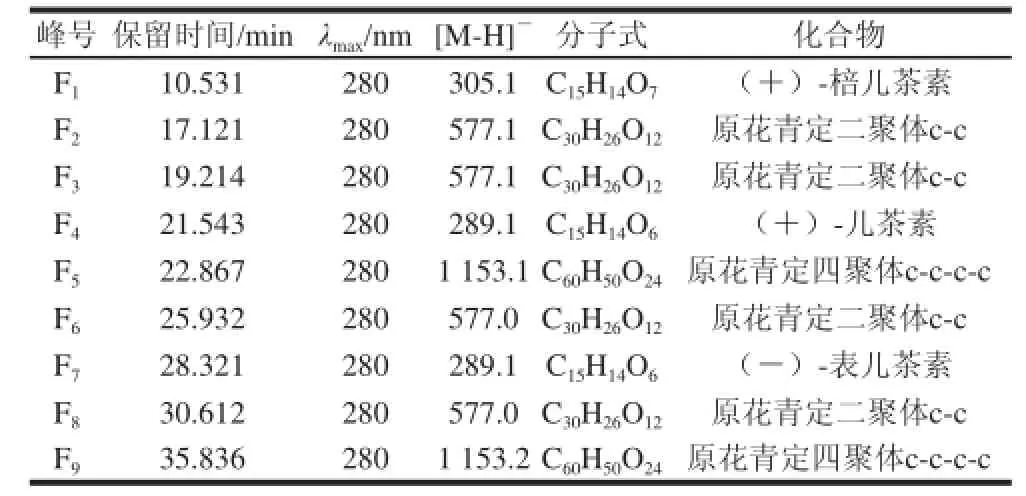
表1 10%、30%和50%丙酮洗脱片段原花青素主要成分的质谱信息Table 1 Analytical data for the fractions eluted with 10%, 30% and 50% acetone in water
通过和标准品共同进样,得出在10.531 min的为棓儿茶素(F1),21.543 min的为儿茶素(F4),28.321 min的为表儿茶素(F7)。二聚体在17.121、19.214、25.932、30.612 min时均为577,可以断定四者为儿茶素与表儿茶素构成的原花青素二聚体的同分异构体。在22.867、35.836 min时,相对分子质量为1 153,推断出可能是原花青定四聚体[14-18]。
由此可以看出,在丙酮体积分数较低时,洗脱出来的主要是儿茶素和表儿茶素的单体和一种原花青定二聚体。随着丙酮体积分数的增加,洗脱出来的原花青素的聚合度也逐渐增大。此现象可以解释为,水的极性比丙酮大,随着丙酮体积分数的增加,丙酮溶液的极性就越来越低,根据极性相吸的原理,低浓度高极性的丙酮溶液会洗脱出原花青素成分儿茶素和表儿茶素单体应该是强极性的,而丙酮体积分数增加极性减弱,原花青素聚合度越来越大极性也越来越弱。从理论上讲,原花青素分子中不仅存在氢键与范德华力两种,还会存在色散力。氢键的作用力是由分子内羟基或不同分子之间的羟基产生的;范德华力是广泛存在于所有分子之间的;而色散力则与分子的大小和空间构型有一定的关系,也对分子的极性产生影响。当原花青素聚合度增加时,羟基的数目也会增加使极性增大,而色散力的增加则会使极性减小,两种完全相反的作用力会使聚合体原花青素极性发现变化。本实验的研究表明,随着聚合度的增加,原花青素极性降低了,故应该是色散力起了主导作用[17]。因此,通过改变洗脱液的极性以达到不同聚合度原花青素的初步分离无论在理论还是在实践上都是可行的。另外,关于莲属中原花青素的研究,虽然对莲子外皮的研究很少,但是已有科研人员对莲蓬进行了研究。Ling Zhiqun等[18]通过对莲蓬的原花青素的纯化和分析发现,原花青素的主要相对分子质量分布为290、578、730、866、1 018和1 154等,说明聚合体主要是由儿茶素或表儿茶素组成的原花青定,而这一结论与本研究中莲子外皮提取的原花青素主要成分基本相同。
2.4 二级质谱分析
为进一步确认原花青素的结构,对二聚体(m/z 577)和四聚体(m/z 1 153)进行了二级质谱分析。文献报道的原花青素聚合体主要的降解方式包括:1)黄酮间连接键的断裂;2)RDA反应,即逆迪尔斯-阿德尔反应,发生在C2和O,C3和C4键的断裂;3)C环开环后,失去一个间苯三酚单元[21]。而原花青素的碎片断裂方式已经被许多研究者证实[20-25]。
为便于区分原花青素结构中的黄烷醇单元,Porter提出了一种用黄烷类内部结合的位置来命名的方法,包括只有C4键和其他基团相连的称为T-Unit,既有C4也有C6或者C8与其他基团相连的被称为M-Unit,而只有C6或者C8与其他基团相连的,被称为B-Unit[19]。

图3 原花青定二聚体([M-H] 577)的CID-MS-MS图谱Fig.3 CID-MS-MS spectrum of procyanidin dimer ([M-H] of m 577)

表2 原花青定二聚体的二级质谱主要碎片Table 2 Main masses in the MS-MS spectrum of procyanidin dimer
二聚体原花青定F2、F3、F6和F8(m/z 577)二级质谱图断裂方式相同,均产生两个主要碎片m/z 407、m/z 289(图3和表2)。,为二聚体发生RDA(Retro Diels-Alder reactions)反应并脱水的产物。RDA是二聚体裂解的主要碎片,而脱水反应产物也常被检测到,甚至比RDA反应更强烈。(m/z=289)为C4-C8键断裂,失去一个(表)儿茶素单元(Cat)后的产物。
四聚体(F5、F9)的碎片分析方式相同。F5产生了5个碎片,包括m/z 1001、865、695、575、287(图4和表3);F9也产生了5个碎片,包括m/z 865、739、575、423、287(图5和表4)。黄烷骨架C环的RDA裂解失去C8H8O3碎片(m/z 152),剩下碎片m/z 1 001。黄烷醇连接键的裂解有两种方式。一种裂解为失去T-unit的碎片,而产生包含B-unit的二聚体和三聚体碎片即[MB-H]-(m/z 865)和[MB-H]-(m/z 577)。另一种则相反为失去B-unit的碎片,而产生包含T-unit的二聚体和三聚体碎片即[MT-H]-(m/z 865)和[MT-H]-(m/z 575)。其中m/z 865失去C6H6O3得m/z 739,m/z 575失去C8H8O3得m/z 423。准分子离子m/z 695为四聚体在黄烷醇连接键裂解后的RDA产物。

图4 原花青定四聚体FCID-MS-MS图谱Fig.4 CID-MS-MS spectrum of procyanidin tetramer F5 ([M-H]-, m/z 1 153)
表3 原花青定四聚体F3)的二级质谱主要碎片Table 3 Major masses in the MS-MS spectrum of procyanidin tetrame

表3 原花青定四聚体F3)的二级质谱主要碎片Table 3 Major masses in the MS-MS spectrum of procyanidin tetrame
m/z 裂解途径 碎片1 153.2 [M-H]-1 001.2 [M-C8H8O3-H]-RDA裂解产物865.2 [M-C15H12O6-H]- 黄酮间连接键的断裂失去T单元(Mr288)的产物695.1[M-C15H12O6-C8H8O3-H2O-H]- 黄酮间连接键的断裂失去T单元(Mr288)后的RDA裂解产物575.1 [M-C30H26O12-H]- 黄酮间连接键的断裂失去B单元和M单位(Mr578)后的产物287.1 [M-C45H38O18-H]- 黄酮间连接键的断裂失去B单元和2个M单位(Mr866)后的产物

图5 原花青定四聚体FCID-MS-MS图谱Fig.5 CID-MS-MS spectrum of procyanidin tetramer F9 ([M-H]- of m/z 1 153)
表4 原花青定四聚体F9([M)的CID-MS-MSS图谱Table 4 Major masses in the MS-MS spectrum of procyanidin tetrammeerr FF9 ([MM--HH]]- ooff m/zz 1 115533))

表4 原花青定四聚体F9([M)的CID-MS-MSS图谱Table 4 Major masses in the MS-MS spectrum of procyanidin tetrammeerr FF9 ([MM--HH]]- ooff m/zz 1 115533))
m/z 裂解途径 碎片1 153.2 [M-H]-865.2 [M-C15H12O6-H]- 黄酮间连接键的断裂失去T单元(Mr288)后的产物739.2 [M-C15H12O6-C6H6O3-H]- 黄酮间连接键的断裂失去T单元(Mr288)后的RDA裂解产物575.1 [M-C30H26O12-H]- 黄酮间连接键的断裂失去B单元和M单元(Mr578)后的产物423.1 [M-C30H26O12-C8H8O3-H]- 黄酮间连接键的断裂失去B单元和M单元(Mr578)后的RDA裂解产物287.1 [M-C45H38O18-H]- 黄酮间连接键的断裂失去B单元和2个M单元(Mr866)后的产物
3 结 论
3.1 通过近红外光谱扫描,初步确定了红莲外皮原花青素大孔树脂提取物的主要结构单元是由儿茶素或表儿茶素单元构成的原花青定聚合物。
3.2 通过聚酰胺的纯化,用不同体积分数丙酮溶液洗脱得到10%丙酮洗脱物(M1)、30%丙酮洗脱物(M2)、50%丙酮洗脱物(M3)3个洗脱片段。通过HPLC-ESI-MS分析发现随着丙酮体积分数的增加,洗脱出来的原花青素的聚合度也逐渐增大,因此通过分级洗脱可以达到分离不同聚合度原花青素的目的。
3.3 通过HPLC-ESI-MS/MS对原花青素分级洗脱片段在负离子条件下的检测和二级质谱对结构的进一步分析,使得红莲外皮原花青素的基本成分得到了确认,包括儿茶素、表儿茶素单体(m/z 289)、棓儿茶素单体(m/z 305),4种原花青定二聚体的同分异构体(m/z 577)和2种四聚体(m/z 1153)。其中二级质谱研究发现,4种二聚体均含有荷质比为407和289的碎片信息,一种四聚体含有1 001、865、695、575、287的碎片信息,另一种四聚体含有865、739、575、423和287的碎片信息。
[1] 周海超, 林益明, 柴纬明, 等. 反射模式与线性模式MALDI-TOF MS联合分析荔枝果核缩合单宁[J]. 化学学报, 2011, 59(24): 2981-2986.
[2] 石碧. 植物多酚[M]. 北京: 科学出版社, 2000: 45-52.
[3] SAINT-CRICQ-DE-GAULEJAC N, VIVAS N, FREITAS V, et al. The influence of various phenolic compounds on scavenging activity assessed by an enzymatic method[J]. Journal of the Science of Food and Agriculture, 1999, 79(8): 1081-1090.
[4] SILVA J M R D, DARMON N, FERNANDEZ Y, et al. Oxygen free radical scavenger capacity in aqueous models of different procyanidins from grape seeds[J]. Journal of Agricultural and Food Chemistry , 1991, 39(9): 1549-1552.
[5] LOTITO S B, ACTIS-GORETTA L, RENART M L, et al. Influence of oligomer chain length on the antioxidant activity of procyanidins biochemical and biophysical research communications[J]. Biochemical and Biophysical Research Communications, 2000, 276(3): 945-951.
[6] FOO L Y. Proanthocyanidins: gross chemical structures by infrared spectra[J]. Phytochemistry, 1981, 20(6): 1397-1402.
[7] WU Yanwen, SUN Suqin, ZHOU Qun, et al. Fourier transform midinfrared (MIR) and near-infrared (NIR) spectroscopy for rapid quality assessment of Chinese medicine preparation Honghua oil[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 46(3): 498-504.
[8] KIEHNE A, ENGELHARDT U H. Thermospray-LC-MS analysis of various groups of polyphenols in tea[J]. Zeitschrift für Lebensmitteluntersuchung und-Forschung A, 1996, 202(1): 48-54.
[9] KHALLOUKI F, HAUBNER R, HULL W E, et al. Purification and identification of ellagic acid derivatives, catechins, and procyanidins from the root bark of Anisophyllea dichostyla R. Br[J]. Food and Chemical Toxicology, 2007, 45(3): 472-485.
[10] PRASAIN JK, PENG N, DAI Y, et al. Liquid chromatography tandem mass spectrometry identification of proanthocyanidins in rat plasma after oral administration of grape seed extract[J]. Phytomedicine, 2009, 16(2/3): 233-243.
[11] MONAGAS M, QUINTANILLA-LOPEZ J E, GOMEZ-CORDOVES C, et al. RMALDI-TOF MS analysis of plant proanthocyanidins[J]. Pharm Biomed Anal, 2010, 51(2): 358-372.
[12] FULCRAND H, MANE C, PREYS S, et al. Direct mass spectrometry approaches to characterize polyphenol composition of complex samples[J]. Phytochemistry, 2008, 69(18): 3131-3138.
[13] 李春阳, 张红城, 王乃富, 等. 葡萄籽原花青素的单元结构[J]. 江苏农业学报, 2010, 26(5): 1070-1077.
[14] 薛扬, 吴唯. 聚酰胺树脂的层析分离应用[J]. 化工新型材料, 2005, 33(4): 50-53.
[15] FRIEDRICH W, EBERHARDT A. Galensa RInvestigation of proanthocyanidins by HPLC with electrospray ionization mass spectrometry[J]. The Journal European Food Research and Technology, 2000, 211(1): 56-64.
[16] 刘睿, 段玉清, 谢笔钧. 高粱外种皮中原花青素的提取工艺及其组分鉴定[J]. 农业工程学报, 2004, 20(1): 242-245.
[17] 樊金玲, 武涛, 陶冠军. 沙棘籽原花色素寡聚体和多聚体的研究[J].中草药, 2007, 38(9): 1292-1298.
[18] WU Qingli, WANG Mingfu, JAMES E. Determination of proanthocyanidins in grape products by liquid chromatography/mass spectrometric detection under low collision energy[J]. Anal Chem, 2008, 95: 2345-2349.
[19] 吴朝霞. 葡萄籽原花青素分离提纯、组分鉴定及抗氧化性研究[D].沈阳: 沈阳农业大学, 2005.
[20] LING Zhiqun, XIE Bijun, YANG Erling. Isolation, characterization, and determination of antioxidative activity of oligomeric procyanidins from the seedpod of Nelumbo nucifera Gaertn[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2441-2445.
[21] FREIDRICH W, ELBERHARDT A, GALENSA R. Investigation of proanthocyanidins by HPLC with electrospray ionization mass spectrometry[J]. The Journal European Food Research and Technology, 2000, 211: 56-64.
[22] KARONEN M, LOPONEN J. Analysis of procyanidins in pine bark with reversed-phase and normal-phase high-performance liquid chromatography-electrospray ionization mass spectrometry[J]. Analytica Chimica Acta, 2004, 522(1): 105-112.
[23] 任其龙, 魏冠红, 金米聪, 等. 反相高效液相色谱-电喷雾质谱法鉴定葡萄籽低聚原花青素[J].分析与检测, 2006, 32(3): 79.
[24] MONAGAS M, GOMEZ-CORDOVES C, BARTOLOME B, et al. Monomeric, oligomeric, and polymeric flavan-3-ol composition of wines and grapes from Vitis vinifera L. Cv. Graciano, Tempranillo, and Cabernet Sauvignon[J]. Journal of Agricultural and Food Chemistry, 2003, 51(22): 6475-6481.
[25] WOLLGAST J, PALLARONI L, AGAZZI M E, ANKLAM E. Analysis of procyanidins in chocolate by reversed-phase highperformance liquid chromatography with electrospray ionisation mass spectrometric and tandem mass spectrometric detection[J]. Journal of Chromatography A, 2001, 926: 211-220.
[26] YOKOZAWA T, LEE YA, CHO EJ, MATSUMOTO K, PARK CH, SHIBAHARA N, Anti-aging effects of oligomeric proantho-cyanidins isolated from persimmon fruits[J]. Drug Discov Ther, 2011, 5(3):109-118.
Purification and Analysis of Proanthocyanidins from Red Peel of Lotus Seeds
LI Qi-li1,2, PENG Fang-Gang1, LIU De-ming3, LIU Zhen-bao4, WU Wei-guo1,*
(1. Hunan Provincial Key Laboratory of Food Science and Biotechnology, College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Agricultural Product Processing Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, China; 3. Hunan Provincial Key Laboratory of Crop Germplasm Innovation and Utilization, Analysis and Tes ting Center of National Key Laboratory, Hunan Agricultural University, Changsha 410128, China; 4. School of Pharmaceutical Sciences, Central South University, Changsha 410013, China)
Proanthocyanidins, a large class of polyphenols, are widely present in natural plants. In this study, proanthocyanidins extracted from the red peel of lotus seeds were purified by a macroporous resin AB-8 and a polyamide column. Chromatographic eluates were analyzed by infrared spectroscopy (IR) and electrospray ionization-mass spectroscopy ( ESI-MS). The separated components of proanthocyanidins were further confirmed by reverse phase highperformance liquid chromatography-mass spectroscopy (RP-HPLC-MS/MS) to be nine monomers and oligomers of proanthocyandins including (+)-catechin, (-)-epicatechin (m/z 28 9), (+)-gallocatechin (m/z 305), four isomeric compounds of procyanidin dimers (m/z 577) and two tetramers (m/z 1 153).
lotus seed; proanthocyanidi ns; infrared spectroscopy; reverse phase highperformance liquid chromatography-mass spectroscopy
TS264.3
A
1002-6630(2014)03-0106-05
10.7506/spkx1002-6630-201403022
2013-04-18
李绮丽(1986—),女,博士研究生,研究方向为园艺产品采后科学与技术。E-mail:liqili1986@gmail.com
*通信作者:吴卫国(1968—),男,教授,博士,研究方向为食品科学。E-mail:wuweiguo1986@sina.cn
