动物源性食品中志贺氏菌实时荧光定量PCR快速检测方法的建立
2014-01-16李丹丹徐义刚王绥家高慎阳李一经
李丹丹,徐义刚,王绥家,高慎阳,李一经
(1.海南出入境检验检疫局检验检疫技术中心,海口 570311;2.黑龙江出入境检验检疫局检验检疫技术中心,哈尔滨 150001;3.辽宁医学院畜牧兽医学院,辽宁锦州 121001;4.东北农业大学动物医学学院,哈尔滨 150030)
动物源性食品中志贺氏菌实时荧光定量PCR快速检测方法的建立
李丹丹1,徐义刚2*,王绥家1,高慎阳3,李一经4
(1.海南出入境检验检疫局检验检疫技术中心,海口 570311;2.黑龙江出入境检验检疫局检验检疫技术中心,哈尔滨 150001;3.辽宁医学院畜牧兽医学院,辽宁锦州 121001;4.东北农业大学动物医学学院,哈尔滨 150030)
根据志贺氏菌属高度保守的ipaH基因序列,设计探针和引物,通过优化反应条件,建立检测动物源性食品中志贺氏菌实时荧光定量PCR方法,应用于动物源性食品中志贺氏菌的快速检验。结果表明,该法灵敏度约为2.8 cfu·mL-1,经对205份肉类、蛋、奶及其制品和动物腹泻物、人工污染样品等进行检测,共检出13份阳性样本,与国标(GB 4789.5-2012)方法的检测结果一致。表明建立的荧光PCR方法操作简便、特异性强、灵敏度高,具有良好实用性。
志贺氏菌;ipaH基因;荧光定量PCR;快速检测
志贺氏菌(Shigella)是引起人类急性感染性痢疾最为常见的病原菌,俗称痢疾杆菌,夏、秋季多发。人类主要通过食用被志贺氏菌污染的食品而感染发病,苍蝇可作为机械性媒介,水源性传播不常见,卫生条件差的拥挤人群中最易发生流行,全身中毒症状和大肠化脓性炎症为主要临床特征,此菌对婴幼儿具有致命性,是重要的食源性致病菌[1-4]。建立志贺氏菌快速、准确、灵敏、特异的检测方法,为及时有效控制食源性传染病提供依据。
目前我国针对进出口动物性食品中志贺氏菌检验检疫主要采用常规增菌培养、生化鉴定及自动酶联荧光免疫检测方法相结合。存在操作程序多、费时费力、检出效率低、检测灵敏度不高、假阴性普遍等不足[5-8]。荧光PCR技术具有快速、简便、灵敏等优点,与常规PCR方法相比,由于引物和探针的“双保险”,因此特异性更强、自动化程度更高,可实现实时在线检测,PCR扩增过程无需对PCR扩增产物进行后处理,可有效解决PCR产物污染导致的假阳性及不能准确定量问题,成为检测领域重要的检测手段[9-11]。食源性致病菌快速检测技术建立将提高食源性致病菌检测效率和检测通量,为不同条件的检测机构提供技术支持,满足食品中致病菌快速检测要求,更好地保障食品安全,有利于国内外贸易发展,在食品卫生与食品安全检测方面具有重要意义。本研究旨在建立一种快速、准确检测动物源性食品中志贺氏菌方法,提高食源性志贺氏菌的检测效率,为动物源性食品致病微生物监测提供技术手段。
1 材料与方法
1.1 菌株
试验用菌株多购自美国典型菌种保藏中心(ATCC)和中国医学微生物菌种保藏管理中心(CMCC),部分菌株由海南出入境检验检疫局检验检疫技术中心实验室和黑龙江出入境检验检疫局检验检疫技术中心实验室分离保存(见表1)。细菌培养基购于北京陆桥技术有限公司。
表1 试验用菌株Table 1 Bacteria stains
1.2 主要试剂
DNA聚合酶、dNTP购自TaKaRa(大连)公司;细菌基因组DNA提取试剂盒购自TIANGEN生物技术公司;肉类、蛋奶及其制品购自海南兴成农贸市场;动物腹泻物采自海南阳光畜禽饲养场。
1.3 主要仪器
ABI7500Real-timePCR仪,购自美国ABI公司。
1.4 方法
1.4.1 待检菌株的培养
样品的制备及增菌培养参照国家标准GB 4789.5-2012进行。
1.4.2 细菌基因组DNA的提取
按DNA提取试剂盒的操作说明进行。
1.4.3 引物与探针的设计
根据志贺氏菌ipaH基因序列(登录号:M76445),用引物设计软件Prmier 5.0设计一对特异性引物和Taqman探针。
引物序列如下:F:CGCAATACCTCCGGATTCC R:TCCGCAGAGGCACTGAGTT
Taqman探针为:Fam-AACAGGTCGCTGCATG GCTGGAA-MGB
引物和探针由Invitrogen公司合成。
1.4.4 实时荧光PCR反应条件优化
25μL反应体系:rTaq酶(5 U·μL-1)用量范围0.25~2 μL,以0.25 μL递增;Mg2+(25 mmol·μL-1)用量范围0~4 μL,以每0.4 μL递增;dNTP(2.5 mmol·μL-1)用量范围0.5~2.5 μL,以0.25 μL递增。引物(20 pmol·μL-1)的用量范围0.1~0.8 μL,以0.1 μL递增;探针(10 μmol·μL-1)用量范围0.1~0.5 μL,以每0.05 μL递增。反应程序:95℃5 min;95℃5 s,60℃40 s(此步骤收集荧光信号),进行40个循环,每次试验均包括阴性对照。
1.4.5 方法的灵敏度试验
将过夜培养的标准试验用菌株采用平板菌落记数法测定菌体浓度,然后将培养菌液按10倍梯度稀释法进行系列稀释,每个浓度梯度设3个平行,提取细菌基因组DNA,进行实时荧光PCR检测,以确定检测方法的灵敏度。
1.4.6 方法的特异性试验
采用试剂盒法提取表1中菌株的基因组DNA,进行实时荧光PCR试验,以验证本方法的特异性。
1.4.7 方法的实用性试验
采集涉及肉类、豆制品、水产品、奶类、人工污染样品、动物腹泻物等样本,利用实时荧光PCR方法进行检测,国标法作为参考,以评价建立方法的实用性。

图1 志贺氏菌实时荧光PCR检测方法的建立Fig.1 Development of a dual real-time PCR reaction system
表2 采集样品数量及类型Table 2 Number and type of samples collected
2 结果与分析
2.1 志贺氏菌实时荧光PCR检测方法的建立
以志贺氏菌属高度保守的ipaH基因为靶基因,设计引物和探针,经反应体系优化,建立志贺氏菌实时荧光PCR检测方法。反应体系为:rTaq酶(5 U·μL-1)0.25 μL,dNTP(25 mmol·μL-1)1.5 μL,探针(10 μmol·μL-1)0.15 μL,下游引物浓度(20 pmol·μL-1)0.5 μL,Mg2+(25 mmol·μL-1)2.4 μL,DNA模板0.5 μL DEPC水18.7 μL。以建立的实时荧光PCR反应体系检测志贺氏菌,结果见图1,出现典型的实时荧光PCR扩增曲线,表明建立的实时荧光PCR反应体系适用于志贺氏菌检测。
2.2 灵敏度试验结果
将浓度约2.8 cfu·mL-1的志贺氏菌进行10倍梯度稀释,采用试剂盒提取每个稀释度志贺氏菌的基因组DNA,以此作为模板进行实时荧光PCR检测,确定检测方法的灵敏度,检测结果见图2。
由图2可以看出,原始菌液稀释至10-7时仍能检出,表明本检测方法对志贺氏菌的检测灵敏度约为2.8 cfu·mL-1。
2.3 特异性试验结果
提取表1中菌株的基因组DNA,利用建立的实时荧光PCR方法进行检测,以验证建立的实时荧光PCR检测方法的特异性。结果见图3,仅志贺氏菌为阳性,其他菌株均为阴性,说明该方法具有良好的特异性。
2.4 方法的实用性
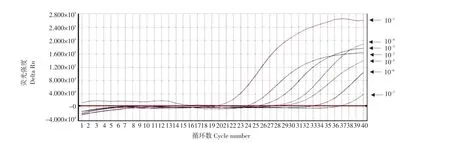
图2 志贺氏菌实时荧光PCR检测灵敏度Fig.2 Sensitivity of a dual real-time PCR reaction system
利用建立的志贺氏菌实时荧光PCR检测方法共计检测样品205份,涉及肉类、豆制品、水产品、奶类、人工污染样品、动物腹泻物等,检测结果采用国标法进行验证。结果表明,试验中没有出现假阳性和假阴性,而且实时荧光PCR方法检测结果与国标法检测结果相符,说明该荧光PCR方法具有良好的实用性(见表3)。
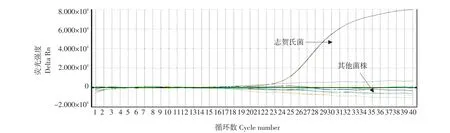
图3 志贺氏菌实时荧光PCR方法特异性结果Fig.3 Specificity of a dual real-time PCR reaction system
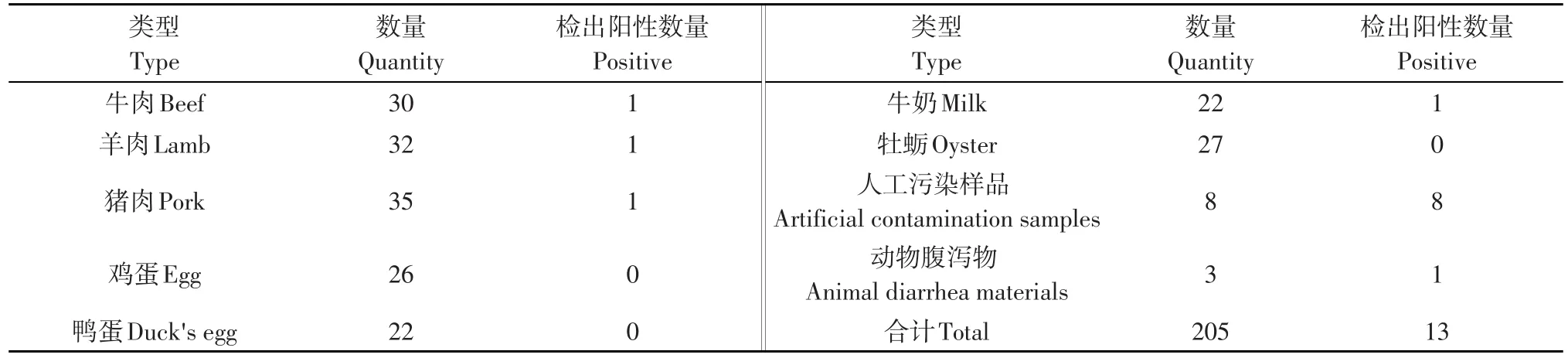
表3 实际应用结果Table 3 Results of practical application
3 讨论与结论
志贺氏菌引起细菌性痢疾,常为食物爆发型或经水传播。人和灵长类是其适宜宿主,根据宿主的健康状况和年龄,只需10个细菌细胞就可致病,致病性极强,是重要的食源性致病菌。建立快速、准确易于推广使用的检测方法对预防和控制志贺氏菌感染、保障食品安全具有重要意义。
荧光定量PCR技术是新的PCR检测技术,因其具有检测范围广、敏感度高、特异性好等优点而被广泛应用于微生物检测[12-16]。本研究选择志贺氏菌属高度保守的ipaH基因为靶基因,进行志贺氏菌荧光定量PCR快速检测方法研究。利用建立荧光定量PCR方法对包括志贺氏菌在内的15种共21株细菌进行检测,结果显示,其中7株志贺氏菌检测为阳性,而其他细菌检测为阴性,说明引物和探针具有高度特异性。为确定该方法检测灵敏度,对已知浓度的致病菌进行10倍倍比稀释,提取每个稀释度细菌基因组DNA作为模板进行实时荧光PCR检测,结果显示,原始菌液稀释至10-7时仍能检出,表明本检测方法对志贺氏菌的检测灵敏度约为2.8 cfu·mL-1。
对定量PCR反应体系进行优化,确立定量PCR检测最佳反应条件。经对205份肉类、蛋、奶及其制品和动物腹泻物、人工污染样品等进行检测,共检出13份阳性样本。所建立志贺氏菌实时荧光定量PCR检测技术保留常规PCR检测的特异性和敏感性,整个过程由电脑控制,从加样到结果需2 h。通过对肉类、蛋、奶及其制品和动物腹泻物、人工污染样品等样品的检测证实,本研究建立的动物源性食品中志贺氏菌实时荧光定量PCR快速检测方法操作简便、快速、特异性强、灵敏度高。
[1]Wang L,Reeves P R.Organization of Shigella antigen gene cluster and identification of its specific genes[J].Infect Immunity,2012, 66(11):3545-3511.
[2]Zheng H,Jing H,Wang H,et al.Stx2vha is the dominant genotype of Shiga toxin-producing Shigella isolated from patiens and domestic animals in three regions of China[J].Microbio Immunol, 2011,49(12):1019-1025.
[3]Paton A W,Paton J C.Mechanisms of Salmonella entryinto host cells[J].Cell Microbiol,2012,9(9):1211-1214.
[4]Jun Y,Shioko S.In vitro effect of subinhibitory concentrations of antibiotics on biofilm formationby clinical strains of Salmonella enterica serovar Typhimurium isolated in Slovakia[J].J Appl Microbiol,2010,104(5):1294-1299.
[5]Mossong J,Marques P,Ragimbeau C,et al.Outbreaks of monophasic Salmonella enterica serovar in Luxembourg[J].Euro Surveill,2011,12(6):209-214.
[6]Stephens N,Sault C,Firestone S M,et al.Largeoutbreaks of Salmonella Typhimurium phage type 135 infectionsassociated with the consumption of products containing raw egg in Tasmania [J].Commun Dis Intell,2010,31(1):115-120.
[7]Wise M G,Healy M,Reece K.Outbreaks of Salmonella in infants associated with powdered infant formula[J].Kokuritsu Iyakuhin Shokuhin Eisei Kenkyusho Hokoku,2009,124:69-74.
[8]Dominguez A,Torner N.Foodborne Salmonella-caused outbreaks in Catalonia(Spain),1990 to 2003[J].J Food Prot,2009,70(1): 209-212.
[9]Doublet B,Weill F X,Fabre L,et al.Variant Salmonella genomic island 1 antibiotic resistance gene cluster containing anovel 3-N-aminoglycoside acetyl transferase gene cassette,Aac(3)Id, in Salmonella enterica serovar newport[J].Antimicrob Agents Chemother,2008,48(10):3806-3812.
[10]Eaves D J,Randall L,Gray D T,et al.Prevalence of mutations within the quinolone resistance-determining region ofgyrA,gyrB, parC,and parE and association with antibioticresistance in quinolone resistant Salmonella enterica[J].Antimicrob Agents Chemother, 2004,48(10):4005-4012.
[11]严睿,朱凤才.志贺菌分子生物学检测技术研究进展[J].中国病原生物学杂志,2008,3(6):464-467.
[12]钟青萍,葛萃萃,张世伟,等.检测食品中志贺氏菌的双抗夹心ELISA方法的研究[J].食品科技,2007(10):199-202.
[13]李文涛,王俊东,杨利峰,等.实时荧光定量PCR技术及其应用[J].生物技术通讯,2006,17(1):112-114.
[14]Brown T M,Osorio F A,Rock D L.Seki1Duplex real-time SYBR Green PCR assays for detection of 17species o f food or waterborne pathogens in stools[J].Clin Microbio,2003,41(11):5134-5146.
[15]Anna Casabianca.Development of a real-time PCR assay using SYBR Green PCR assays for provirus load quantification in a murine model of AIDS[J].Clin Microbio,2004,42(9):4361-4364.
[16]Amazaki W,Taguchi M,Ishibashi M,et al.Development and evaluationof a loop-mediated isothermal amplification assay forrapid and simple detection of Campylobacter jejuni and Campylobacter coli[J].Clin Microbiol,2008,57:444-451.
Development of a dual real-time PCR for the rapid detection ofShigellain animal-origined food
LI Dandan1,XU Yigang2,WANG Suijia1,GAO Shenyang3,LI Yijing4(1.Inspection and Quarantine Technology Center of Hainan Entry-Exit Inspection andQuarantine Bureau,Haikou 570311,China;2.Inspection and Quarantine Technology Center of Heilongjiang Entry-Exitn Inspection and Quarantine Bureau,Harbin 150001,China;3.Department of Animal Husbandry and Veterinary Medicine,Liaoning Medical University,Jinzhou Liaoning 121001,China; 4.School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
AccordingShigellaipaH highly conserved gene sequences,probes and primers designed by optimizing the reaction conditions,the establishment of foods of animal originShigella real-time PCR method,used in foods of animal origin Shiga rapid test forShigella.The results showed that the sensitivity of a dual real-time PCR was 2.8 cfu·mL-1.13 from 205 samples of meat,egg,milk and itsproducts,animal diarrhea materials and artificial contamination samples were positive in a dual real-time PCR assay,which was in accordance with the testing result according to GB 4789.5-2012.The results showed that a dual real-time PCR assay developed in this work was simple,specificity, high sensitivity,good practicality for the detection ofShigella.
Shigella;ipaHgene;real-time PCR;rapid detection
S855.1+2
A
1005-9369(2014)08-0098-05
李丹丹,徐义刚,王绥家,等.动物源性食品中志贺氏菌实时荧光定量PCR快速检测方法的建立[J].东北农业大学学报,2014,45 (8):98-102.
Li Dandan,Xu Yigang,Wang Suijia,et al.Development of a dual real-time PCR for the rapid detection ofShigellain animal-origined food[J].Journal of Northeast Agricultural University,2014,45(8):98-102.(in Chinese with English abstract)
2014-01-06
海南省自然科学基金项目(310106);国家质检总局科技项目(2013IK031);国家质检总局科技项目(2012IK157);海南省应用技术研究与开发专项项目(ZDXM20130025)
李丹丹(1979-),女,高级兽医师,博士,研究方向为微生物学与免疫学。E-mail:108074182@qq.com
*通讯作者:徐义刚,高级兽医师,硕士生导师,研究方向为微生物学与免疫学。E-mail:108074182@qq.com
时间2014-7-18 15:01:44[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140718.1501.008.html
