猪沙门氏菌的分离鉴定及其耐药性分析
2014-01-16加春生毛泽明王晓楠王俊峰王龙陈爽葛兰云徐世文
加春生,毛泽明,王晓楠,王俊峰,王龙,陈爽,葛兰云,徐世文
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江农业工程职业学院,哈尔滨 150088;3.哈尔滨鑫广丰牧业有限公司,哈尔滨 150030)
猪沙门氏菌的分离鉴定及其耐药性分析
加春生1,2,毛泽明3,王晓楠2,王俊峰2,王龙2,陈爽2,葛兰云2,徐世文1*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江农业工程职业学院,哈尔滨 150088;3.哈尔滨鑫广丰牧业有限公司,哈尔滨 150030)
对哈尔滨地区规模化猪场沙门氏菌进行分离鉴定,分析其对β-内酰胺类药物的药敏试验结果及耐药情况。采用病原菌的形态学观察、生化鉴定和PCR鉴定,从600份哈尔滨地区规模化猪场猪直肠粪便中分离出沙门氏菌,运用Kirby-Bauer法检测分离菌对10种β-内酰胺类药物的敏感性。结果表明,在哈尔滨地区十市县的猪群中,沙门氏菌的总检出率为5.83%(35/600);不同市县沙门氏菌的总分离率介于3.3%~18.3%;沙门氏菌的分离率与猪日龄有一定关系;对临床常用抗菌药物均表现出较高的耐药性,对氨苄西林100%耐药,对头孢他啶80%耐药,对头孢西丁、哌拉西林、头孢噻肟、头孢吡肟、氨曲南存在不同程度耐药,对碳青霉烯类敏感。结果表明,哈尔滨地区猪场存在不同程度的沙门氏菌感染,耐药现象严重。
猪;沙门氏菌;分离鉴定;耐药性
猪沙门氏菌病又称猪副伤寒[1],常发于6月龄以下的仔猪,1~4月龄多发,临床上可分为急性(败血症)、亚急性和慢性3种类型,常引起较高死亡率,其中败血型病死率达90%,慢性型病死率达25%~50%。临床上常选择抗生素对沙门氏菌进行预防与治疗,由于β-内酰胺类抗生素价格相对低廉,药效独特应用广泛。但猪群沙门氏菌对其产生耐药性屡见报道[2]。本文对哈尔滨地区规模化猪场的猪沙门氏菌带菌情况进行分离鉴定,研究其对β-内酰胺类抗生素耐药情况,了解猪沙门氏菌的流行病学及耐药特征,为探讨防治沙门氏菌病提供科学依据。
1 材料与方法
1.1 样品采集
2012年8月~2012年12月,从黑龙江省哈尔滨地区的10个规模化猪场,分哺乳(19~23 d)、保育(52~58 d)、生长(115~125 d)3个阶段,用棉拭子采集临床健康猪直肠粪便样本,每个猪场60份,每个阶段各采集20份,共计600份,将采集的样品保存于4℃环境中,在24 h内进行细菌分离培养。
1.2 主要试剂
增菌培养、分离培养及生化试验用的各种培养基和沙门氏菌微量生化发酵管购自北京奥博星生物技术有限责任公司产品;沙门氏菌属诊断血清购自兰州生物制品研究所,批号20100101;参考菌株沙门氏菌等由东北农业大学家畜传染病实验室鉴定保存;革兰氏染色液,营养肉汤、BS、SS和三糖铁斜面琼脂培养基均按文献[3]方法制备。
1.3 细菌分离培养
在超净工作台中,样品使用生理盐水,按100、10-1、10-2、10-3和10-4五个梯度进行稀释。将各稀释度的样品,均匀涂布在BS、SS琼脂培养基上,在37℃孵化箱内培养24 h,得到单个细菌菌落。再挑取具有典型特征的疑似菌落,配制成纯培养细菌菌液,取少量于营养琼脂培养基上进行培养,将单个菌落分别接种于营养肉汤培养基,并放于37℃恒温空气震荡浴170 r·min-1中进行扩增12 h。取培养菌苔涂布穿刺接种三糖铁斜面培养基中,恒温培养箱37℃恒温培养24 h。
1.4 沙门氏菌的筛选
菌落经过分离纯化后,根据革兰氏染色后的单个细菌菌体的形态,氧化酶和发酵试验来筛选沙门氏菌。
1.4.1 革兰氏染色
在灭菌的载玻片的中前部滴10 μL菌液,均匀涂布,用酒精灯外焰对菌液进行固定,待冷却后,然后进行染色。其流程如下:
①草酸钱结晶紫染色2 min,用去离子水进行冲洗;②碘液染色1 s,用去离子水进行冲洗;③95%的酒精脱色15~30 s,随即水洗;④复染液染色2 min,水洗,直至洗下的水呈无色为止。
用吸水纸吸取多余水分,待干燥后,油镜下观察。呈现紫色的是革兰氏阳性菌,呈现红色的是革兰氏阴性菌。将观察到的革兰阴性杆状菌进行氧化酶试验和发酵试验进一步筛选。
1.4.2 氧化酶试验
待检菌用灭菌牙签均匀涂布在氧化酶试纸上,30 s内观察结果,呈紫红色的为阳性,阴性呈无色或淡黄色。沙门氏菌的氧化酶试验呈阴性菌。
1.4.3 发酵试验
待检菌用接种环挑取接种到发酵微量生化管中,每株菌接种2支,取出其中一支,加入液体石蜡覆盖,倒置,在37℃恒温培养箱培养24 h,观察记录生化管中颜色变化。不加液体石蜡的变黄色,加液体石蜡管不变色,为氧化型,两支均变黄色则为发酵型。沙门氏菌,发酵试验为发酵型。
1.5 沙门氏菌的鉴定
1.5.1 生化试验
分别用分离的细菌接种三糖铁琼脂斜面,于37℃培养24~48 h后,观察底部和斜面颜色变化以及产气情况,按文献[4]方法对所有分离株进行乳糖、葡萄糖、甘露醇、麦芽糖、蔗糖、M.R、吲哚、枸橼酸盐、V-P10项生化指标的测定。
1.5.2 沙门氏菌分离株的PCR鉴定
对分离纯化菌株进行序列分析,对其进行分子鉴定。
1.5.2.1 16srDNA区的PCR扩增及序列测定
引物见表1。
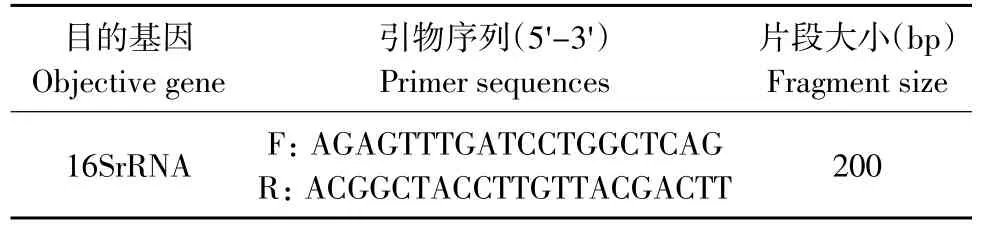
表1 扩增目的基因的引物序列及目的片段长度[5]Table 1 Primer sequence and amplification length of destination fragment
反应体系为重蒸水41 mL,10xbuffer 5 μL,上游引物l μL,下游引物1 μL,dNTP l μL,模板DNA 0.5 μL,Tap酶0.5 μL。
反应条件为94℃预变性7 min;94℃变性1 min;50℃退火l min;72℃延伸l min;共30个循环;72℃延伸10 min。
PCR扩增及检测:采用细菌基因组DNA提取试剂盒提取细菌总DNA,其具体操作方法可以参考产品说明书。
发展序列测定:将PCR扩增产物进行16SrDNA序列测定(上海生物工程技术服务有限公司完成)。
1.5.2.2 16srDNA系列分析
把测序序列在GenBank(http://www.ncbi.nLm. nih.gov/)中Blast比对后,然后选取GenBank中相关序列,利用DNAstar软件绘制进化树和同源相似列表,确定菌株的种属。
1.6 沙门氏菌血清群的鉴定
首先进行O抗原的鉴定,取出一块玻板,清洗干净,抽出10 μL不同血清群沙门氏菌O抗原单因子血清滴于一端,10 μL生理盐水滴于另一端作对照。再在三糖铁上斜面上挑取少量菌苔,与血清混匀,1 min内观察结果。通过O抗原判断所分离的沙门氏菌属于哪一血清群。鉴定O抗原后,再鉴定H(鞭毛)抗原,最后根据H抗原判断沙门氏菌所属种。
1.7 药敏试验
按照CLSI标准进行操作[6],采用K-B纸片扩散法测定6类10种β-内酰胺类抗生素作为药物敏感性试验用抗生素,其中包括头霉素类(FOX);青霉素类(AMP、PIP);碳青霉烯类(ETP、MEC、IPM);第三代头孢菌素类(CAZ、CTX);第四代头孢菌素类(FEP);氧头孢烯类(ATM)。具体抗菌药物粉剂的批号,效价及来源详见表2。
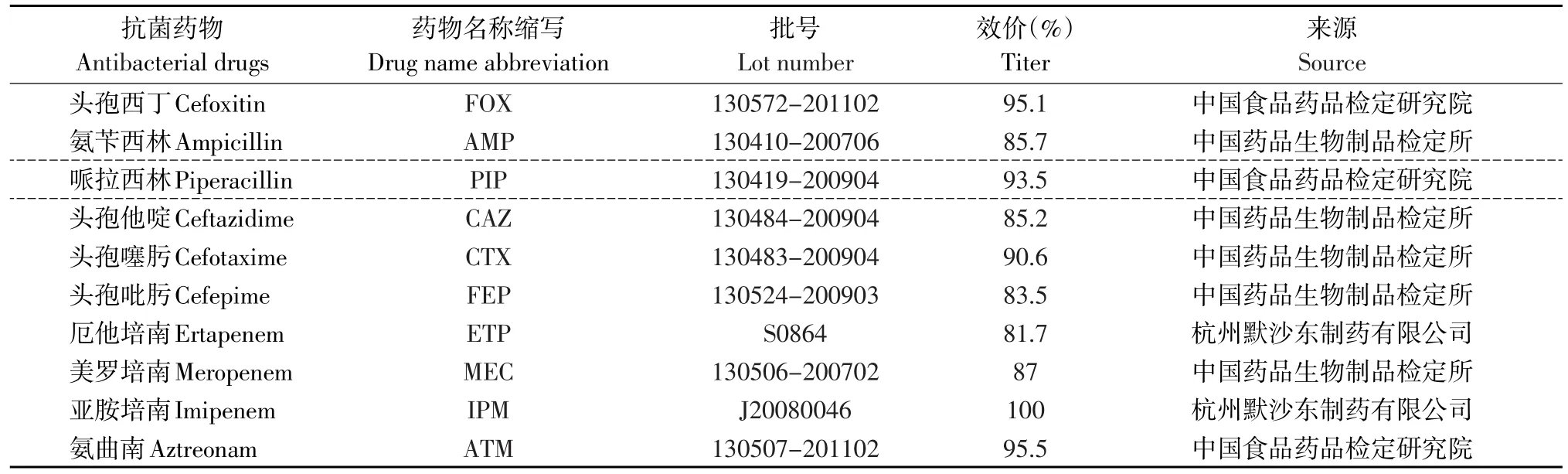
表2 药物敏感性试验所用抗菌药物粉剂的批号、效价及来源Table 2 Lot number,potency and sources of antibiotic in drug susceptibility testing
采用琼脂平皿稀释法测定被测菌株对CTX、CAZ和CIP的MIC值,结果按照CLSI标准进行判断[6]。
2 结果与分析
2.1 临床健康猪直肠沙门氏菌的分离鉴定结果
2.1.1 沙门氏菌分离培养
经增菌培养后的棉拭子样品接种于BS和SS选择性琼脂平板进行纯化,从其中选择有金属光泽的黑色、灰色或棕褐色,菌落周围培养基可呈棕色或黑色,有些菌株形成灰绿色的菌落,产生硫化氢,周围培养基不变的菌落(BS),以及无色透明、细小、圆整、光滑、中心为黑色的菌落(SS)。挑取可疑菌落接种三糖铁培养基,底面黄色,斜面红色,产H2S涂片、革兰氏染色镜检为革兰氏阴性短小杆菌。
2.1.2 沙门氏菌分离株生化试验鉴定结果
分离菌株能分解葡萄糖、甘露醇、麦芽糖,产酸产气;不利用乳糖和蔗糖;能利用枸橼酸盐;不分解尿素;甲基红试验阳性;硫化氢试验产生H2S。由生化试验结果可知分离菌株各项生化试验指标大部分符合沙门氏菌生化特征。
2.1.3 沙门氏菌分离株PCR鉴定结果
对分离菌株进行沙门氏菌16SrDNA序列分析,结果见图1。
2.2 规模猪场临床健康猪沙门氏菌带菌情况
采用常规法与PCR技术结合对600份样本进行检测,共分离到沙门氏菌35株,总检出率为5.83%(35/600)。保育阶段检出率最高为9.44%(17/ 180),结果见表3。
可知保育阶段检出率与哺乳阶段1.5%(3/200)和生长阶段检出率2%(4/200)差异均极显著(P≤0.01),而哺乳阶段与生长阶段检出率差异不显著P>0.05)。
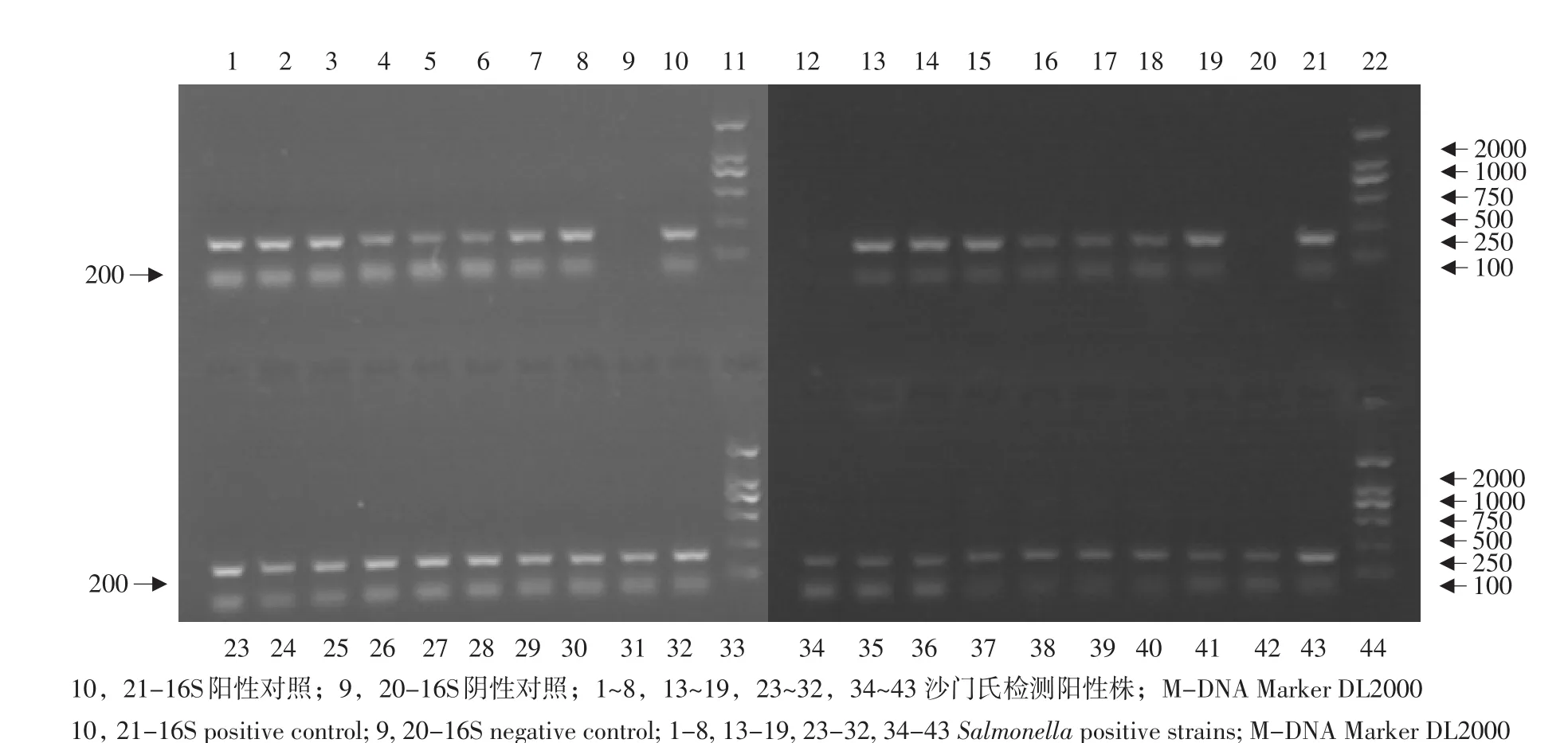
图1 35株沙门氏菌PCR扩增电泳Fig.1 PCR electrophoretogram of 35 Salmonella isolates

表3 不同饲养阶段沙门氏菌的检出率Table 3 Detectable rate of Salmonella in different growth phases
被调查的十个猪场中,以巴彦县猪场检出率最高为18.89%(17/90),结果见表4。
由结果可知巴彦县猪场与其余九个地区猪场之间的检出率差异均极显著(P≤0.01),而这九个猪场之间检出率差异均不显著(P>0.05)。
2.3 血清型分布
35株沙门氏菌共分为3种不同的血清型,其中猪霍乱沙门氏菌为最主要的血清型,共25株,占71.4%(25/35),其次为猪伤寒沙门氏菌,共8株(22.9%),鼠伤寒沙门氏菌2株(5.7%)。具体生长阶段分布情况见表5,地区及猪场分布情况表6。
2.4 药敏试验
35株被测沙门氏菌对10种β-内酰胺类抗生素存在不同的耐药性,对氨苄西林均耐药,80%对头孢他啶耐药,对头孢西丁、哌拉西林、头孢噻肟、头孢吡肟、氨曲南存在不同程度耐药,对厄他培南、美罗培南、亚胺培南均敏感。35株猪沙门氏菌对抗菌药物的耐药谱见表7。

表4 哈尔滨地区不同县市十个猪场沙门氏菌的检出率Table 4 Detectable rate of Salmonella in ten swine farms of different regions in Harbin Citys

表5 不同饲养阶段沙门氏菌的血清型Table 5 Serotype of Salmonella in different growth phases
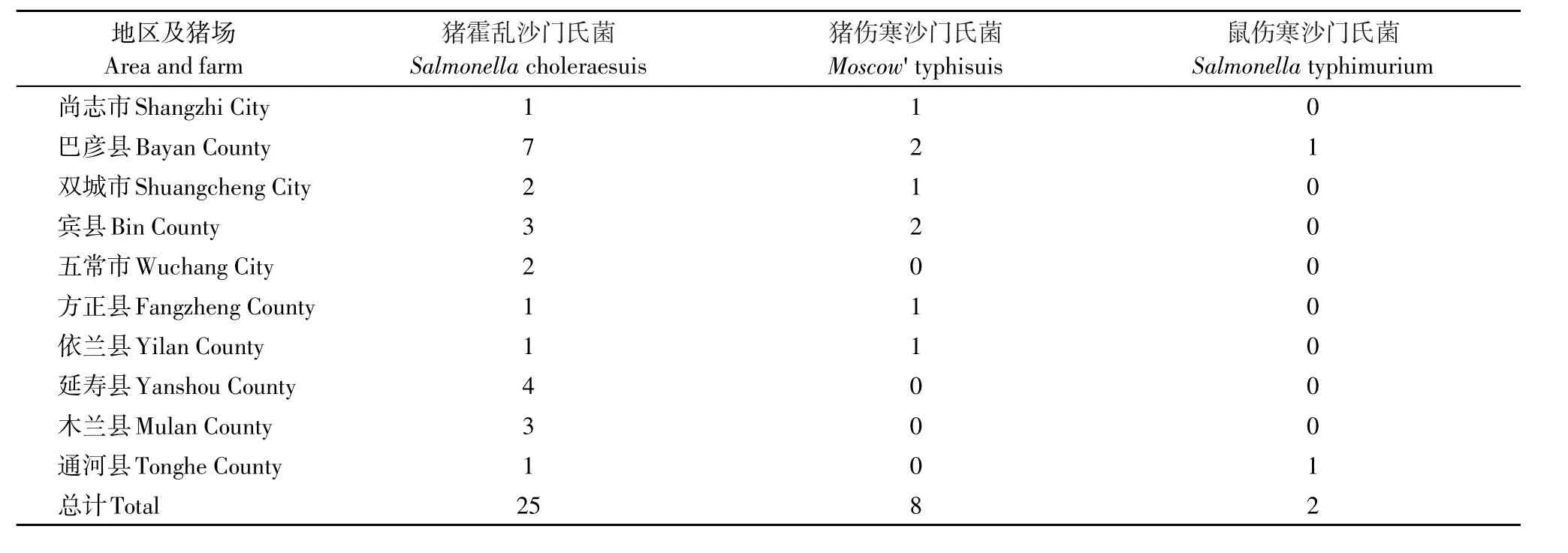
表6 哈尔滨地区不同县市十个猪场沙门氏菌的血清型Table 6 Serotype of Salmonella in ten swine farms of different regions in Harbin Citys

表7 35株猪霍乱沙门氏菌对抗菌药物的耐药谱Table 7 Drug resistant tests of 35 Salmonella spp to 10 antibiotics (%)
3 讨论
沙门氏菌是条件致病菌,常存于病猪各脏器及粪便中,对外界环境的抵抗力较强。当猪受其他病原感染或猪场饲养管理状况不佳时,易产生并发症状[5]。Julie等对美国加州商品猪进行直肠沙门氏菌分离,检出率为9.0%(21/228)[7];张玮对安徽省540份临床健康猪直肠样本调查,发现沙门氏菌检出率为4.07%(22/540)[8]。目前尚未见相关报道指出沙门氏菌的检出率在合格范围,本试验使用微生物学镜检、生化试验并辅助PCR方法进行鉴定,确保分离准确性。
本试验沙门氏菌总分离率为5.83%(35/600),检出率低于Julie研究结果[7]。与美国相比,我国使用抗菌促生长剂比例偏大,与预混料中普遍使用抗菌促生长剂[8]有关。但由于沙门氏菌在粪便中存在量少、菌株生长缓慢以及杂菌的污染严重等因素均可降低该菌分离率,沙门氏菌实际的感染率可能高于此结果,这也是沙门氏菌对猪群危害被低估的重要原因[9]。张玮对安徽省6个地区猪场沙门氏菌的检测结果显示,检出率的高低存在区域性[8]。本研究分离结果可见,沙门氏菌在哈尔滨地区十个市县的猪群中广泛存在,不同市县的分离率除巴彦县具有极显著差异外,其他市县差异不显著。这可能与不同地区猪场饲料中抗生素的添加及添加量有关。若将饲料中的抗生素消除或减少,猪体沙门氏菌的带菌率是否会提高尚需进一步调查研究。
任娟研究报道在猪生长过程各阶段均检出沙门氏菌,保育阶段检出率显著高于生长和哺乳阶段,认为生长阶段猪的自身免疫机能健全,细菌难以在体内长期存在,而哺乳阶段仔猪得到母源抗体的保护,细菌也难以造成隐性感染,但保育阶段的猪缺乏母源抗体保护,自身免疫机能尚不健全,较易受到沙门氏菌感染[11]。本研究发现,沙门氏菌在3个阶段中均检出,其分离率与猪日龄有关,与任娟研究结果[11]一致,以保育阶段猪分离率最高,感染程度最重。哺乳和生长阶段的猪沙门氏菌分离率较低(P≤0.01)。分析认为,这与动物易感性有关,由于大龄动物对沙门氏菌不易感,而保育期之前猪群相互接触机会较少,推测仔猪在保育期大量合群时,发生相互感染。因此,对养殖过程每一环节严加管理,才能消除生猪感染沙门氏菌的机会[12]。
不合理运用抗生素,导致耐药性普遍存在,使临床上对沙门氏菌的临床防治困难[13]。崔忠光利用13种抗菌药物对沙门氏菌药敏试验发现,沙门氏菌对青霉素耐药率最高达100%,对氟苯尼考耐药率最低为12.5%,对头孢噻吩的耐药率为25%[14]。李淑梅通过对豫北地区规模化猪场病原菌的分离及其耐药性研究发现,沙门氏菌对大观霉素、克林霉素、头孢噻吩敏感,对红霉素、庆大、链霉素、痢菌净、阿莫西林耐药率均较高[15]。从表6可以看出,沙门氏菌对氨苄西林100%,对头孢他啶80%耐药,对头孢西丁、哌拉西林、头孢噻肟、头孢吡肟、氨曲南存在不同程度的耐药,对临床上较少应用的药物厄他培南、美罗培南、亚胺培南敏感,结果不一致。这可能与不同地区不同养殖场的用药习惯及用药史有关,沙门氏菌是人兽共患病,如果在临床上经常使用同一种类的抗生素对其进行治疗,导致沙门氏菌的耐药性在人兽之间进行传递,对公共卫生安全造成潜在威胁,临床用药应根据药敏试验结果选择治疗用抗菌药物。有研究认为沙门氏菌主要产生β-内酰胺酶,水解β-内酰胺抗生素的β-内酰胺环,是使β-内酰胺类抗生素失去抗菌活性的主要原因[16]。抗菌药物的耐药导致抗生素虽可暂时控制疫情发展或减轻畜禽病情,但停药后复发,有效药物渐成低效或无效药物[17]。
4 结论
本研究从哈尔滨地区不同市县均分离并鉴定出猪源沙门氏菌,对沙门氏菌在哈尔滨地区十个市县猪群中的流行病学分布进行研究,发现在哈尔滨地区十个市县猪群中病原携带与感染情况非常严重,在保育阶段中检出率最高。β-内酰胺环类抗生素如氨苄西林、头孢他啶等是猪沙门氏菌病防治中的常用药物,但由于长期广泛使用,耐药率很高,疗效严重下降,但对于临床应用较少碳青霉烯类抗生素均敏感,临床上应根据药敏试验合理用药,取得良好效果。采用交叉用药、联合用药、轮换用药,不但使疗效增加,充分发挥抗生素之间协同作用,可避免沙门氏菌与某一种药物长期接触,使产生耐药性几率降低[18-19]。
[1]王继春,金星方,陈建明,等.常熟地区猪高热病细菌性病原分离与鉴定[J].江苏农业科学,2007(5):154-156.
[2]焦新安.屠宰生猪沙门氏菌分离株的血清型和药物感受性分析[J].中国人兽共患病学报,2008(1):5-9.
[3]苏战强.伊犁地区雏鸡沙门氏菌的分离鉴定及敏感药物测定和防治应用[D].乌鲁木齐:新疆农业大学,2006:15-32.
[4]曹澍泽,郭玉璞,董国雄,等.兽医微生物学及免疫学技术[M].北京:中国农业大学出版社,1992:32-38.
[5]Hold G L,Pryde S E,Russell V J,et al.Assessment of microbial diversity in human colonic samples by 16S rDNA sequence analysis[J].FEMS Microbiology Ecology,2002,39(1):33-39.
[6]金明华.宝山区猪沙门氏菌流行病学调查[D].上海:上海交通大学,2010:44-50.
[7]Wayne P A.M100-S18 Performance standards for antimicrobial susceptibilitytesting[J].ClinicalandLaboratoryStandards Institute 18th Informational Supplement USA,2008,23:131-132.
[8]Julie A,Peter R D,Monica A N,et al.The effect of fecal sample weight on detection of Salmonella enterica in swine feces[J].J Vet Diagn Invest,2000(12):412-418.
[9]张玮.安徽省部分猪场生猪沙门氏菌带菌情况与耐药性研究[D].合肥:安徽农业大学,2010:56-58.
[10]顾君华.抗菌素在养殖环节中的使用[J].饲料工业,2006,27(10): 61-64.
[11]刘俊伟,张海棠,张志鹏,等.规模化猪场猪霍乱沙门氏菌的分离鉴定与药敏试验[J].河南农业科学,2011,40(4):15-16.
[12]任娟.猪粪中沙门氏菌的分离鉴定及体外抑菌方法的研究[D].乌鲁木齐:新疆农业大学,2008:65-70.
[13]吕吉云,曲芬.多重耐药微生物及防治对策[M].北京:人民军医出版社,2011:56-59.
[14]Zahid H M,Mahal Z,Chowdhury M R.Prevalence of multiple antibiotic resistant bacteria and chromosomal determinants in surface water of Bangladesh[J].African Journal of Biotechnology, 2009,8(2):38-42.
[15]崔忠光.临床3种常见病原菌的耐药性分析[J].养猪,2013(2): 25-27.
[16]李淑梅,杨帆,刘兴友.豫北地区规模化猪场病原菌的分离及其耐药性研究[J].畜牧与兽医,2008(6):25-27.
[17]李睿,刘芳萍,徐倩倩,等.沙门氏菌耐药抑制剂止泻作用与急性毒性研究[J].东北农业大学学报,2008,39(8):93-95.
[18]刘芳萍,李昌文,张秀英,等.鸡源性沙门氏菌氟喹诺酮类耐药株与拓扑异构酶Ⅳ关系研究[J].东北农业大学学报,2011,42(3): 94-98.
[19]刘立新,刘芳萍,李睿,等.鸡白痢沙门氏菌耐药性中药抑制剂的临床治疗效果[J].东北农业大学学报,2009,40(1):89-91.
Identification and resistance ofSalmonellaisolated from pigs
JIA Chunsheng1,2,MAO Zeming3,WANG Xiaonan2,WANG Junfeng2,WANG Long2,CHEN Shuang2, GE Lanyun2,XU Shiwen1(1.School of Veterinary Medicine,Northeast Agricultural University, Harbin 150030,China;2.Heilongjiang Agricultural Engineering Profession College,Harbin 150088,China;3.Harbin Xinguangfeng Husbandry Limited Company,Harbin 150030,China)
Serological identification ofSalmonellain the large-scale pig farms of Haerbin,and analyzed the differentSalmonellaantimicrobial susceptibility testresults and drug resistance.Methods Up to 35Salmonellastrains were isolated from 600 feces in the rectal of pigs by morphological observation and biochemical system.The sensitivity tests of 35 strains to 10 Beta lactam antibacterials were performedby Krby-Bauer method.These microorganisms were further confirmed by corresponding specific bio-chemistry assay and polymerase chain reaction(PCR).The reasults showed that the overall detection rate ofSalmonellawas 5.83%and the total rate of separation was from 3.3%to 18.3% in the different citys of Harbin.The resistant rate of 35 strains to ampicillin,ceftazidime,cefoxitin, piperacillin,cefotaxime,cefepime and aztreonam was 100%,80%,17%,71%,66%,6 3%and 29% respectively.However,they were still sensitive to ertapenem,meropenem and imipenem.The resultsshowed thatSalmonellainfections exist in pig farms in Harbin and the antimicrobial resistance of Salmonella is very serious.
pig;Salmonella;isolation and identification;resistance
S858.283
A
1005-9369(2014)08-0049-06
2014-03-03
国家自然科学基金项目(30170711)
加春生(1981-),男,讲师,博士,研究方向为环境毒理。E-mail:jcs552@163.com
*通讯作者:徐世文,教授,博士生导师,研究方向为环境毒理,E-mail:1009598967@qq.com
时间2014-7-18 14:57:24[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140718.1457.002.html
加春生,毛泽明,王晓楠,等.猪沙门氏菌的分离鉴定及其耐药性分析[J].东北农业大学学报,2014,45(8):49-54.
Jia Chunsheng,Mao Zeming,Wang Xiaonan,et al.Identification and resistance ofSalmonellaisolated from pigs[J].Journal of Northeast Agricultural University,2014,45(8):49-54.(in Chinese with English abstract)
