真姬菇在高温胁迫下的差异表达蛋白分析
2014-01-14刘琳贾培培卢伟东郭奇林郭立忠
刘琳 贾培培 卢伟东 郭奇林 郭立忠
(1.青岛农业大学生命科学学院 山东省应用真菌重点实验室,青岛 266109;2.西北农林大学生命科学学院,杨凌 712100)
真姬菇(Hypsizigus marmoreus),别名玉蕈,味道比平菇鲜,肉质比滑菇厚,质地脆嫩、口感极佳,因具有独特的蟹香味,又称蟹味菇。据报道,真姬菇富含蛋白质和人体必需的8 种氨基酸,在日本,人们把其与珍贵的松茸相提并论,享有“闻则松茸,食则玉蕈”的美誉,已成为仅次于金针菇的重要食用菌品种[1]。真姬菇含有多种生物活性物质,具有抗癌、防癌、降血压、提高免疫力、延长寿命等独特功效。从真姬菇子实体中提取的核糖体抑制蛋白Hypsin、胶原质蛋白HM23 及多糖均具有显著的抗肿瘤效果[2-4]。Ikemizu 等[5]从真姬菇菌丝体中提取分离到血管紧张素转换酶抑制剂(ACEI),ACEI 能够有效降低血压,减缓高血压和糖尿病患者肾功能的衰退,且副作用小,世界卫生组织将其推荐为抗高血压的一线药物。因此,真姬菇作为一种食药两用真菌具有巨大的开发潜力和良好的市场前景。
真姬菇属于中偏低温型食用菌,温度是影响其生长及品质的重要因素[6]。菌丝生长最适温度20-25℃,30℃以上生长缓慢,超过 35℃时菌丝不再生长,45℃以上无法存活。当温度较高时,菌盖变薄且展开加快,菇体色泽变白,鲜菇品质明显下降。目前,真姬菇的栽培已经规模化,但由于高温对其生长的限制,增加了周年栽培成本,国内真姬菇只在大型超市中出售,且价格较高[7]。研究真姬菇温度胁迫相关机理是解决高温限制,降低生产成本、提高产量的有效方法,而真姬菇在高温胁迫下的抗逆机理研究尚未见报道。本研究应用双向电泳和质谱蛋白质组技术,通过比较最适温度(25℃)和高温胁迫条件下(42℃)真姬菇菌丝体的蛋白表达差异,筛选与高温胁迫紧密相关的蛋白,并探讨其功能,旨在为实现通过基因操作选育耐热性强的优良真姬菇菌种,降低周年栽培生产成本奠定基础。
1 材料与方法
1.1 材料
白真姬菇G12 为青岛农业大学山东省应用真菌重点实验室保藏。将G12 接种到PDA 平板上,25℃培养3 周后分为两组:对照组(继续在25℃培养2 h)、高温处理组(42℃热激2 h)。
1.2 方法
1.2.1 菌丝体全蛋白的提取 刮取对照组和高温处理组的真姬菇菌丝体各1.0 g,液氮研磨后,分别用Tris-饱和酚法[8]、TCA/丙酮法[9]、尿素裂解法[10]提取菌丝体全蛋白。采用Bradford 法[11]测定提取液中全蛋白总量,SDS-PAGE[12]检测蛋白,分离胶浓度为12%,浓缩胶浓度为5%,Marker 上样体积4 μL,蛋白上样体积17 μL。
1.2.2 双向电泳 选用24 cm 的IPG 胶条(pH4-7),蛋白上样量1.2 mg,胶条水化16 h 后,进行等电聚焦。聚焦参数:温度20℃,最大电流50 μA/胶条。聚焦程序:100 V×1 h,500 V×1 h,1 000 V×1 h,8 000 V×4 h,8 000 V×8 h,500 V×∞。第一向电泳等电聚焦结束后,迅速取出IPG 胶条,吸干胶条上的矿物油和多余的样品,将胶条先后置于平衡缓冲液Ⅰ[6 mol/L 尿素、75 mmol/L Tris-HCl(pH8.8)、30%甘油、2% SDS、0.002% 溴酚蓝、1% DTT]和平衡缓冲液Ⅱ[6 mol/L 尿素、75 mmol/L Tris-HCl(pH8.8)、30%甘油、2% SDS、0.002%溴酚蓝、2.5%碘乙酰胺]中各平衡15 min,取出胶条,吸去多余的平衡液。第二向SDS-PAGE 凝胶电泳采用Ettan-DALT-Six 系统,水浴循环仪设定温度为20℃,聚丙烯酰胺凝分离胶浓度为12.5%,电泳程序设置为2 W×45 min,17 W/gel 电泳至溴酚蓝前沿距离玻璃板下缘0.5 cm 时停止电泳。凝胶染色采用银染。
1.2.3 数据分析 凝胶银染后,用UMAX 光密度扫描仪获得分辨率为300dpi 的电子图像。采用PDQuest8.0 版软件进行图象分析,为验证自动检测到的蛋白点,需要对所有蛋白点进行人工检查和编辑,主要操作包括凝胶蛋白点检测、图像背景扣除、蛋白点灰度值标准化。比较处理组和对照组的双向电泳图谱,确定差异蛋白点(表达量差异倍数>3.0),进行蛋白质的胶内酶解及肽段提取[13]。样品送北京华大蛋白组研发中心进行MALDI-TOF-MS 鉴定。根据质谱结果,用MASCOT 软件搜索MSDB、NCBI 等数据库,初步鉴定相关蛋白并分析其生理功能。
2 结果
2.1 全蛋白提取方法的评价
为了制备适合蛋白质组分析的蛋白样品,获得较好的双向电泳效果,分别采用TCA/丙酮法、Tris-饱和酚法和尿素裂解法提取真姬菇菌丝体的全蛋白。Bradford 法检测蛋白量结果表明,TCA/丙酮法获得的蛋白总量最高,达到1.6 mg/g 菌丝体;Tris-饱和酚法稍低,蛋白量为1.36 mg/g 菌丝体;尿素裂解法仅得到蛋白0.89 mg/g 菌丝体。全蛋白提取液的SDSPAGE 结果(图1)表明,3 种方法提取的菌丝体蛋白分子量都在19-118 kD 之间;全蛋白浓度大小顺序为Tris-饱和酚法>尿素裂解法>TCA/丙酮法。将上述3 种方法制备的菌丝体全蛋白提取液应用于双向电泳检测,凝胶图谱分析(图2)表明,Tris-饱和酚法获得的全蛋白提取液在凝胶上可检测到900多个蛋白点且杂质少,而其它两种方法的全蛋白提取液,图谱上蛋白点较少。因此,选择Tris-饱和酚法提取真姬菇对照组和高温处理组的菌丝体全蛋白。
2.2 高温胁迫下的差异表达蛋白
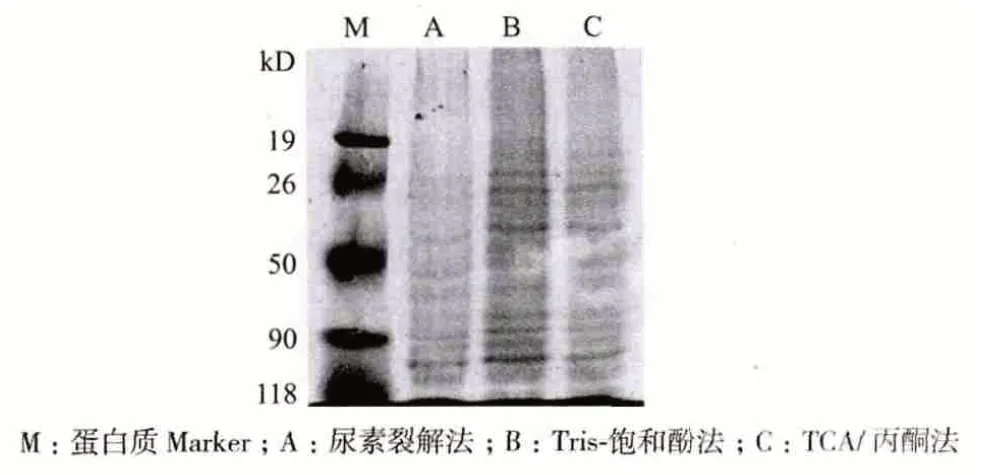
图1 SDS-PAGE 检测3 种方法提取的全蛋白

图2 三种方法提取的全蛋白2-DE 图谱
采用Tris-饱和酚法提取真姬菇菌丝体对照组和高温处理组的全蛋白,然后进行双向电泳检测,用PDQuest8.0 版软件分析电泳凝胶图谱。对照组凝胶上约有890 个蛋白点,高温处理组凝胶上约有930个蛋白点(图3)。软件分析对照组和高温处理组的凝胶图谱,筛选出12 个表达丰度差异倍数大于3 的蛋白点,其中6 个蛋白点的表达量上调,6 个蛋白点的表达量下调。凝胶上,这12 个蛋白点分布在分子量80 kD 以下,pH4-6 的区域。
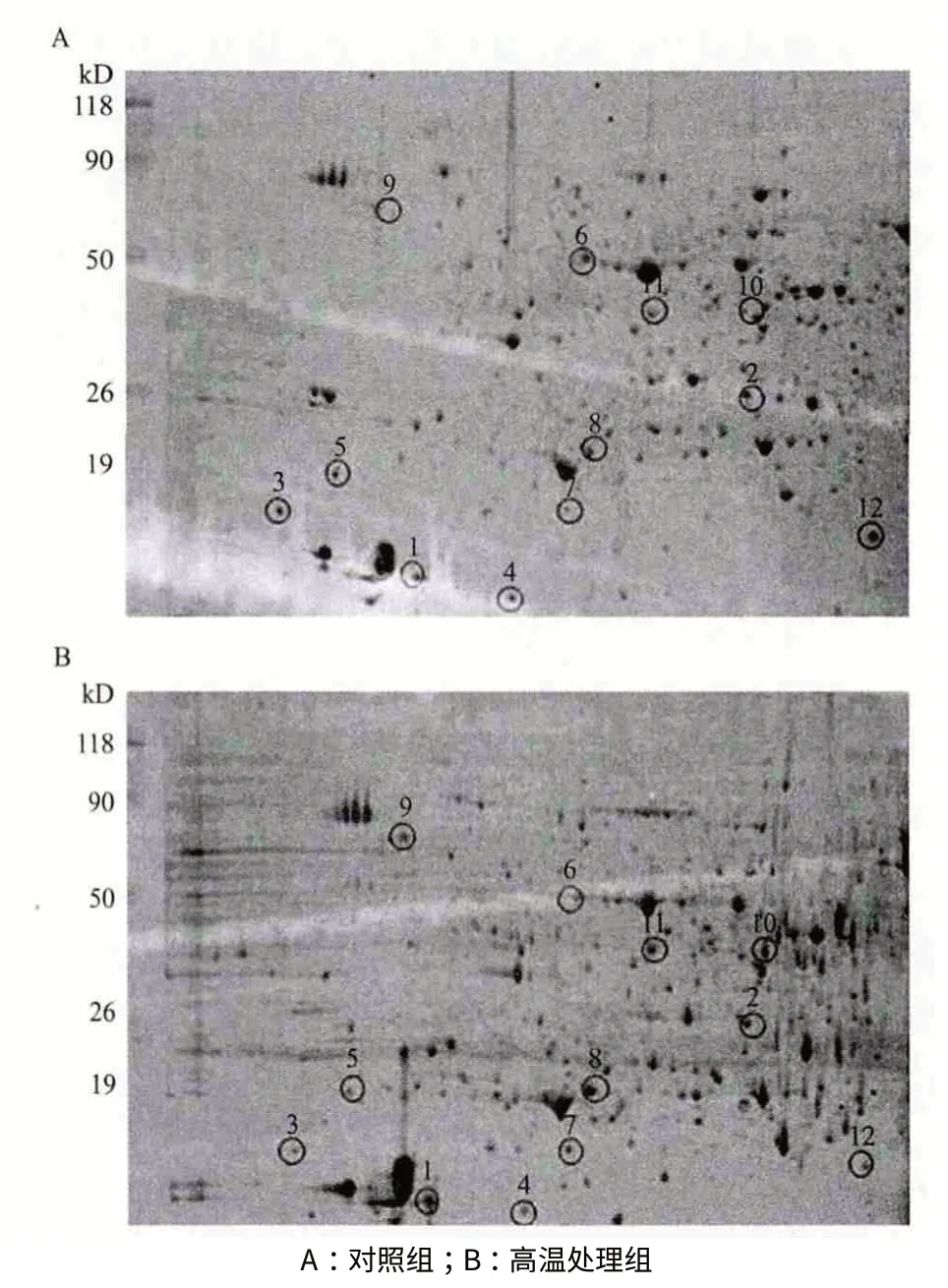
图3 对照组和高温处理组菌丝体全蛋白2-DE 图谱比较
2.3 差异表达蛋白的质谱鉴定
将12 个具有显著表达差异的蛋白点进行质谱鉴定,根据获得的信息用MASCOT 软件搜索MSDB、NCBI 等数据库,初步鉴定7 个蛋白。另外5 个蛋白由于分辨率或灵敏度不够(酶解不充分或样品含有杂质),或者因匹配率、覆盖率太低未能被鉴定。7个被鉴定的蛋白质中,6 个蛋白表达量上调(点1、7、8、9、10 和11),1 个蛋白表达量下调(点2)。蛋白鉴定结果如下:DEHA2G15532p(点1),Spa2 同源结构域(点2),肽酶M76 家族(点7),HSP70(点8),SNF2家族的DNA 修复蛋白(点9),细胞色素p450(点10),SAM 域家族和锌指蛋白的混合物(点11)。各蛋白的详细信息见表1。
3 讨论
3.1 菌丝体全蛋白的提取
TCA/丙酮法能够将真姬菇菌丝体中的所有干物质沉淀,蛋白损失少,因此获得的全蛋白总量最多。但其沉淀的蛋白因与膜或其它组织结合而较难溶解,需要大量裂解液才能溶解完全,所以蛋白质提取液浓度较低。Tris-饱和酚法由于只收集酚相、苯酚与水相的界面,蛋白质总量较TCA/丙酮法少,但沉淀蛋白易溶于裂解液,因此,获得的蛋白提取液浓度最高。TCA/丙酮法制备的样品由于杂质多且盐浓度高,电压很难顺利到达聚焦电压,聚焦不充分造成蛋白点较少;尿素裂解法获得的全蛋白在双向电泳凝胶图谱上蛋白点较少,可能与样品蛋白总量少且浓度较低有关。Tris-饱和酚法制备的全蛋白提取液,蛋白浓度高,蛋白总量能够满足双向电泳检测需求,获得的双向电泳图谱,蛋白得率高,分辨率高,重复性好,因此,以Tris-饱和酚法作为真姬菇菌丝体全蛋白的提取方法。
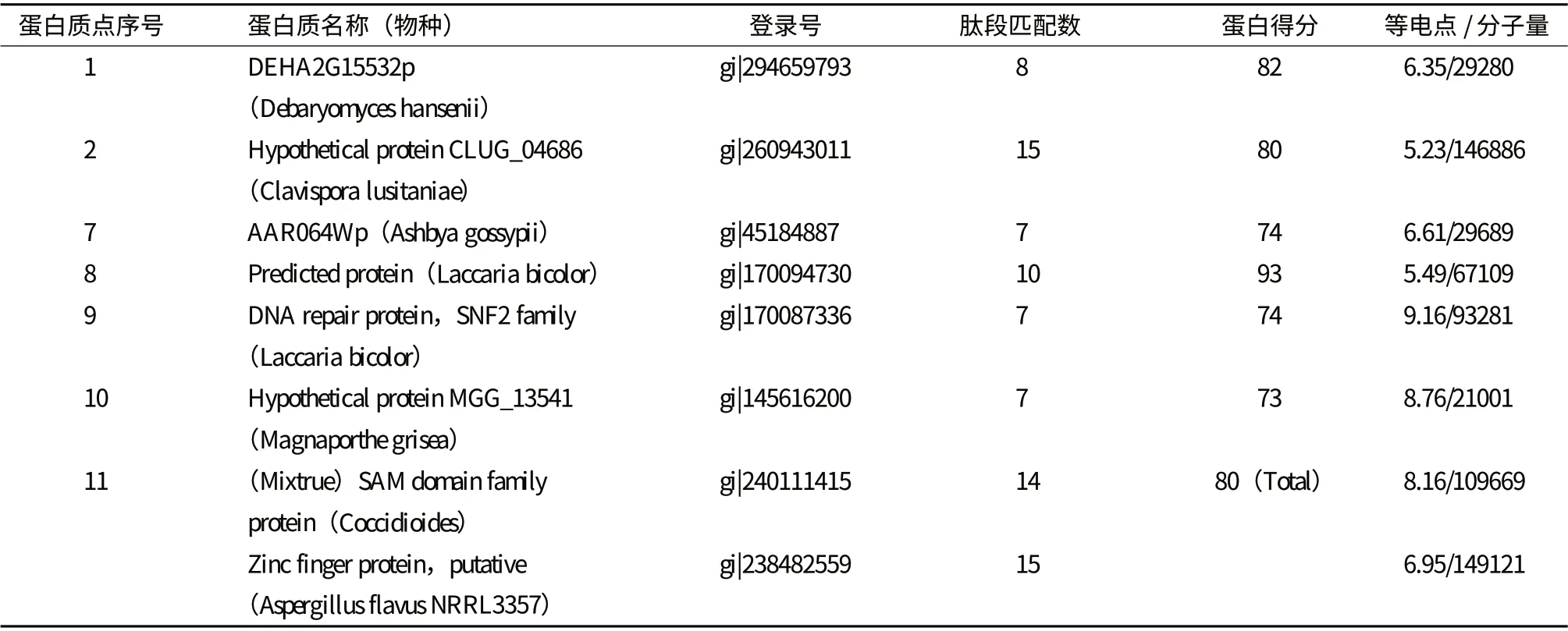
表1 差异蛋白点的质谱鉴定结果
3.2 差异表达蛋白的功能分析
在已被鉴定的7 个蛋白中,DEHA2G15532p(点1)目前仅在汉逊德巴利酵母的两个菌株中发现,数据库中没有其结构和功能的相关信息,其它6 个蛋白质按其参与的生理代谢过程归纳为5 类。
3.2.1 调节功能和信号转导有关的蛋白质:Spa2 同源结构域(SHD)、SAM 域家族蛋白和锌指蛋白 Spa2 同源结构域(SHD)与多种蛋白相互作用,参加细胞信号的转导过程[14,15]。Ryan 等[16]的研究表明,SHD 是GIT(G-protein-coupled receptors kinase interacting protein)家族蛋白的功能域,能够与p21 基因激活的磷酸化蛋白激酶(PAK)相互作用,PAK 通过调节Rac1/Cdc42 诱导激活丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPKs),MAPKs信号转导通路将细胞外刺激信号转导至细胞及其核内,并引起细胞生物学反应,调节细胞的极化和分裂。在酿酒酵母细胞中,Spa2蛋白定位于极性生长点,为细胞极性生长所必需,另外,Spa2 蛋白在细胞交配过程中的形态学变化中起重要作用,缺失Spa2 基因,细胞交配效率降低了90%[17]。高温胁迫下,真姬菇细胞通过Spa2 同源结构域参与的信号转导过程,调节细胞的极性生长和分裂。SHD 的表达量下调导致细胞分裂次数减少或分裂周期延长,真姬菇菌丝细胞的生长繁殖受到抑制。这在一定程度上降低了细胞的能量消耗,有利于提高真姬菇在逆境中的生存能力。
Schultz 等[18]的研究表明,SAM 是重要的蛋白结合域,参与细胞内的信号转导过程。pH 结构域是SAM 的重要功能区域,约由100-120 个氨基酸残基组成,与磷酸肌醇类化合物具有很强的亲和力[19]。SAM 域家族蛋白通过与磷酸肌醇类化合物的相互作用,对胞外刺激做出反应,转移至细胞膜上[20]。另有文献报道pH结构域能够与G蛋白的β、γ亚基结合,并参与调节宿主蛋白的活性[21]。高温处理后,SAM域家族蛋白的表达量显著上调,说明它可能参与真姬菇抗高温反应的信号转导过程。Orrecilla 等[22]监测了鱼腥藻(Anabaena sp. PCC7120)细胞内的游离Ca2+浓度,发现热激20 min 细胞内的游离Ca2+浓度达到最大值。试验中我们发现热激后真姬菇菌丝体细胞内的Ca2+浓度明显增加。高温胁迫下,真姬菇可能通过磷脂酰肌醇信号通路,以Ca2+作为第三信使,引发一系列生理生化反应,缓解逆境伤害。
锌指蛋白(点11)是一种具有手指状结构域的转录因子,通过和核酸结合或与蛋白质发生相互作用,在转录水平上调控基因的表达。高温胁迫下,锌指蛋白通过表达量上调,调控高温相关基因的表达,参与真姬菇的高温胁迫过程。
3.2.2 蛋白质降解有关的蛋白:肽酶M76 家族 肽酶M76 家族蛋白能够将蛋白质直接水解为氨基酸[23]。有研究表明,高等植物在冷害、干旱、光辐射和高温等环境胁迫下会诱导蛋白发生错误折叠,如果不受抑制将导致细胞死亡[24]。高温下,Bt 棉棉铃中的肽酶活性显著增加,促进了蛋白质的分解,导致细胞内可溶性蛋白含量大幅度下降[25]。高温胁迫下,真姬菇菌丝体细胞可能通过提高肽酶的表达量,促进错误折叠蛋白的降解,增强生存能力。
3.2.3 热激蛋白:HSP70 HSP70 是高温刺激诱导生成或增加合成的蛋白质,在机体中呈现重要的应对高温的细胞策略[26]。高温会导致细胞蛋白质的变性和聚集,如果不受抑制将导致细胞死亡。热激蛋白与其他蛋白质结合,帮助蛋白质折叠,防止变性蛋白聚合,调节细胞内环境以适应外界高温压力[27]。Waters 等[28]研究指出植物以复杂的方式对热胁迫产生应答,而HSP 在复杂的细胞网络中起主导作用。陆兆明等[29]的研究表明,35℃高温处理后,双孢蘑菇菌丝体中HSP70 表达量显著上调(为对照组的5 倍)。这与本试验中,高温处理后HSP70 表达量上调的结果一致。可见,HSP70 是食用菌耐热机制中的重要蛋白之一,高温下热激蛋白的表达上调提高了真姬菇的耐热性和存活率。
3.2.4 解毒有关的蛋白:细胞色素p450 细胞色素p450 是一类能与CO 结合形成复合物,在450 nm附近有最大吸收峰的含血红素和硫羟基的蛋白。真菌细胞中,细胞色素p450 主要是催化一些具有重要生理功能的内源性物质,如激素、脂肪酸、萜类化合物等的生物合成代谢,以及参与许多外源性物质或一些有毒物质的生物氧化[30]。棉花中,细胞色素p450 的超量表达能显著增加棉花对黄萎病的抗性[31]。高温处理后,真姬菇菌丝体中细胞色素p450 的表达量上调,说明其可通过生物合成或代谢相关途径参与热应激反应,降低高温对细胞的毒性。
3.2.5 DNA 修复有关的蛋白质:SNF2家族的DNA修复蛋白 DNA 修复蛋白质能够通过对自身损伤DNA 的有效修复,维持DNA 的完整性和稳定性。在不良环境条件下,生物体提高DNA 修复蛋白质的表达量是自我保护,防止突变的重要手段。高温处理后真姬菇菌丝体DNA 修复蛋白的表达量上调是真姬菇在高温条件下启动的有效抗逆措施。
4 结论
本研究通过对最适温度和高温胁迫条件下真姬菇菌丝体蛋白质的差异表达分析,筛选鉴定出7 个与高温胁迫相关的蛋白,分别为Spa2、 DEHA2G15532p、肽酶M76 家族、HSP70、SNF2家族的DNA 修复蛋白、细胞色素p450 及AM 域家族和锌指蛋白的混合物。根据同源蛋白的功能分析探讨了真姬菇的抗高温机制。高温胁迫下,真姬菇可通过多种机制抵抗高温刺激。
[1] 郑宇, 林兴生, 陈福如.真姬菇生物学特性研究初报[J].食用菌, 2001, 23(3):12-13.
[2] Lam SK, Ng TB. Hypsin a novel thermostable ribosome-inactivating protein with antifungal and antiproliferative activities from fruiting bodies of the edible mushroom Hypsizigus marmoreus[J]. Biochemical and Biophysical Research Communications, 2001, 285:1071-1075.
[3] Kazutaka T, Yutaka A, Shoji O, et al. Isolation of a novel collagenbinding protein from the mushroom, Hypsizigus marmoreus, which inhibits the lewis lung carcinoma cell adhesion to type IV collagen[J]. The Journal of Biological Chemistry, 1995, 270(4):1481-1484.
[4] Tetsuro I. Beneficial effects of edible and medicinal mushrooms on health care[J]. International Journal of Medicinal Mushrooms, 2001(3):291-298.
[5] Ikemizu S, Kishimoto M, Konishi H. Angiotensin-converting enzyme inhibitors of bunashimeji and enokitake[P]. JP:08099895, 1996, gen Im.
[6] 李翠翠.真姬菇热激蛋白HmHSP70 基因克隆及其原核表达分[D].青岛:青岛农业大学, 2009.
[7] 孙国庆, 郝涤非.苏北地区发展真姬菇生产可行性研究[J].食用菌, 2011(1):5-7.
[8] Yao Y, Yang YW, Liu JY. An efficient protein preparation for proteomic analysis of developing cotton fibers by 2-DE[J]. Electrophoresis, 2006, 27:4559-4569.
[9] Wang W, Scali M, Vignani R, et al. Protein extraction for twodimensional electrophoresis from olive leaf, a plant tissue containing high levels of interfering compounds[J]. Electrophoresis, 2003, 24:2369-2375.
[10] Grinyer J, McKay A, Nevalainen Herbert BR, Saraste M. Fungal proteomics:initial mapping of biological control strain Trichoderma harzianum[J]. Current Genet, 2004, 45:163-169.
[11] Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Anal Biochemistry, 1976, 72:248-254.
[12] 郭尧君.蛋白质电泳实验技术[M]. 第2 版. 北京:科学出版社, 2005.
[13] Kumiko SK, Tadatoshi K, Noriko F, et al. Screening system for D-Asp-containing proteins using D-aspartyl endopeptidase and twodimensional gel electrophoresis[J]. Amino Acids, 2009, 36:125-129.
[14] Sheu YJ, Santos B, Fortin N, et al. Spa2p interacts with cell polarity proteins and signaling components involved in yeast cell morphogenesis[J]. Molecular Cell Biology, 1998, 18:4053-4069.
[15] Van DF, Peter M. Spa2 functions as a scaffold-like protein to recruit the Mpk1p MAP kinase module to sites of polarized growth[J]. Current Biology, 2002, 12:1698-1703.
[16] Ryan JH, Bradford CB. The multifunctional GIT family of proteins[J]. Journal of Cell Science, 2006, 119:1469-1475.
[17] Arkowiz RA, Lowe N. A small conserved domain in the yeast spa2p is necessary and sufficient for its polarized localization[J]. Journal of Cell Biology, 1997, 138(1):17-36.
[18] Schultz J, Bork P, Ponting CP, Hofmann K. SAM as a protein interaction domain involved in developmental regulation[J]. Protein Science, 1997, 6(1):249-253.
[19] Baltimore D, Mayer BJ, Ren R, Clark KL. A putative modular domain present in diverse signaling proteins[J]. Cell, 1993, 73(4):629-630.
[20] Gibson T, Musacchio A, Thompson J, et al. The PH domain:a common piece in the structural pathwork of signaling proteins[J]. Trends Biochemical Science, 1993, 18(9):343-348.
[21] Wang DS, Shaw R, Winkelmann JC, Shaw G. Binding of PH domains of β-adrenergic receptor kinase and β-spectrin to WD40/β-transducin repeat containing regions of the β-subunit of trimeric G-proteins[J]. Biochemical and Biophysical Research Communications, 1994, 203(1):29-35.
[22] Torrecilla I, Leganes F, Bonilla I. Use of recombinant aequorin to study calcium transients in response to heat and cold in cyanobacterial[J]. Plant Physiology, 2000, 123(1):161-175.
[23] Page MJ, Enrico DC. Evolution of peptidase diversity[J]. Journal of Biological Chemistry, 2008, 283:30010-30014.
[24] 侯学文, 郭勇.泛肽与植物逆境响应[J].植物生理学通讯, 1998, 6:474-478.
[25] 姜周庚, 张延昭, 冯梦诗, 等.高温胁迫对盛铃期Bt 棉棉铃中杀虫蛋白表达量及氮代谢的影响[J].中国棉花, 2012, 39(4):13-15.
[26] Sorensen JG, Kristensen TN, Loeschcke V. The evolutionary and ecological role of heat shock proteins[J]. Ecology Letters, 2003, 6(11):1025-1037.
[27] Krebs RA, Holbrook SH. Reduced enzyme activity following Hsp70 over expression I Drosophila melanogaster[J]. Biochemical Genetics, 2001, 39(1-2):73-82.
[28] Waters ER, Lee GJ, Vierling E. Evolution, structure and function of the small heat shock proteins in plants[J]. Journal of Experimental Botany, 1996, 47(3):325-338.
[29] 陆兆明, 徐祯, 王珂, 等.双孢蘑菇耐温差异蛋白质组学研究[J].厦门大学学报:自然科学版, 2009, 48(4):590-593.
[30] 王海燕, 图力故尔, 陈强, 黄晨阳.真菌细胞色素P450 研究进展[J].食用菌学报, 2010, 17(2):97-102.
[31] 徐理, 朱龙付, 张献龙.棉花抗黄萎病机制研究进展[J].作物学报, 2012, 38(9):1553-1560.
