烟草角斑病菌拮抗细菌筛选及抗菌活性物质研究
2014-01-14文景芝赵黎明杨晓敏孙剑萍刘振平
文景芝,赵黎明,杨晓敏,孙剑萍,刘振平
(1.东北农业大学农学院,哈尔滨 150030;2.牡丹江烟草科学研究所,黑龙江牡丹江 157011;3.黑龙江省职工电化教育中心,哈尔滨 150001)
烟草角斑病菌拮抗细菌筛选及抗菌活性物质研究
文景芝1,赵黎明1,杨晓敏1,孙剑萍2,刘振平3
(1.东北农业大学农学院,哈尔滨 150030;2.牡丹江烟草科学研究所,黑龙江牡丹江 157011;3.黑龙江省职工电化教育中心,哈尔滨 150001)
研究从黑龙江省健康烟草植株及其根际土壤和海南三亚采集的20种杂草中分别分离到287和98个细菌分离物,筛选出对烟草角斑病菌有拮抗活性的菌株22个,其中来自三亚稗草叶片中的一株细菌PA-2的抑菌效果最好,抑菌效果稳定。经形态学、生理生化及分子生物学鉴定,PA-2为铜绿假单胞杆菌(Pseudomonas aeruginosa)。筛选出最佳实验室发酵配方:氮源1%(牛肉膏∶蛋白胨=5∶3),葡萄糖0.3%,NaCl 0.5%,KNO30.3%;最佳培养条件:发酵温度28℃,培养基pH 7.0~7.5,接种量4%,装液量为250 mL三角瓶中装液50 mL。PA-2优化发酵液的田间防效达69.77%,比农用链霉素防效提高24.47%。采用硫酸铵分级沉淀法分离抑菌活性物质,结果表明,在(NH4)2SO4浓度为30%~90%各浓度梯度下均有抑菌活性物质沉淀,其中60%~70%(不含60%)是抑菌活性物质的最适盐析饱和度。抑菌活性物质具有较强的热稳定性、较好的蛋白酶耐受性、较好的耐碱性、较差的耐酸性,能溶于部分有机溶剂,经乙醇、乙醚、氯仿、乙酸乙酯、正丁醇和丙酮萃取后,该抑菌活性物质抑菌活性下降范围为1.4%~4%。确定该抑菌活性物质为小分子碱性、水溶性脂肽类物质。
烟草角斑病;拮抗细菌;16S rDNA鉴定;发酵条件优化;抑菌活性物质
由Pseudomonas syingae pv.tabaci(Wolf et Foster)引起的烟草角斑病是一种暴发性、毁灭性细菌病害,影响烟草质量和产量。目前国内烟草品种对抗角斑病均无高抗性[1]。农用链霉素是生产上防治烟草角斑病的常用药剂[2],由于连续使用,病原菌已产生抗药性[3]。烟草角斑病防治采取以调控烟田生态环境,利用生物防治,重病田进行药剂防治综合防治策略。研究者利用有益微生物及其代谢产物来防治烟草角斑病。张晓雯等和乔婵等分别筛选出对烟草角斑病菌具有较好防效的链霉菌株H210和荧光假单胞杆菌PF7-5,但研究仅限于抑菌效果和田间防效测定[4-5],缺乏抑菌活性物质研究。关于拮抗细菌产生的活性物质研究较多,烟草角斑病菌拮抗菌产生的抑菌活性物质研究较少。研究发现,拮抗细菌产生的活性物质种类具有多样性。抗生素具有很强拮抗专化性,可抑制同种内不同株系或近缘种细胞生长[6]。另一抑菌活性物质为蛋白类,主要包括细胞壁降解酶类和其他类抗菌蛋白[7]。嗜铁素(Siderophore)类物质是大量根际细菌和植物内生细菌分泌的拮抗代谢物质代表,拮抗细菌通过自身的作用形成一种病原微生物不能利用的Fe3+-嗜铁素复合物[8],在低铁环境下,拮抗菌可通过自身特异功能吸收Fe3+,使病原菌受到抑制,达到防治病害目的[9],这些物质对植物抵抗病菌侵入、潜伏、扩展、蔓延有重要作用。本研究从不同品种的烟草植株、烟草根际土壤和野生杂草中分离出大量细菌菌株,筛选出一株对烟草角斑病菌具有较好拮抗效果的细菌,对其进行形态学、生理学鉴定和16S rDNA鉴定,并进行发酵条件优化,测定发酵液田间防效。通过硫酸铵分级沉淀法分离出抑菌活性物质,为以拮抗活性物质为主要成分微生物杀菌剂的研制和应用提供理论依据与技术支撑。
1 材料与方法
1.1 供试烟草品种、病菌及培养基国内主栽中感烟草角斑病的烟草品种K326和烟草角斑病菌Pseudomonas syringae pv.tabaci均由牡丹江烟草科学研究所提供。其中K326用于田间防效试验。
KMB培养基、NA培养基、NB培养液和PDA培养基分别用于烟草角斑病菌的培养、细菌的分离、发酵和保存。培养基配方参照文献[10]。
1.2 植物体内及烟草根际土壤中细菌的分离
采用常规稀释平板法分离烟草和杂草器官内外和烟草根际土壤中的细菌[11],挑取不同类型菌落,在NA平板上反复划线纯化培养,挑取单个菌落移至PDA斜面上保存。
1.3 烟草角斑病菌拮抗细菌的筛选
参照文献[12]方法。
1.4 烟草角斑病菌拮抗细菌的鉴定
1.4.1 形态学鉴定
利用逐级稀释法,将拮抗细菌用无菌水稀释至10-7,将10-3至10-7菌悬液分别涂于NA平板上,28℃培养2~3 d,出现单菌落后,观察菌落的形状、大小、颜色、边缘、表面、隆起形状、透明度、是否产生色素等。挑取菌体进行革兰氏染色[13]。选择老龄菌配制菌悬液,进行芽孢染色,观察芽孢的形状、大小及着生位置[13-14]。用透射电子显微镜观察拮抗细菌鞭毛的着生位置、数目及菌体形状,并测量菌体大小。
1.4.2 生理生化特性测定
拮抗菌株的生理生化特性测定参照文献[15],菌悬液浓度3×108cfu·mL-1[16]。
1.4.3 16S rDNA鉴定
采用Schroth等方法提取拮抗细菌总DNA[17]。以总DNA为模板,采用细菌通用引物27F和1492R(上海生工合成)进行PCR,扩增片段长度1400bp。PCR反应体系及其测定参照文景芝等方法[12]。将PCR产物测序,并与GenBank数据库序列进行BLAST分析比对,确定拮抗细菌的分类地位。
1.5 拮抗细菌发酵条件的优化
1.5.1 单因子试验
参照文景芝等方法[12]进行单因子试验,确定拮抗菌生长的最适碳源、有机氮源、无机氮源及其最适浓度。
1.5.2 培养基优化正交试验
依据单因素试验结果,选取较优碳源、较优有机氮源、较优无机氮源、NaCl的3种浓度组合进行4因素3水平正交试验,测定各条件下OD625值及其对烟草角斑病菌的抑菌活性(见表1)。
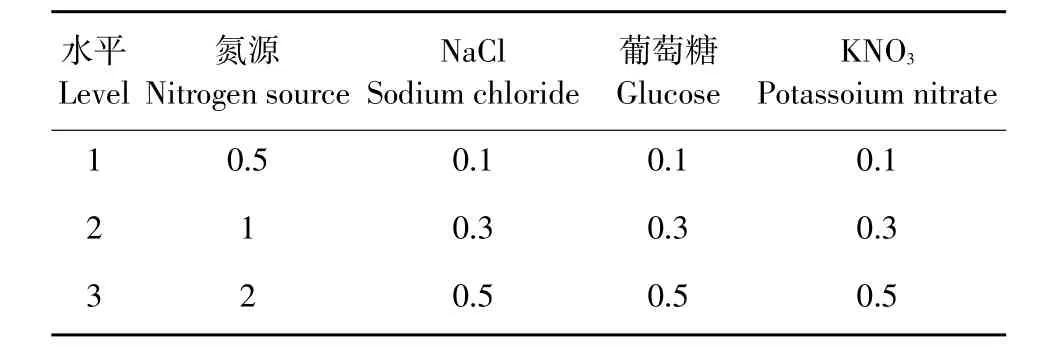
表1 L9(34)正交水平因素Table 1 L9(34)factors and levels of the orthogonal test(%)
1.5.3 发酵条件的优化
采用优化后的NB发酵培养液,参见文献[12]方法进行处理,测定培养后菌液的OD625值及其对烟草角斑病菌的抑菌活性,分别确定最适合拮抗菌生长的温度、pH、接种量及最适合的通气量。
1.6 拮抗细菌对烟草角斑病的田间药效试验
试验于2011年6~7月在牡丹江烟草科学研究所试验场烟田进行。每小区烟株15株,株距0.9 m×0.5 m。共设5个处理:A-拮抗菌发酵液(用普通NB培养液培养,稀释6倍);B-拮抗菌优化发酵液(用优化后的培养液培养,稀释6倍);C-NB培养液空白对照;D-优化后的培养液空白对照;E-20%农用链霉素可湿性粉剂(瑞田生化有限公司)。各处理采用随机区组排列,重复3次。各处理在团棵期采用高压喷雾法进行第1次喷雾,A、B、C、D、E分别喷施各处理液,每处理喷雾2 L,喷雾后保湿。2 d后各处理均喷施病原菌2 L(6倍稀释液,浓度约6.0×108cfu·mL-1)后保湿。喷施病原菌后每隔5 d进行1次病害调查,同时进行下次喷施各处理液(同第1次),共调查3次。每小区调查10株烟株,每株调查中下部叶片10片,以每片叶病斑面积占整个叶片面积的百分比分级,记录总叶片数、各级病叶数,计算病情指数及防治效果。
病害分级标准参照中华人民共和国烟草病害分级标准(YC T39-1996),防效计算参见文献[12]方法。
1.7 拮抗细菌抑菌活性物质的提取及初步鉴定
1.7.1 活性物质的提取
参照刘永峰的硫酸铵分级沉淀法[18]。
1.7.2 活性物质的抑菌活性检测
取5 mL病原菌发酵液混入NA培养基中制成含病原菌的平板。在平板中央打1个7 mm的孔,取0.1 mL上述分级提取的粗提物注入孔内,以拮抗菌发酵液为对照,每处理3次重复,28℃培养2~3 d,测量抑菌圈直径,分析比较不同梯度沉淀物质的抑菌活性差异。
1.7.3 活性物质的生理生化特性测定
参照张成省等方法对活性物质进行处理[19],然后参照前文方法测定抑菌活性。
2 结果与分析
2.1 烟草角斑病菌拮抗细菌的筛选
从黑龙江省烟草植株及其根际土壤和海南三亚的杂草中分别分离到287和98个细菌分离物,只有来自烟草植株及根际土壤中的21株和来自三亚稗草叶片中的1株(命名为PA-2)细菌对烟草角斑病菌具有拮抗作用,抑菌带宽度范围5.3~15.3 mm,其中以PA-2的抑菌效果最好,抑菌效果稳定(见表2)。
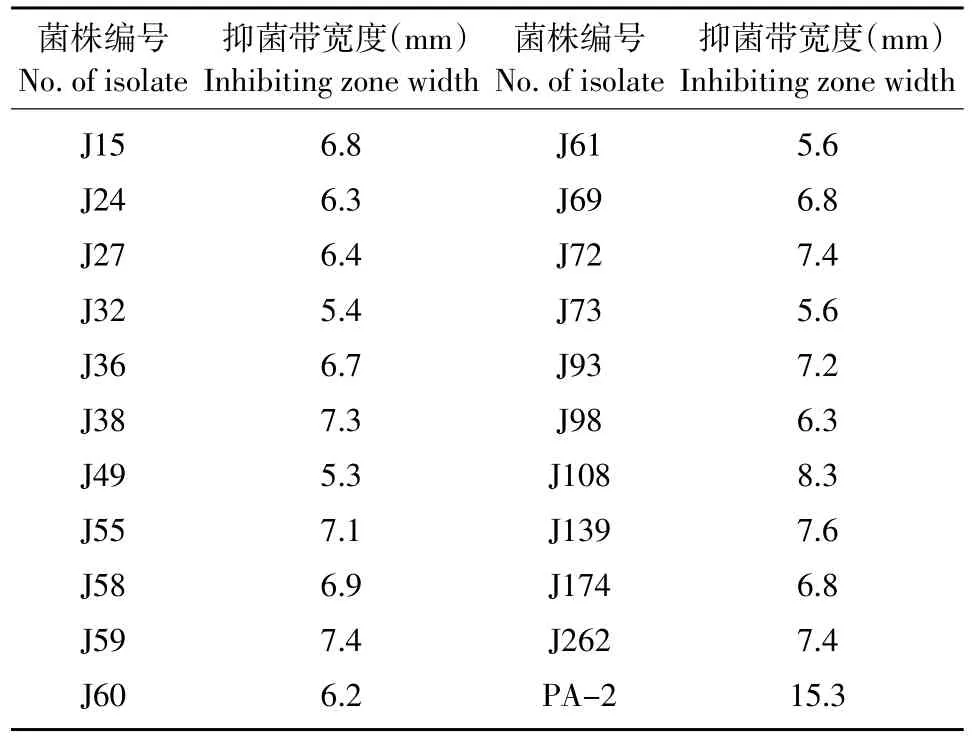
表2 烟草角斑病菌拮抗细菌的筛选Table 2 Screening of the antagonistic bacteria to Pseudomonas syringae pv.tabaci
2.2 烟草角斑病菌拮抗细菌PA-2的鉴定
2.2.1 形态学及生理生化鉴定
PA-2在NA培养基上生长良好,单菌落形态为圆形或近圆形,扁平状且周围不规则,中等大小,表面光滑,半透明,产生蓝绿色色素(见图1A),菌落表面呈黏稠状。革兰氏染色阴性(见图1B)。菌体杆状,不产生芽孢。透射电子显微镜下菌体呈杆状,一端有单鞭毛,菌体较小且长短不一,约为(0.5~1)μm×(1~1.5)μm,分散、成对或短链状排列(见图2),具有运动性及好氧特性。

图1 菌落特征及革兰氏染色Fig.1 Morphology of the colony and gram stain of PA-2

图2 拮抗细菌PA-2的电镜观察(30000×)Fig.2 PA-2 under electron microscope
2.2.2 生理生化特性
荧光反应、蔗糖氧化发酵、吲哚产生、从蔗糖产生还原物质、甲基红试验、乙酰甲基甲醇试验、淀粉水解试验均为阴性。葡萄糖氧化发酵试验、接触酶反应、明胶液化试验、脂酶(Tween 80)试验、硝酸盐还原试验、脓青素的产生试验、柠檬酸盐利用试验均为阳性。NaCl含量2%、5%、7%、10%时生长良好,且41℃条件下生长状态较好。
根据PA-2的形态特征及生理生化特性,参照《常见细菌系统鉴定手册》[20]及《伯杰氏细菌鉴定手册》[21],初步鉴定菌株PA-2为铜绿假单孢杆菌(Pseudomonas aeruginosa)。
2.2.3 16S rDNA鉴定
从PA-2基因组DNA中成功扩增出与预期大小一致的特异性片段,大小为1 438 bp(见图3)。登录GenBank数据库,将测序结果与GenBank中已报道序列进行同源性比较,结果表明,PA-2与HM224410.1(Pseudomonas aeruginosa strain JL091016)、FJ907192.1(Pseudomonas aeruginosa isolate 9)、FJ972533.1(Pseudomonas aeruginosa isolate 10)和FJ907193.1(Pseudomonas aeruginosa isolate 10)的同源性均达99%,证明该菌株为Pseudomonas aerugi⁃nosa。

图3 PA-2 16S rDNA的PCR扩增产物琼脂糖凝胶电泳Fig.3 Agarose gel electrophoresis for PCR product of 16S rDNA of PA-2
2.3 拮抗细菌PA-2发酵条件的优化
碳源试验结果表明,葡萄糖为最适碳源(见图4),0.1%浓度最佳(见图5)。有机氮源试验结果表明,牛肉膏、蛋白胨为氮源时抑菌效果较好(见图6),在牛肉膏与蛋白胨组合浓度为1%(见图7)时PA-2的生长量最大且二者的比例为5:3抑菌效果最好(见图8)。以KNO3为无机氮源时PA-2产量最高(见图9),且抑菌活性显著高于其他无机氮源;一定量的KNO3和NaCl均能促进PA-2生长,亦能提高PA-2抑菌活性,其中以0.3%NaCl(见图10)和0.5%KNO3(见图11)效果最好。
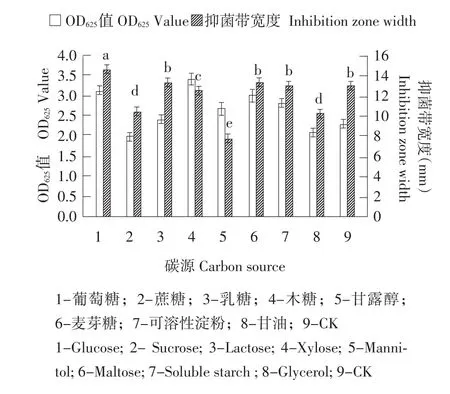
图4 单一碳源对PA-2产量和抑菌活性的影响Fig.4 Effect of single carbonhydrate on population and antibacterial activity of PA-2

图5 葡萄糖浓度对PA-2产量和抑菌活性的影响Fig.5 Effect of glucose concentration on population and antibacterial activity of PA-2

图6 单一有机氮源对PA-2产量和抑菌活性的影响Fig.6 Effect of single organic nitrogen on population and antibacterial activity of PA-2

图7 牛肉膏与蛋白胨组合对PA-2产量和抑菌活性的影响Fig.7 Effect of beef extract combined with peptone on population and antibacterial activity of PA-2
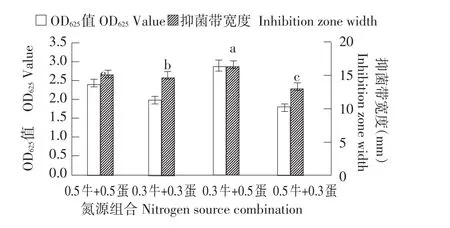
图8 牛肉膏与蛋白胨组合浓度对PA-2产量和抑菌活性的影响Fig.8 Effect of the concentration of beef extract combined with peptone on population and antibacterial activity of PA-2

图9 单一无机氮源对PA-2产量和抑菌活性的影响Fig.9 Effect of single inorganic nitrogen on population and antibacterial activity of PA-2

图10 NaCl对PA-2产量和抑菌活性的影响Fig.10 Effect of sodium chloride on population and antibacterial activity of PA-2

图11 KNO3浓度对PA-2产量和抑菌活性的影响Fig.11 Effect of potassium nitrate concentration on population and antibacterial activity of PA-2
PA-2最佳实验室发酵配方为氮源1%,其中牛肉膏∶蛋白胨=5:3;KNO30.5%;葡萄糖0.1%;Na⁃Cl 0.3%。按此条件的试验结果在氮源、葡萄糖、NaCl和KNO34因素3种不同浓度正交试验表9次试验中并未出现,通过做补充试验,结果得到16.9 mm的抑菌带宽度,大于正交试验结果中的最高值16.1 mm,说明利用正交试验优化培养基的试验成功。
发酵条件筛选试验结果表明,PA-2最适生长温度为28℃(见图12),最适pH为7.0~7.5(见图13),接种量在4%(见图14),装液量为50 mL时PA-2产量最大,发酵液抑菌活性也最高(见图14)。
2.4 PA-2对烟草角斑病的田间药效
PA-2防治烟草角斑病田间药效试验结果见表2。喷施3次生防菌后,PA-2优化发酵液的防效达到69.77%,显著高于其他处理。PA-2发酵液的防效达58.03%,显著高于农用链霉素的防效。证明PA-2对烟草角斑病具有良好的田间防效,有进一步研发价值。
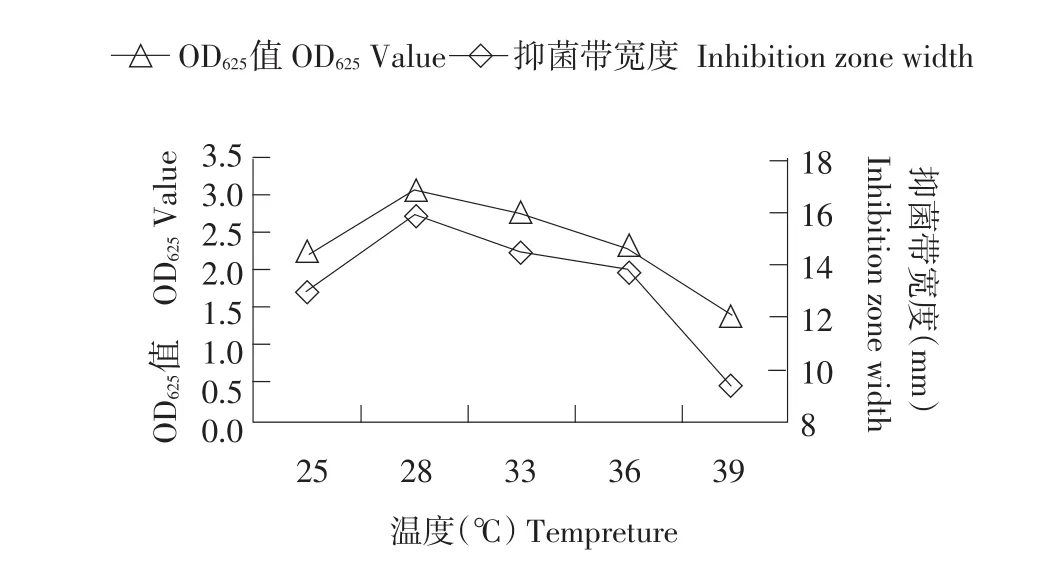
图12 温度对PA-2产量和抑菌活性的影响Fig.12 Effect of cultural temperature on population and antibacterial activity of PA-2
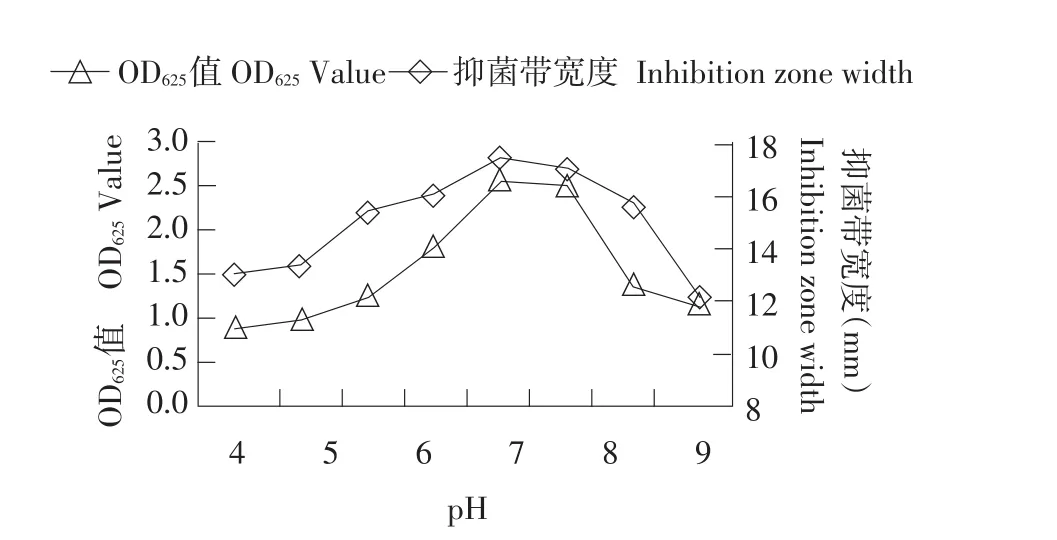
图13 pH对PA-2产量和抑菌活性的影响Fig.13 Effect of pH on population and antibacterial activity of PA-2

图14 接种量对PA-2产量和抑菌活性的影响Fig.14 Effect of inoculation volumes on population and antibacterial activity of PA-2

图15 装液量对PA-2产量和抑菌活性的影响Fig.15 Effect of medium volumes on population and antibacterial activity of PA-2
2.5 PA-2抑菌活性物质的提取及初步鉴定
PA-2无菌发酵液用硫酸铵分级沉淀提取后,测定提取物对烟草角斑病菌的抑菌活性,结果表明(见表3),硫酸铵30%~90%各饱和度沉淀物质均有抑菌活性,抑菌圈直径为15.3~41.6 mm,其中60%~70%(不含60%)饱和度沉淀物拮抗效果最好,显著优于其他处理,说明在此饱和度下沉淀出的抑菌活性物质最多(见表4)。

表3 PA-2发酵液对烟草角斑病的田间药效Table 3 Field effect of PA-2 fermentation liquid against tobacco angular leaf spot

表4 PA-2抑菌活性物质对烟草角斑病菌的抑菌效果Table 4 Antagonistic effect of the antagonistic active substances against P.syringae pv.tabaci
将上述抑菌活性物质分别经50、60、70、80和90℃处理30 min后,抑菌活性与对照处理(25℃)相比并未下降;100℃处理30 min和121℃高温高压(0.4 MPa)处理20 min后,抑菌活性下降25%。说明该抑菌活性物质对高温具有耐受性(见图16)。
上述抑菌活性物质经胰蛋白酶和蛋白酶K处理后抑菌活性比对照分别下降8.3%和12.5%,表明拮抗细菌PA-2产生的抑菌活性物质可能包括蛋白质类,但起抑菌活性的主要为非蛋白类。
经乙醇、乙醚、氯仿、乙酸乙酯、正丁醇和丙酮萃取后,萃取物均显示出一定抑菌活性,抑菌活性下降范围在1.4%~4.0%,且随着有机溶剂极性的增加,抑菌活性也逐渐增强。丙酮萃取物的抑菌活性最强,乙醇与丙酮萃取物的抑菌活性相当。根据“相似相容”原理,该活性成分的极性应该介于丙酮和乙醇之间。由于丙酮具有低毒性,且易燃,因此确定乙醇为最佳有机萃取溶剂。
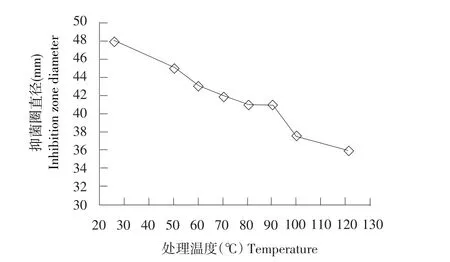
图16 抑菌活性物质经不同热处理后的抑菌活性Fig.16 Antagonistic activity of the antagonistic active substances treated at different temperatures
在酸性和碱性条件下,抑菌活性物质的抑菌活性均表现出不同程度下降,且酸性条件下抑菌活性丧失程度相对较大,pH接近1.0时抑菌活性几乎全部丧失。当pH达11.0时,抑菌活性下降24%,与对照差异不显著。说明抑菌活性成分有较好的耐碱性,但耐酸性较差。
综上所述,表明拮抗细菌PA-2产生的抑菌活性物质为一种小分子碱性、水溶性脂肽类。
3 讨论与结论
细菌具有防治植物病害能力,目前主要有假单胞杆菌(Pseudomonas spp.)、芽孢杆菌(Bacillussubtilis)、土壤放射杆菌(Agrobacterium radiobacter)等[15,20]。乔禅等从烟草根际土壤中筛选出一株荧光假单胞菌(Pseudomonas fluorescens),其对烟草角斑病的田间防效为87.34%[5]。防效表面较高,但是在对照区病情指数只有3.74和以清水为对照的情况下得出。如果以农用链霉素为参照,本研究生防菌株PA-2对烟草角斑病相对防效为54.01%,而乔禅等
研究表明,拮抗细菌产生抗菌活性物质包括低分子质量抗生素、细菌素、细胞壁降解酶和未鉴定的抗菌蛋白等。这些抑菌物质存在于植物体内,可伴随拮抗菌在植物体内运转,提高防病效果[21]。国内外研究多从天然产物中寻找生物活性物质,经分离、提纯、测定分子结构,作为人工合成新农药品种模板[22-23]。其共同特点是高效防治且不产生抗性,在环境中易被降解,是环境友好型农药,利用微生物杀菌剂防治烟草角斑病前景广阔。本研究结果表明,PA-2产生的抑菌活性物质耐高温,对胰蛋白酶和蛋白酶K均不敏感,有较好耐碱性,确定该活性物质为一种小分子脂肽类,但起作用的活性物质以何种形式存在,尚需后续试验进一步证明。
[1]李发新,胡玉梅,张艳玲.济源市王屋烟区烟草角斑病发生原因及防控对策[J].中国植保导刊,2008,28(9):31-32.
[2]刘雅婷,张世珖,李永忠,等.防治烟草野火病的药剂筛选及应用研究[J].湖南农业大学学报,2002(2):109-111.
[3]王家银,李明菊,刘玉斌,等.抗生素类药剂防治烟草野火病应用研究[J].云南农业科技,2000(1):11-12.
[4]张晓雯,高芬,魏颖颖,等.拮抗链霉菌H210发酵液抗菌谱及理化性质[J].湖北农业科学,2008,47(6):2283-2284.
[5]乔婵,陈星,张艳菊,等.PF7-5对烟草角斑病的室内及大田防治效果[J].中国林副特产,2010(5):18-19.
[6]Hiraoka H,Asaka O,Ano T,et al.Molecular cloning of a gene re⁃sponsible for the biosynthesis of lipopeptide antibiotics iturin and surfactin[J].Journal of Fermentation and Bioengineering,1992, 74:323-3261.
[7]Buchenauer H.Biological control of soil-borne disease by rhizo⁃bacteris[J].Plant Disease and Protection,1995,44:40-50.
[8]陈晓斌,张炳欣.植物根围促生细菌(PGPR)作用机制的研究进展[J].微生物学杂志,2000,20(1):38-41.
[9]Ran L X,Xing M L,Zhou B,et al.Siderophes are the main deter⁃minants of Pseudomonas fluorescens strain in suppression of grey mould in Eucalyptus urophylla[J].Plant Disease and Protection, 2005,35(1):6-12.
[10]方中达.植病研究方法[M].3版.北京:中国农业出版社,1998: 171-208,212-218.
[11]Edwards K,John stone C,Thompson C.A simple and rapid meth⁃od for the preparation of plant genomic DNA for PCR analysis [M].Nucleic Acids Research,1991,19:1349.
[12]文景芝,杨晓敏,李樱梅,等.烟草野火病菌拮抗细菌的筛选及其应用研究[J].东北农业大学学报,2012,43(10):156-160
[13]钱存柔,黄仪秀.微生物学实验教程[M].北京:北京大学出版社,2008:23-33,113-129.
[14]沈萍,范秀荣,李广武.微生物学实验[M].3版.北京:高等教育出版社,2003:28-30,116-120.
[15]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984:54-68.
[16]车秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社, 2001:364-398.
[17]Schroth N,Milton J G.Hancock.Importance of chitin synthesis for fungal growth and as a target for antifungal agents[J].Journal of General Microbiology,1981,53(10):281-285.
[18]刘永峰,陈志谊,张杰,等.枯草芽孢杆菌B2916胞外抗菌蛋白质的性质[J].江苏农业学报,2005,21(4):288-293.
[19]张成省,孔凡玉,关小红,等.烟草叶围细菌Tpb55菌株的鉴定及其抑菌活性[J].中国生物防治,2008,24(1):63-68.
[20]Keer A.Interactions of soil microflora with cucurbit wilt special emphasis on non-pathogenic Fusarium[J].1982(20):167-192.
[21]Klepper J W,Beauchamp C J.A review of issues related to mea⁃suring colonization of plant roots by bacteria[J].Can J Microbiol, 1992,38:1219-1232.
[22]赵善欢,张兴.植物质杀虫剂对水稻三化螟的拒食及内吸毒力试验[J].中国农业科学,1982(2):55-62.
[23]张兴.试论无公害农药[J].西北农业大学学报,1995,23(6): 90-95.
ScreeningofantagonisticbacterialstrainagainstPseudomonas syringaepv.tabaciand studies on antagonistic active substances/
WENJingzhi1,ZHAO Liming1,YANG Xiaomin1,SUN Jianping2,LIU Zhenping3(1.School of Agriculture, Northeast Agricultural University,Harbin 150030,China;2.Tobacco Research Institute of Mudanjiang, Mudanjiang Heilongjiang 157011,China;3.Workers Educational Technology Center of Heilongjiang Province,Harbin 150001,China)
In the present study,287 and 98 bacterial strains were isolated from healthy tobacco plants and their rhizospheric soil samples as well as 20 kinds of weeds from Hainan Province,in which 22 strains had antibacterial activity againstPseudomonas syingaepv.tabaci.The strain PA-2 that was identified as Pseudomonas aeruginosaby morphological,physiological and biochemical as well as molecular biology tests was isolated from the leaf ofEchinochloa crusgalliin Sanya and had the best inhibiting and stableeffect.The optimal fermentation medium components for PA-2 constituted of 1%of nitrogen(beef extract: peptone=5:3),0.1%of glucose,0.5%of sodium chloride,and 0.3%of potassium nitrate.The optimal fermentation conditions:cultural temperature 28℃,optimum initial pH 7.0-7.5,inoculation seed liquid 4% and 50 mL of loading liquid in a 250 flask.The field effect of PA-2 fermentation liquid against tobacco angular leaf spot was 69.77%,24.47%increase over the streptomycin.We used the ammonium sulfate precipitation classification method to separate the antibacterial active substances,the results showed that each 30%-90%saturation of(NH4)2SO4had precipitated antibacterial active substances,in which 60%-70% (exclusive 60%)was the most appropriate saturation.The antibacterial active substances had stronger heat stability,better tolerance to proteinase K,better resistance to alkali,but poor tolerance to acid,dissolved in parts of the organic solvents.The decreasing range of the antibacterial activity of extractants of Ethyl alcohol,Ethyl ether,chloroform,ethyl acetate,n-butanol and acetone was 1.4%-4.0%.So they might be a kind of alkaline and water-solubility antibacterial substance.
Pseudomonas syingaepv.tabaci;antagonistic bacterium;16S rDNA identification; optimization of fermentation condition;antagonistic active substance
S476+.9
A
1005-9369(2014)06-0016-08
时间 2014-6-11 16:10:16 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140613.0953.003.html
文景芝,赵黎明,杨晓敏,等.烟草角斑病菌拮抗细菌筛选及抗菌活性物质初步研究[J].东北农业大学学报,2014,45(6):16-23.
Wen Jingzhi,Zhao Liming,Yang Xiaomin,et al.Screening of antagonistic bacterial strain againstPseudomonas syringaepv. tabaciand studies on antagonistic active substances[J].Journal of Northeast Agricultural University,2014,45(6):16-23.(in Chinese with English abstract)
2013-12-04
黑龙江省科技计划项目(HN200810,HN200811);哈尔滨市科技创新人才研究专项资金项目(2007RFXXN005)
文景芝(1964-),女,教授,博士,博士生导师,研究方向为植物病害生物防治。E-mail:jzhwen2000@163.com
