沙棘叶中黄酮提取及大孔树脂分离纯化槲皮素
2014-01-13王昌涛孙宝国
李 柰, 王昌涛, 孙宝国
(1.北京工商大学食品学院,北京 100048;2.北京工商大学理学院,北京 100048)
沙棘叶中黄酮提取及大孔树脂分离纯化槲皮素
李 柰1, 王昌涛2,*, 孙宝国1
(1.北京工商大学食品学院,北京 100048;2.北京工商大学理学院,北京 100048)
采用响应面的方法对热碱水提取沙棘叶中黄酮的条件进行优化,较佳工艺条件为pH值 11.4,温度75.5℃,质量浓度28.6mg/m L,提取2.0 h,产率为1.23%.磷酸沉淀后采用大孔树脂进行纯化,比较了3种大孔树脂AB-8、DM301、HPD-100对沙棘黄酮的纯化效果,最终选出较佳大孔树脂为AB-8,且当上样液浓度为1.0mg/mL、pH值为6.0、吸附1.0 h后,树脂的吸附率达到最大值.最后用3倍柱体积蒸馏水洗脱除去杂质,用不同体积分数乙醇溶液(30%,50%,70%,80%, 90%)进行梯度洗脱,并将解吸液用高效液相色谱(HPLC)进行检测,结果显示80%和90%乙醇解吸液中槲皮素纯度均可到达97%以上.
沙棘叶;黄酮;热水碱提;大孔树脂;槲皮素
沙棘(HippophaerhamnoidesLinn.)是被子植物门(Angiospermae)木兰纲(Magnoliopsida)蔷薇亚纲(Rosidae)山龙眼目(Proteales)胡颓子科(Elaeagnaceae)沙棘属(Hippophae)植物,又名醋柳,酸刺儿.据报道沙棘中富含多种化学成分及生物活性物质,对儿童生长发育、中青年缓解疲劳以及老年人调节新陈代谢、减缓衰老均具有显著效果[1].目前,用沙棘生产的食品有果汁饮料、汽水、香槟、啤酒、果酱、冰淇淋、明胶软糖、沙棘饼干、果脯等.沙棘嫩叶可以制茶,它具有抗癌、消炎、抗氧化等功效,而且其咖啡碱含量低,适用于老人、小孩、高血压等神经衰弱患者[2].当用沙棘叶和沙棘残渣作为补充饲料时,可使断奶仔猪增重9.38%~21.72%,奶山羊奶量增加6.24% ~6.88%,蛋鸡产蛋率提高8.1% ~11.3%,产蛋量增加24.9% ~28.7%,并能明显增加蛋黄中胡萝卜素含量,降低胆固醇含量[3].沙棘黄酮是沙棘中一类重要的活性成分,在沙棘叶中含量最高,具有生物抗氧化、清除自由基、抗衰老[4-5]、降血脂、降血压、降血糖、治疗心脑血管疾病[6-7]以及消炎、镇痛、抗菌和增强免疫力等作用[8-9].目前,沙棘黄酮的提取分离方法有超声波提取法、微波提取法、水浸提法、碱性助提剂提取法、硅胶柱色谱法、大孔吸附树脂法等[10].沙棘叶中总黄酮主要以苷的形式存在,采用热水浸提法提取成本低、生产过程安全、设备简单是替代乙醇萃取剂的首选溶剂.近年来,吸附树脂法因其操作简单、成本低、环境友好、纯化效率高等优点,在天然植物有效成分的纯化以及工业化制备中发挥了越来越大的作用.本文采用热水碱提法提取沙棘叶中黄酮并采用大孔吸附树脂进行分离纯化.
1 材料、试剂与仪器
1.1 材料
沙棘叶,干燥叶片,实验前粉碎,由新疆药物研究所提供;大孔吸附树脂(AB-8、DM301、HPD-100),购于上海华羚树脂有限公司.
1.2 试剂
氢氧化钠(分析纯)、85%磷酸(分析纯)、无水乙醇(分析纯)购于北京化工厂;芦丁标准品(色谱纯)、槲皮素标准品(色谱纯),SIGMA公司;甲醇(色谱纯)、乙腈(色谱纯)、乙酸(色谱纯),Fisher公司.
1.3 仪器
TB-214型电子天平,北京赛多利斯仪器系统有限公司;RJ-TDL-5A型低速大容量离心机,无锡市瑞江分析仪器有限公司;DK-98-1型电热恒温水浴锅,天津市泰斯特仪器有限公司;T6新世纪型紫外可见分光光度计,北京普析通用仪器有限公司;SHZ-Ⅲ型循环水真空泵及RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;pHS-3D型pH计,上海三信仪表厂; YS-04型小型高速粉碎机,北京燕山正德机械设备有限公司;Agilent 1260型高效液相色谱仪(配有四元梯度泵、自动进样器、二极管阵列检测器、Chem Station色谱工作站等),Agilent ZORBAX SB-C18柱(250mm×4.6mm,5μm),美国安捷伦科技有限公司;大孔树脂吸附层析柱系统(层析柱:1.6 cm×30 cm,DHL-A型电脑恒流泵,DBS-100型电脑全自动部分收集器),上海沪西仪器厂有限公司.
2 实验方法
2.1 沙棘黄酮的测定方法
2.1.1 紫外分光度测定
以芦丁为对照品,在510 nm下采用Al3+显色法测定黄酮含量[11].
1)标准曲线绘制.准确称取标准品后逐级稀释至不同浓度,测定不同质量浓度芦丁标准液,以吸光度y为纵坐标,质量浓度x为横坐标(mg/mL)绘制标准曲线,得到回归方程 y=11.314x-0.000 6, R2=0.999 4.
2)样品黄酮含量测定.取适量样品提取液,稀释后,根据回归方程计算提取液中黄酮含量.
2.1.2 高效液相测定
据文献[12]报道,沙棘黄酮中主要含有儿茶素、芦丁、槲皮素、山柰酚、异鼠李素5种活性物质,但根据实验需要,只选取芦丁、槲皮素两种标准品进行液相分析,见图1.
HPLC检测方法是 Agilent ZORBAX SB-C18柱(250mm×4.6mm,5μm),流速1mL/min,柱温25℃,流动相A为含有体积分数0.5%乙酸的甲醇和乙腈混合液(40∶15,V/V),流动相B为体积分数0.5%乙酸的超纯水,检测波长279 nm,梯度洗脱如表1.

图1 两种标准品HPLCFig.1 HPLC of two standard products

表1 高效液相梯度洗脱Tab.1 HPLC gradient elution
图1中1号峰为芦丁,出峰时间为10.087min; 2号峰为槲皮素,出峰时间为15.189min.根据文献[13]所述方法,精密称取对照品,以不同浓度分别上样,然后以质量浓度x(mg/m L)为横坐标,峰面积y为纵坐标,计算回归方程.芦丁的标准曲线为y= 17 891x-28157,R2=0.999 4;槲皮素标准曲线为y=41 046x-55718,R2=0.999 2,见图2.
2.2 热水碱提
取一定量干燥沙棘叶,粉碎过50目筛.称量25.0 g沙棘叶粉,按实验计划溶解,并用1.0 mol/L 的NaOH溶液和1.0mol/L磷酸溶液调节pH值,控制反应温度及反应时间,抽滤后用分光光度计测定.
2.2.1 单因素实验
各因素水平设置为pH值:4.0,6.0,8.0,10.0, 12.0;温度:50,60,70,80,90℃;时间:0,0.5,1.0, 1.5,2.0,2.5,3.0 h;质量浓度:50.0,40.0,33.3, 28.6,25.0mg/mL.
2.2.2 响应面试验
根据单因素实验结果,采用响应面设计,利用Design-Expert7.1.6软件进行Box-Behnken设计和实验处理,以确定较优工艺条件[14-16].选择对黄酮浸提率有显著影响的3个因素:pH值,温度,质量浓度,进行3因素3水平响应面分析试验,因素水平及编码见表2.

图2 高效液相标准曲线Fig.2 HPLC standard curves
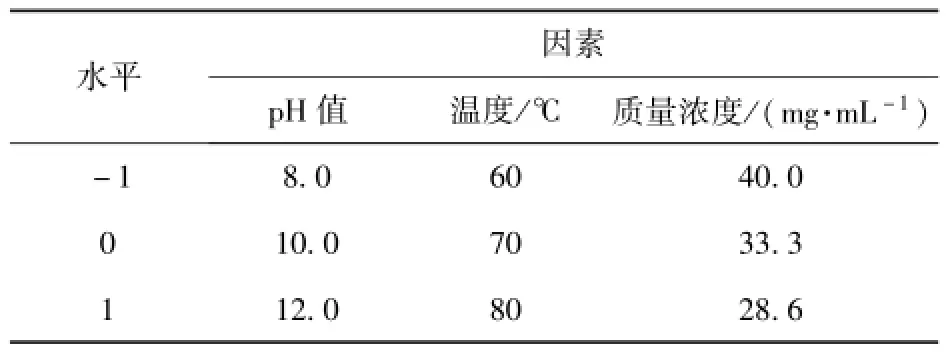
表2 响应面三因素三水平实验设计Tab.2 Factors and levels of response surface analysis
2.3 大孔树脂纯化研究
将热碱水提取液过滤后用1.0mol/L的磷酸中和至pH值为7.0,离心集沉淀,沉淀物溶解后再次调至中性,然后作为上样液进行纯化.
2.3.1 静态吸附和解吸实验
2.3.1.1 树脂选择
根据文献[17-19]选取树脂 AB-8、DM301、HPD-100对样品中沙棘黄酮进行静态吸附、解吸. 在50mL 1mg/mL的上样液中加入5.00 g树脂,放入25℃恒温水浴摇床中振荡,在不同时间1.0, 2.0,3.0,4.0,5.0 h取样.利用分光光度法计算树脂吸附值.


2.3.1.2 单因素实验
选取树脂AB-8进行如下各单因素实验:上样液pH值分别调至4.0,5.0,6.0,7.0,8.0;上样液质量浓度分别为0.2,0.5,1.0,2.0,3.0 mg/mL;洗脱
树脂吸附饱和后,用去离子水洗涤,再用50 mL体积分数为70%的乙醇在25℃恒温水浴摇床中解吸.在不同时间0.5,1.0,1.5,2.0,3.0 h取样.利用分光光度法计算树脂的解吸率.液分别为体积分数40%,50%,60%,70%,80%的乙醇.利用分光光度法计算树脂的吸附值及解吸率.
2.3.2 动态吸附/解吸实验
将35 g树脂AB-8装于层析柱(1.6 cm×30 cm,柱体积100m L)中,平衡后采用1.0mg/mL pH值为6.0的上样液进行吸附,流速1.0 mL/min,上样量150mL,用收集器收集流出液(10min/管),并用分光光度法测定每管流出液浓度,计算最适上样量.吸附完毕后用3倍柱体积的去离子水以2mL/min洗涤,最后再分别用体积分数30%,50%,70%,80%,90%乙醇进行梯度洗脱,流速1.0 mL/min,每个浓度分别洗脱100 mL,收集洗脱液,采用HPLC方法进行测定.
3 结果与分析
3.1 热水碱提条件确定
3.1.1 提取单因素优化
不同pH值、温度、时间、质量浓度等因素的单因素条件对沙棘黄酮提取率的影响见图3.由图3可知,pH值的增加使得沙棘黄酮的产率不断上升, 但pH值过大后黄酮会被破坏,产率降低,所以较佳pH值为10.0;在温度的单因素实验中,总黄酮产率随温度的提高呈上升趋势,这是因为温度升高,加快了分子的扩散能力[20],但当温度达70℃后,产率随温度的上升而不再改变,所以较佳提取温度为70 ℃;提取时间测定中,当低于2.0 h时总黄酮产率随时间增加而增大,当提取时间大于2.0 h后,总黄酮产率随时间变化的趋势减缓,所以选择适宜提取时间为2.0 h;最后在质量浓度实验中,当质量浓度大于33.3mg/mL后,总黄酮产率趋势随质量浓度增加而变缓,即当质量浓度达到一定程度时,即使再增大质量浓度,产率也趋于稳定,此时溶剂已将有效成分基本完全溶出,所以适宜质量浓度为33.3mg/mL.

图3 提取各因素对总黄酮产率的影响Fig.3 Effects of various factors on extraction yield of total flavonoids
3.1.2 提取响应面优化
根据单因素实验结果,选择提取时间2.0 h,以提取pH值,温度,质量浓度作为因素,采用Box-Behnken设计试验,试验方案及结果见表3,回归方程模型方差分析及其系数的显著性检验见表4.

表3 响应面分析试验设计方案及结果Tab.3 Experimental design and corresponding results of response surface analysis

表4 回归方程模型方差分析及其系数的显著性检验Tab.4 Variance analysis for fitted quadraticmodel and significance tests of regression coefficients
经方差分析得到:A、A2项极其显著,B、AB、AC、B2项显著,其余项不显著,说明质量浓度、温度与质量浓度的交互作用影响弱.pH值、温度、质量浓度3个因素的影响顺序为:pH值>温度>质量浓度.
各因素经二次多项回归拟合后,得到黄酮产率对pH值、反应温度、质量浓度3个因素的二次多项回归方程:

响应面图能比较直观地反映各因素和各因素间的交互作用,通过多元回归方程做响应面图,见图4.

图4 两因素及其交互作用响应面和等高线Fig.4 Response surfaces and contour plots about effects of pairwise interactions of three operating parameters on extraction yield
根据回归方程得出理论较优的工艺条件为pH值11.35,温度75.54℃,质量浓度28.6 mg/mL,提取2.0 h,在此条件下提取理论值达到1.242%.在pH值为11.4,温度75.5℃,质量浓度28.6mg/mL,提取2.0 h条件下验证实际产率为1.23%,理论值与实际值误差不超过0.05%,结果表明,该模型可以较好地反映出沙棘叶热水碱提的条件,从而也证明了响应曲面法优化提取沙棘黄酮条件参数的可行性.
3.2 大孔树脂静态吸附/解吸实验
3.2.1 树脂选择
3种大孔树脂对沙棘黄酮的静态吸附/解吸过程随时间的变化规律见图5.
侦查机关的侦查活动是以刑事案件为对象,运用各种刑事科学技术手段和侦查措施揭露与证实犯罪的一种特殊的侦查决策活动,这一特殊活动的主要目的就是查明案件事实、查明犯罪嫌疑人、收集犯罪证据等。在这一过程中,必然会出现多种选择,如侦查方案的选择、侦查措施的选择、侦查途径的选择、侦查思维谋略的选择等。也就是说侦查的过程就是不断的拟定决策方案,不断的优选方案并使之付诸实施的过程。[1]
由图5可知:大孔树脂AB-8对沙棘黄酮的吸附和解吸效果明显优于树脂DM301和HPD-100,且吸附饱和时间为2.0 h,解吸基本完全时间为1.5 h.树脂AB-8的吸附值为11.35 mg/g,1.5h静态解吸率达到78.13%,选取树脂AB-8为较佳纯化树脂.

图5 不同树脂下沙棘黄酮静态吸附/解吸曲线Fig.5 Static adsorption/desorption curves of sea-buckthorn flavonoids under different resins
3.2.2 上样液pH值选择
随着上样液pH值的改变,大孔树脂AB-8对沙棘黄酮的静态吸附和解吸过程见图6.
由图6可知,沙棘黄酮的吸附值和解吸率在pH值为 6.0时达到最高,分别为 11.83 mg/g和86.23%,所以上样液pH值较优条件为6.0.
3.2.3 上样液浓度选择
随着上样液浓度的改变,大孔树脂AB-8对沙棘黄酮的静态吸附和解吸过程见图7.

图6 上样液不同pH值的沙棘黄酮静态吸附/解吸曲线Fig.6 Adsorption/desorption curves of sea-buckthorn flavonoids under different pH values
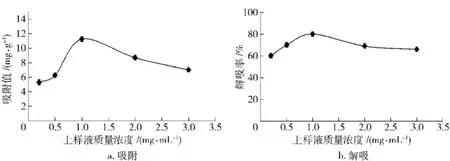
图7 上样液不同质量浓度下沙棘黄酮静态吸附/解吸曲线Fig.7 Adsorption/desorption curves of sea-buckthorn flavonoids under different concentration
3.2.4 洗脱剂浓度选择
大孔树脂AB-8在不同洗脱剂浓度下的解吸曲线见图8.
由图8解吸率可以看出,70%的乙醇解吸率最高,可到达81.67%,应选择70%乙醇进行解吸.
3.3 大孔树脂动态吸附/解吸实验
3.3.1 上样量确定

图8 洗脱剂不同体积分数下沙棘黄酮静态解吸曲线Fig.8 Desorption curve of sea-buckthorn flavonoids under different concentrations eluent
取150 mL浓度为1 mg/mL pH值为6的上样液,在装有35g AB-8树脂的层析柱(1.6 cm×30 cm,柱体积100mL)中纯化,流速为1.0 mL/min,每10min收集一管流出液,用分光光度法测定每管流出液浓度计算最适上样量,结果如图9.
吸附中当吸附质从流出物中出现时,穿透曲线的相应点为穿透点,如果穿透曲线上升很缓慢,可取流出物质量浓度为进料质量浓度的5%或10%为穿透点[21].由图9可知,当流出液达到60mL时,流出液质量浓度为0.12 mg/m L,达到穿透点,可以停止上样.因此,当上样液质量浓度为1.0 mg/m L时,较适上样量为60 mL.

图9 流出液质量浓度随上样量变化曲线Fig.9 Curve between effluent concentration and sample volume
3.3.2 上样液及不同体积分数洗脱液HPLC检测
上样液及体积分数30%,50%,70%,80%, 90%乙醇洗脱液进行HPLC检测,如图10,测定结果如表5.
将体积分数为80%及90%的乙醇洗脱液合并,冷冻干燥后称量,可得到槲皮素纯品15.45mg,产率为25.75%.

图10 上样液及不同体积分数洗脱液HPLCFig.10 Sample and different concentration of eluent on HPLC
4 结 论
本实验以沙棘叶为原料,响应面法优化了沙棘黄酮热水碱提的较优条件是在pH值为11.4,温度75.5℃,质量浓度28.6 mg/mL条件下验证实际产率为1.23%.热水碱提液用磷酸沉淀后溶解,选取35 g大孔树脂AB-8进行纯化,当上样液浓度为1.0mg/m L,pH值为6.0,流速为1.0 m L/min,上样60 mL后,用去离子水洗涤,最后用不同浓度乙醇进行解吸,发现80%及90%乙醇洗脱液中可以得到纯度为97%以上的槲皮素共15.45mg,产率为25.75%.

表5 HPLC方法检测上样液及不同体积分数洗脱液纯度Tab.5 Purity of sample and different eluents determined by HPLC
本实验比较系统的研究了沙棘叶的提取及纯化过程.采用热水碱提法提取,操作简单、成本低,适合工业化生产,提取液沉淀后,大孔树脂纯化一次就得到了槲皮素纯品,纯化效率高,但对于沙棘叶中其他黄酮活性物质的分离纯化过程仍需进一步研究.
[1] 齐虹凌,于泽源,李兴国.沙棘研究概述[J].沙棘, 2005,18(2):37-41.
[2] 王琳,冯建菊,蒋学玮.沙棘植物资源的综合利用[J].北方园艺,2002(6):24-25.
[3] 刘绪川,何国耀,张礼华,等.沙棘叶及沙棘制品残渣毒理学试验和对畜禽生产性能的影响[J].甘肃畜牧兽医,1993,23(1):1-8.
[4] Wei H C,Cai Q Y,Rahn R O,et al.Inhibition of UV light and fentonreaction induced oxidative DNA damage by the soybean isoflavonegenistein[J].Carcinogen Sis, 1996,17:73.
[5] Beretc A.Flavonoids are selective cyclic CMP phosphodiesteraseinhibitors[J].Biochem Pharmacol,1979,28: 536.
[6] 韩锐.抗癌药物研究与试验技术[M].北京:北京医科大学中国协和医科大学联合出版社,1997:141.
[7] 邓保炜,杜芳艳.花生蔓中总黄酮含量的测定[J].食品科学,2006,27(12):649-650.
[8] 白凤梅,蔡同一.类黄酮生物活性及其机理的研究进展[J].食品科学,1999,20(8):11-13.
[9] 王占彬,郭鲜敏,杨兰香,等.皂角刺提取物对肉仔鸡免疫功能及生长性能的影响[J].河南农业科学, 2005(9):98-100.
[10] 焦岩,常影,刘井权.沙棘黄酮提取与分离技术研究综述[J].食品工业,2012,33(8):115-118.
[11] 赵二劳,张晶,吕晶.可见与紫外光度法测定沙棘叶中总黄酮的比较[J].化学世界,2008(6):343-345.
[12] Yuangang Zu,Chunying Li,Yujie Fu,etal.Simultaneous determinationofcatechin,rutin,quercetinkaempferol and isorhamnetin in the extract of sea-buckthorn(Hippophaerhamnoides L.)leaves by RP-HPLC with DAD [J].Pharmaceutical and Biomedical Analysis,2006, 41(3):714-719.
[13] 孙斌,瞿伟菁,张晓玲,等.高效液相色谱法测定沙棘籽渣中黄酮苷元含量[J].中国药学杂志,2005, 40(2):139-141.
[14] 于修烛,王玲,杜双奎,等.响应面法优化枳椇子总黄酮超声波提取工艺[J].食品科学,2011,32 (12):125-129.
[15] 韩帅,李淑燕,陈芹芹,等.响应面分析法优化闪式提取胡柚皮中黄酮类化合物工艺[J].食品科学, 2011,32(10):52-56.
[16] 张玉香,屈慧鸽,杨润亚,等.响应面法优化蓝莓叶黄酮的微波提取工艺[J].食品科学,2010,31 (16):33-37.
[17] 李辰,邸多隆,蒋生祥.大孔吸附树脂对沙棘叶总黄酮的吸附性能考察[J].广东化工,2010,37(10): 12-13.
[18] 焦岩,王振宇.大孔树脂纯化大果沙棘果渣总黄酮的工艺研究[J].食品科学,2010,31(16):16-20.
[19] 王芃,马程浩,王春红,等.MA-EGDMA树脂纯化沙棘叶中总黄酮的研究[J].中草药,2009,40:144 -147.
[20] Liu CM,Zhao X L,Liu Z Q,et al.Isolation and extraction of total flavonoids from Epimedium Koreanum Nakai by supercritical fluid extraction[J].Chem Res Chinese U,2004,20(6):707-710.
[21] 孙彦.生物分离工程[M].北京:化学工业出版社, 2010:212.
W ater Extraction and M acroporous Resins for Purification of Flavonoids from Sea-buckthorn Leaves
LINai1, WANG Changtao2,*, SUN Baoguo1
(1.School ofFood and Chemical Engineering,Beijing Technology and Business University,Beijing 100048,China;
2.School ofScience,Beijing Technology and Business University,Beijing 100048,China)
Response surfacemethodology was applied to optimize the water extraction processing of total flavones from sea-buckthorn leaves.The optimalextraction conditionswere pH 11.4,temperature75.5℃, extraction time 2.0 h,and the ratio ofmaterial to liquid 1∶35 g/m L.Under the optimal conditions,the extraction yield was 1.23%.After being precipitated by phosphoric acid solution,the crude flavonoids were separated bymacroporous resins AB-8,DM301,and HPD-100.Macroporous resin AB-8 had the highestadsorption rate under the conditions of sample concentration 1.0mg/mL,pH 6.0,and adsorption time 1.0 h.About 3 times of column volumn distilled water were used to wash the unabsorbed samples and different concentrations ethanol solutions(30%,50%,70%,80%,and 90%)were used for desorption.The purity of quercetin were detected by high performance liquid chromatography(HPLC)and the purity of quercetin of 80%and 90%fractionswas above 97%.
sea-buckthorn leaves;flavonoids;water extraction;macroporous adsorption resin;quercetin
TS255.1
10.3969/j.issn.2095-6002.2014.04.011
2095-6002(2014)04-0056-08
(责任编辑:李 宁)
李柰,王昌涛,孙宝国.沙棘叶中黄酮提取及大孔树脂分离纯化槲皮素.食品科学技术学报,2014,32(4):56-63. LINai,WANG Changtao,SUN Baoguo.Water extraction and macroporous resins for purification of flavonoids from seabuckthorn leaves.Journal of Food Science and Technology,2014,32(4):56-63.
2013-07-12
国家质检公益项目(201310132).
李 柰,女,硕士研究生,研究方向为生物活性物质的分离提取;*王昌涛,男,副教授,博士,主要从事植物功效成分开发应用方面的研究.通讯作者.
