干旱胁迫及复水对玉簪生长和光合作用的影响
2014-01-02张金政张起源孙国峰何卿李晓东刘洪章
张金政,张起源,孙国峰,何卿,李晓东* ,刘洪章*
(1.中国科学院植物研究所,北京100093;2.吉林农业大学生命科学学院,吉林长春130118;3.国家知识产权局专利局专利审查协作北京中心,北京100190)
近年来,在全球气候变化背景下干旱频繁发生且日趋严重,大部分国家和地区都不同程度地受到干旱威胁[1],合理利用水资源成为一个世界性的课题。而水资源短缺已成为干旱地区限制植物正常生长发育的关键因素。
玉簪属(Hosta)植物作为重要的耐阴地被观赏植物,被世界各地广泛栽培应用。玉簪为浅根性地被植物,根系分布不超过40 cm,其耐旱能力与木本植物相比是有限的。大多数玉簪喜潮湿环境,生长季节每周平均的降雨量25~30 mm利于玉簪生长[2]。在园林绿化过程中,经常会因降雨过少而导致干旱胁迫从而使玉簪的生长受到抑制。由于玉簪属植物应用量较大,需要进行节水栽培。目前园林应用的玉簪主要有两类,有走茎的玉簪和无明显走茎的玉簪;二者对肥料的需求和利用效率不同[3];而二者对水分的需求和利用效率有无差异尚不清楚。
干旱胁迫能够对植物的外部形态、内源激素、光合作用等产生多方面的影响[4-5]。短期或轻度干旱胁迫下植物叶片水势降低、气孔关闭,降低了CO2的摄取与光合作用;长期而严重的干旱胁迫可抑制植株生长,并引起外观形态和生物量的变化,甚至会致使植物死亡[6-10]。而短期干旱胁迫后复水,部分生理指标能得到不同程度的恢复[11],既保证了植物的生长发育需要又做到了节水,成为近年研究的一个热点。然而有关干旱胁迫及复水对玉簪生长和光合作用的影响方面的研究尚未见报道。本文以中国原产玉簪属原种东北玉簪(H.clausa var.ensata)(有走茎小型玉簪)和紫萼玉簪(H.ventricosa)(无走茎大型玉簪)为材料,通过研究干旱胁迫及胁迫后复水对2种玉簪干物质量、部分形态指标、叶绿素含量、气体交换和叶绿素荧光参数的影响,旨在揭示干旱胁迫及复水对玉簪属植物生长和光合作用的影响机制,为提高玉簪属植物水分利用效率和实行节水栽培提供理论依据。
1 材料与方法
1.1 试验材料与处理
试验在中国科学院植物研究所植物园引种驯化组试验地进行。2010年4月选择田间生长一致的3年生东北玉簪(有走茎小型玉簪)和紫萼玉簪(无走茎大型玉簪)大苗移栽到花盆中(规格为29 cm×24 cm,每盆装栽培土6 kg,栽植1株,每株留1芽),进行正常的栽培管理。光照强度为自然光照的50%(黑色遮阳网遮荫)。栽培基质为园土∶黄沙土∶草炭 =3∶1∶1,其营养状况为:全氮0.012%、水解性氮11.3 mg/kg、全磷12.2 mg/kg、全钾 1.68%、有机质 0.312%、pH 8.2。
于2010年6月开始进行干旱胁迫处理。根据张起源[12]的研究结果,试验设3个水分梯度:对照(CK,土壤相对含水量为90% ~95%)、中度干旱胁迫(moderate drought stress,简写为MD,土壤相对含水量为50% ~55%)和重度干旱胁迫(severe drought stress,简写为SD,土壤相对含水量为30% ~35%)。胁迫时间:15,30和45 d。开始控水后每天18:00采用称重法测量土壤含水量,补充当天的水分消耗,使土壤含水量保持在设定范围内。对不同胁迫处理到达设定胁迫时间后的相关指标(形态指标、生物量、叶绿素含量、气体交换参数和叶绿素荧光参数)进行测定,作为复水前的基准值;测定完立即复水(rewatering,简写为RW,恢复至土壤相对含水量为80% ~85%),复水后15 d再次分别对CK、MD、SD、中度干旱胁迫处理15 d后复水15 d(MD15+RW15)和重度干旱胁迫处理15 d后复水15 d(SD15+RW15)、中度干旱胁迫处理30 d后复水15 d(MD30+RW15)和重度干旱胁迫处理30 d后复水15 d(SD30+RW15)的相关指标进行测定。3次重复。
1.2 测定项目及方法
干物质量测定:干旱胁迫处理后15,30,45 d,以及胁迫后复水15 d,每个处理取3盆植株分别测定地上部、地下部干物质量。取3盆植株清除根系周围的泥土并清洗全株后,用吸水纸吸去多余的水分,在105℃下杀青20 min,85℃烘干至恒重,用电子天平(精确度0.001 g)称其干物质量。
形态指标测定:分别于干旱处理后15,30,45 d,以及胁迫后复水15 d测定侧芽数、叶片数、总叶面积、须根数量、株高等。其中总叶面积采用数码相机和Photoshop软件非破坏性测定[13]。
叶绿素含量测定:参考Arnon[14]的方法,分别于干旱处理后15,30,45 d,以及胁迫后复水15 d,选取5片成熟功能叶片,用直径6 mm的打孔器分别打20个叶圆片,用25 mL 80%丙酮于暗处浸提48 h,其间每隔2 h振荡1次,使叶绿素均匀分布于丙酮溶液中,至叶圆片完全泡白。用UV-4802型分光光度计(USA)分别在663,646及470 nm波长下测定 OD值,根据修正的Arnon公式计算出叶绿素a(Chla)、叶绿素b(Chlb)和总叶绿素[Chl(a+b)]含量。修正的Arnon公式如下:
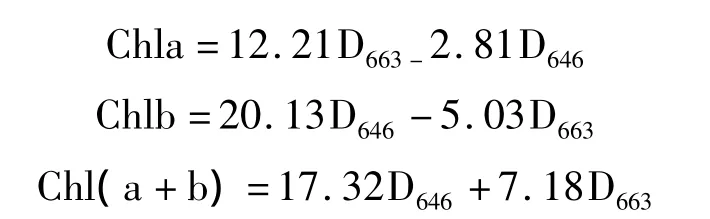
气体交换参数测定:采用LI-6400便携式光合仪(LICOR Inc,USA),分别于干旱处理后15,30,45 d,以及胁迫后复水15 d的上午8:00-11:00选取玉簪中部成熟功能叶片进行测定。仪器采用开放式气路,内置光源,光强为600 μmol/(m2·s)(2 种玉簪饱和光强[15]),主要测定叶片净光合速率(Pn,μmol/m2·s)、气孔导度(Gs,mmol/m2·s)、胞间 CO2浓度(Ci,μmol/m2·s)、蒸腾速率(Tr,mmol/m2·s)等参数,5 次重复。
叶绿素荧光参数测定:采用LI-6400便携式光合仪(LICOR Inc,USA),分别于干旱处理后15,30,45 d,以及胁迫后复水15 d的上午8:00-11:00选取玉簪中部成熟功能叶片于光合速率测定过程中,施加作用光(600 μmol/m2·s),测定光适应下的最大荧光(Fm')、光适应下最小荧光(Fo')、稳态荧光产量(Fs);于22:00-24:00选取中部功能叶片测定暗适应下的初始荧光(Fo)和最大荧光(Fm),5次重复。根据以下公式计算出以下荧光参数:1)光系统II(PSII)最大光能转化效率,Fv/Fm=(Fm-Fo)/Fm;2)光适应下PSII最大光能转化效率,Fv'/Fm'=(Fm'-Fo')/Fm';3)PSII电子传递量子效率,ФPSII=(Fm'-Fs)/Fm';4)光化学猝灭系数,qP=(Fm'-Fs)/(Fm'-Fo');5)非光化学猝灭系数,NPQ=(Fm-Fm')-1。
1.3 数据处理与分析
采用Excel进行数据处理,SPSS 11.0软件(SPSS Inc.,USA)进行方差分析和Duncan多重比较,并用Sigma Plot 10.0(SPSS Inc.,USA)进行作图。
2 结果与分析
2.1 干旱胁迫及复水对2种玉簪干物质量的影响
与对照相比,随干旱胁迫时间的延长东北玉簪MD和SD 处理地上部干物质量逐渐减少。处理后15 d,MD和SD处理与对照无显著差异;处理后30 d,SD处理显著低于对照;处理后45 d,SD处理显著低于MD处理,MD处理显著低于对照(图1A)。重度干旱胁迫处理15 d后复水15 d(SD15+RW15),干物质量恢复到对照水平;而无论中度干旱胁迫处理30 d后复水15 d(MD30+RW15),还是重度干旱胁迫处理30 d后复水15 d(SD30+RW15),干物质量均显著低于对照和干旱胁迫处理(图1A)。干旱胁迫处理后短期内(处理后15 d)MD和SD处理地下部干物质量显著高于对照(即所谓的旱长根);而随干旱胁迫时间的延长MD和SD处理对地下部干物质量增长的抑制作用逐渐显现:处理后30 d,SD处理显著低于对照;处理后45 d,SD处理显著低于MD处理,MD处理显著低于对照(图1B)。无论中度干旱胁迫处理还是重度干旱胁迫处理后复水,地下部干物质量均能得到不同程度的恢复;尤其是中度干旱胁迫处理15 d后复水15 d(MD15+RW15)地下部干物质量还显著高于对照(图1B)。
干旱胁迫对紫萼玉簪干物质量的影响与对东北玉簪的影响相似(图1C、图1D)。与东北玉簪最大不同之处在于,无论中度干旱胁迫处理还是重度干旱胁迫处理30 d后复水15 d,地下部干物质量均无法得到有效恢复(图1D)。
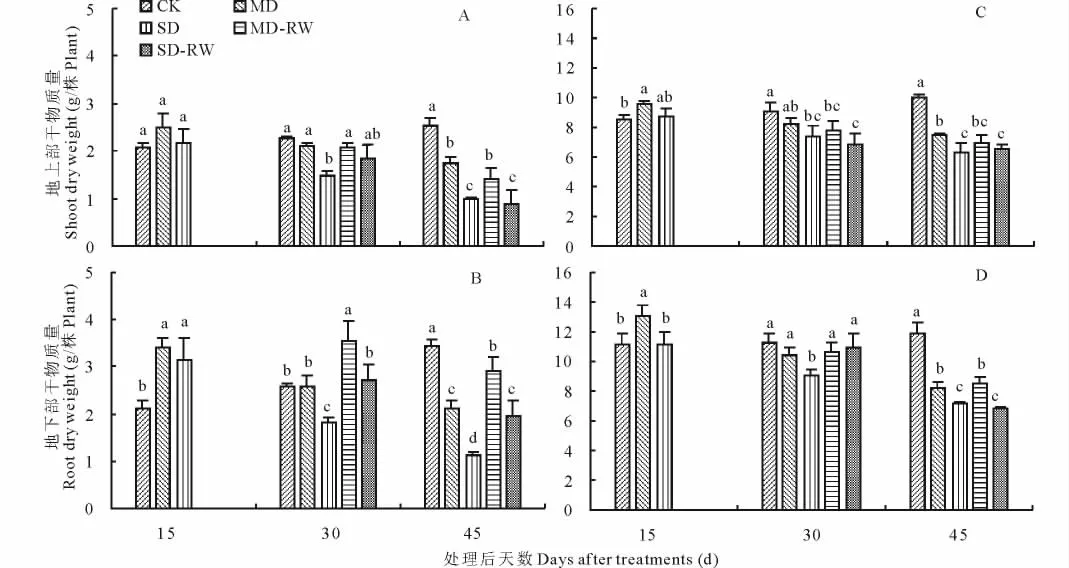
图1 干旱胁迫及复水后东北玉簪(A、B)和紫萼玉簪(C、D)干物质量的变化Fig.1 The changes of dry weights of H.clausa var.ensata(A,B)and H.ventricosa(C,D)after drought stress and rewatering
2.2 干旱胁迫及复水对2种玉簪形态指标的影响
对于东北玉簪,干旱胁迫处理后15 d,仅MD和SD处理(MD15和SD15)的根数显著低于对照,SD处理显著低于MD处理。随着干旱胁迫时间的延长,干旱处理对玉簪不同形态指标的抑制作用开始逐渐显现:干旱胁迫处理后30 d,MD处理(MD30)的叶片数,SD处理(SD30)的侧芽数、叶片数、总叶面积、根数和株高均显著低于对照;干旱胁迫处理后45 d,MD处理(MD45)的除根数外的所有形态指标,SD处理(SD45)的所有形态指标均显著低于对照(表1)。中度和重度干旱胁迫处理15 d后复水15 d(MD15+RW15和SD15+RW15),侧芽数和总叶面积指标能够恢复到对照水平;而仅中度干旱胁迫处理30 d后复水15 d(MD30+RW15),侧芽数指标能够恢复到对照水平(表1)。
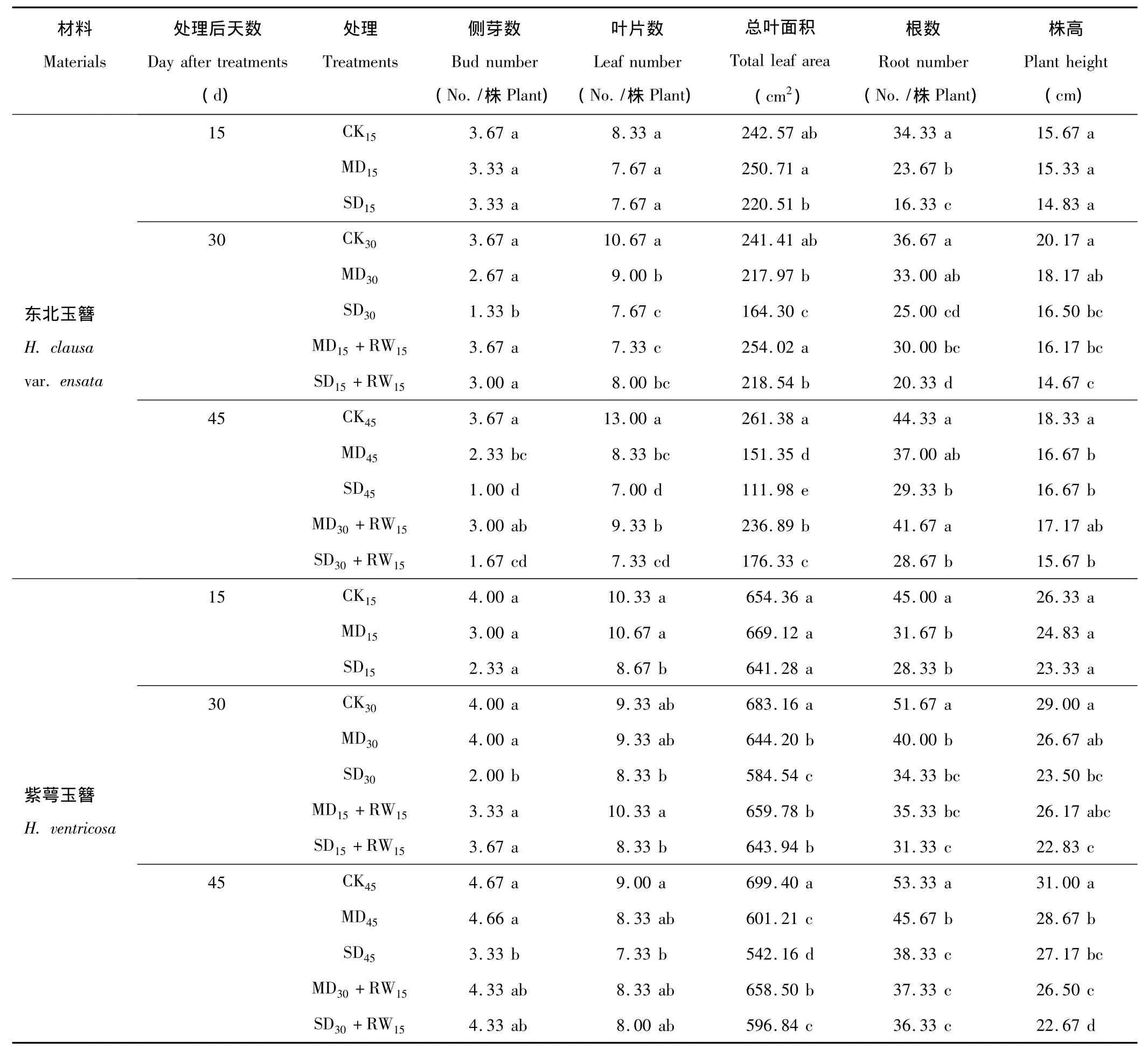
表1 干旱胁迫及复水后东北玉簪和紫萼玉簪形态指标的变化Table 1 The changes of morphologic index of H.clausa var.ensata and H.ventricosa after drought stress and rewatering
干旱胁迫对紫萼玉簪形态指标的影响与对东北玉簪的影响相似,亦表现出随干旱胁迫时间的延长,干旱处理对不同形态指标的抑制作用增大的现象。干旱胁迫处理后15 d,MD处理(MD15)的根数,SD处理(SD15)的叶片数和根数显著低于对照;干旱胁迫处理后30 d,MD处理(MD30)的总叶面积和根数,SD处理(SD30)的侧芽数、总叶面积、根数和株高均显著低于对照;干旱胁迫处理后45 d,MD处理(MD45)的总叶面积、根数和株高,SD处理(SD45)的所有形态指标均显著低于对照(表1)。重度干旱胁迫处理15 d后复水15 d(SD15+RW15),侧芽数和总叶面积指标能够得到不同程度的恢复;中度干旱胁迫处理30 d后复水15 d(MD30+RW15),总叶面积指标能够得到部分恢复,重度干旱胁迫处理30 d后复水15 d(SD30+RW15),侧芽数和总叶面积指标能够得到部分恢复(表1)。
2.3 干旱胁迫及复水对2种玉簪叶绿素含量的影响
对于东北玉簪,干旱胁迫处理后15和30 d,仅SD处理(SD15和SD30)的总叶绿素[Chl(a+b)]含量显著低于对照,随着干旱胁迫时间的延长,即干旱胁迫处理后45 d,MD处理(MD45)和SD处理(SD45)的Chl(a+b)含量均显著低于对照(图2A)。中度和重度干旱胁迫处理30 d后复水15 d(MD30+RW15和SD30+RW15),Chl(a+b)含量指标能够得到一定程度的恢复(图2A)。干旱胁迫处理后的各个时期Chla含量的变化规律与Chl(a+b)含量一致,表明干旱胁迫及胁迫后复水对东北玉簪Chl(a+b)含量的影响主要是对Chla含量的影响。
对于紫萼玉簪,从干旱胁迫处理后15 d,MD和SD处理的Chl(a+b)含量即显著低于对照;但干旱胁迫处理后45 d,仅SD处理(SD45)的Chl(a+b)含量显著低于对照(图2B)。且重度干旱胁迫处理30 d后复水15 d(SD30+RW15),Chl(a+b)指标能够恢复到对照水平(图2B)。干旱胁迫及胁迫后复水对紫萼玉簪Chl(a+b)含量的影响亦主要是对Chla含量的影响。
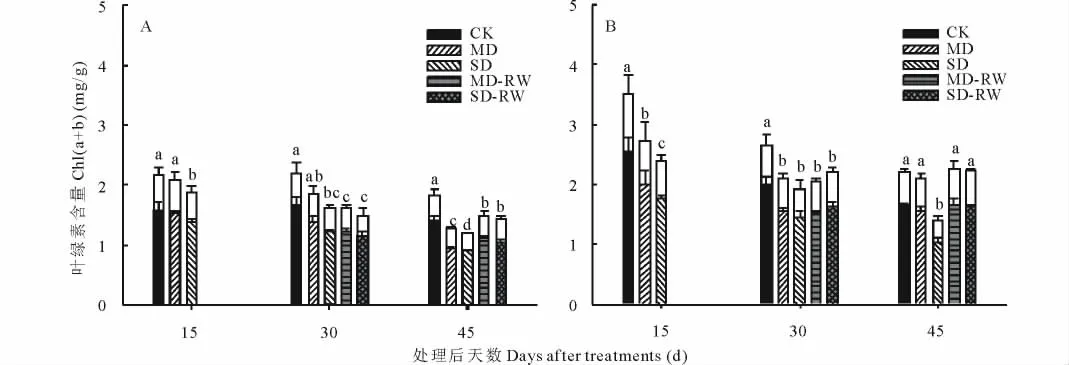
图2 干旱胁迫及复水后东北玉簪(A)和紫萼玉簪(B)叶绿素含量的变化F ig.2 The changes of chlorophyll contents of H.clausa var.ensata(A)and H.ventricosa(B)after drought stress and rewatering
2.4 干旱胁迫及复水对2种玉簪气体交换参数的影响
对于东北玉簪,MD和SD处理的净光合速率(Pn)随干旱胁迫时间的延长急剧下降,且从干旱胁迫处理后15 d开始显著低于对照;干旱胁迫处理后30和45 d,SD处理显著低于MD处理。中度和重度干旱胁迫处理15 d后复水15 d(MD15+RW15和SD15+RW15),Pn恢复到对照水平;中度和重度干旱胁迫处理30 d后复水15 d(MD30+RW15和SD30+RW15),Pn亦能够得到部分恢复,且MD30+RW15能够恢复到与对照相同的水平(图3A)。
干旱胁迫及胁迫后复水对东北玉簪气孔导度(Gs)的影响与对Pn的影响基本一致(图3B)。
MD处理的蒸腾速率(Tr)从干旱胁迫处理后30 d开始显著低于对照,SD处理的Tr从干旱胁迫处理后15 d开始显著低于对照;且在干旱胁迫处理后30和45 d,SD处理显著低于MD处理。中度和重度干旱胁迫处理15 d后复水15 d(MD15+RW15和SD15+RW15),Tr能够得到有效恢复而且均显著高于对照;中度和重度干旱胁迫处理30 d后复水15 d(MD30+RW15和SD30+RW15),Tr均能够恢复到与对照相同的水平(图3C)。
MD和SD处理的胞间CO2浓度(Ci)在所测试期间无显著差异,且从干旱胁迫处理后30 d开始显著低于对照。中度和重度干旱胁迫处理15 d后复水15 d(MD15+RW15和SD15+RW15)和干旱胁迫处理30 d后复水15 d(MD30+RW15和SD30+RW15),Ci均能够恢复到与对照相同的水平(图3D)。
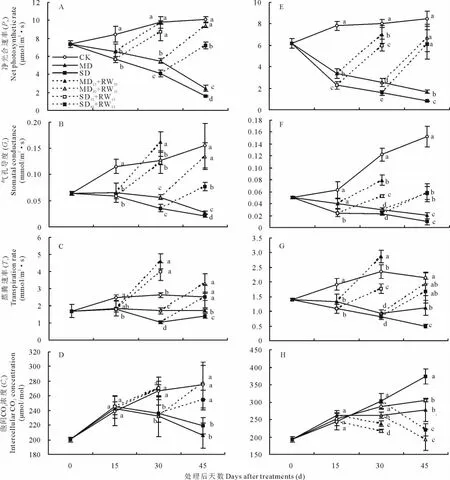
图3 干旱胁迫及复水后东北玉簪(A~D)和紫萼玉簪(E~H)气体交换参数的变化Fig.3 The changes of gas exchange parameters of H.clausa var.ensata(A -D)and H.ventricosa(E-H)after drought stress and rewatering
干旱胁迫及胁迫后复水对紫萼玉簪Pn、Gs和Tr的影响与对东北玉簪的影响一致,只是胁迫后复水15 d恢复的程度比东北玉簪小一些(图3D~图3G)。干旱胁迫及胁迫后复水对紫萼玉簪Ci的影响与对东北玉簪的影响不同。MD处理的Ci仅在干旱胁迫处理后30 d显著低于对照;而SD处理的Ci却在干旱胁迫处理后45 d显著高于对照。中度和重度干旱胁迫处理15 d后复水15 d(MD15+RW15和SD15+RW15)和干旱胁迫处理30 d后复水15 d(MD30+RW15和SD30+RW15)均显著降低了Ci(图3H)。
2.5 干旱胁迫及复水对2种玉簪叶绿素荧光参数的影响
对于东北玉簪,MD和SD处理能够显著降低干旱胁迫处理后15 d的Fv/Fm、ΦPSII,干旱胁迫处理后30 d的Fv/Fm、ΦPSII和qP,以及干旱胁迫处理后45 d的Fv/Fm、Fv'/Fm'和ΦPSII;显著提高干旱胁迫处理后30和45 d的NPQ。其中SD处理在干旱胁迫处理后45 d的Fv/Fm显著低于MD处理。中度和重度干旱胁迫处理15或30 d后复水 15 d(MD15+RW15、SD15+RW15、MD30+RW15和 SD30+RW15),Fv/Fm、Fv'/Fm'、ΦPSII、qP 和 NPQ 指标均能够得到不同程度的恢复。其中重度干旱胁迫处理15或30 d后复水15 d(SD15+RW15和SD30+RW15),不能够将干旱所造成的Fv/Fm降低恢复到与对照相同的水平(图4A~图4E)。
干旱胁迫及胁迫后复水对紫萼玉簪Fv/Fm、Fv'/Fm'、ΦPSII、qP和NPQ的影响与对东北玉簪的影响一致(图4F~图4J)。
3 讨论与结论
本研究结果表明,短期(15 d)中度干旱胁迫(MD:土壤相对含水量为50% ~55%)和重度干旱胁迫(SD:土壤相对含水量为30%~35%)能够促进东北玉簪的生物量分配向地下部生长和干物质量的积累。而随干旱胁迫时间的延长MD和SD处理对地上部和地下部干物质量增长的抑制作用逐渐显现:处理后30 d,SD处理显著低于对照;处理后45 d,SD处理显著低于MD处理,MD处理显著低于对照。干旱胁迫处理15 d后复水15 d(MD15+RW15和SD15+RW15),地上部和地下部干物质量能够得到有效恢复。而延长干旱胁迫处理30 d后再复水15 d(MD30+RW15和SD30+RW15),地上部干物质量无法得到有效恢复,仅地下部干物质量得到部分恢复(图1A和图1B)。干旱胁迫对紫萼玉簪干物质量的影响与对东北玉簪的影响相似,但无论MD处理还是SD处理30 d后复水15 d,地上部和地下部干物质量均无法得到有效恢复(图1C和图1D)。上述结果表明,东北玉簪和紫萼玉簪都具有一定的抗短期干旱的能力;短期干旱胁迫后复水能够部分或全部恢复干旱所造成的干物质量的损失;具有走茎的小型玉簪(东北玉簪)抗旱能力强于无走茎大型玉簪(紫萼玉簪)。
干旱胁迫45 d未对2种玉簪造成致死性伤害,但随着干旱程度的加重(胁迫时间延长或由中度干旱胁迫到重度干旱胁迫),干旱处理对玉簪不同形态指标的抑制作用逐渐加大。干旱胁迫处理后15 d,2种玉簪主要表现为根数的减少;干旱胁迫处理后30 d,MD处理的部分指标(东北玉簪的叶片数、紫萼玉簪的总叶面积和根数)显著低于对照,而SD处理的所测指标均显著低于对照;干旱胁迫处理后45 d,MD处理和SD处理的所测形态指标均低于或显著低于对照。此外,中度和重度干旱胁迫处理15或30 d后复水15 d主要表现为侧芽数、叶片数和总叶面积的部分或全部恢复(表1)。
干旱胁迫导致植物叶片失水,进而影响叶绿素的生物合成,并促进已合成的叶绿素分解。本研究结果表明:中度和重度干旱胁迫处理能够降低或显著降低2种玉簪的总叶绿素[Chl(a+b)]含量;而中度和重度干旱胁迫处理30 d后复水15 d(MD30+RW15和SD30+RW15),Chl(a+b)含量能够得到部分或全部恢复(图2A和图2B)。且干旱胁迫及胁迫后复水对2种玉簪Chl(a+b)含量的影响主要是通过对Chla含量的影响实现。
干旱胁迫下植物叶片的光合速率降低是所有植物的共同现象[16]。2种玉簪均表现出,MD和SD处理的净光合速率(Pn)随干旱胁迫时间的延长急剧下降,且从干旱胁迫处理后15 d开始显著低于对照的结果(图3A和图3E)。干旱胁迫导致Pn下降的主要原因即可能是气孔限制(stomatal limitations),也可能是非气孔限制(non-stomatal limitations)。Farquhar和Sharkey[17]提出检查气孔限制是否为Pn下降原因的判断方法:看Gs和Ci的变化趋势是否一致,Gs降低而Ci升高或不变为非气孔限制;Gs降低伴随着Ci降低为气孔限制。本研究结果表明,干旱胁迫对2种玉簪Gs与对Pn的影响基本一致(图3B和图3F)。而对2种玉簪Ci的影响不同,对于东北玉簪MD和SD处理Ci在所测试期间无显著差异,且从干旱胁迫处理后30 d开始显著低于对照;而对于紫萼玉簪MD处理的Ci仅在干旱胁迫处理后30 d显著低于对照;而SD处理的Ci却在干旱胁迫处理后45 d显著高于对照。上述结果表明,中度和重度干旱胁迫处理致东北玉簪Pn的降低主要是由气孔限制引起;中度干旱胁迫处理致紫萼玉簪Pn的降低主要是由气孔限制引起,而重度干旱胁迫处理致紫萼玉簪Pn的降低主要是由非气孔限制引起。此外,中度和重度干旱胁迫处理15或30 d后复水15 d(MD15+RW15、SD15+RW15、MD30+RW15和SD30+RW15),2种玉簪Pn、Gs和Tr能够得到恢复或部分恢复(图3A~图3C和图3E~图3G)。而对于东北玉簪复水处理能够显著提高Ci,使Ci恢复到与对照相同的水平(图3D);对于紫萼玉簪复水处理却显著降低了Ci(图3H)。
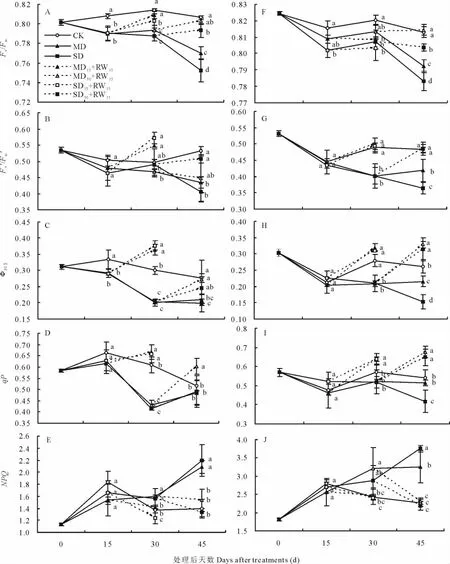
图4 干旱胁迫及复水后东北玉簪(A~E)和紫萼玉簪(F~J)叶绿素荧光参数的变化Fig.4 The changes of chlorophyll fluorescence parameters of H.clausa var.ensata(A -E)and H.ventricosa(F-J)after drought stress and rewatering
对于植物的光合作用机理及植物对环境响应机理的研究,叶绿素荧光参数分析是一种反应灵敏、操作简便且对植物无侵扰的方法[18]。Fv/Fm反映PSII原初光能转化效率及PSII潜在活性,非逆境条件下植物的Fv/Fm一般为0.75~0.85[19-20],在逆境条件下或受到伤害时Fv/Fm会显著降低[21],Fv/Fm的变化可以用来鉴别植物对干旱的耐受能力。Fv'/Fm'反映光下开放的(open)PSII反应中心的激发能捕获效率,ΦPSII反映光下PSII实际的光化学量子效率,与净光合速率显著正相关,在一定程度上能够代表净光合速率的变化[22]。qP代表光系统Ⅱ反应中心开放部分的比例[23],较高的qP有利于光系统Ⅱ反应中心的电荷分离和电子传递[24]。NPQ反映出了光合器官的一种自我保护机制,通过重新构建跨类囊体的质子浓度梯度来防止过度激发PSII反应中心[25]。MD和SD处理能够显著降低2种玉簪干旱胁迫处理后30~45 d的Fv/Fm、Fv'/Fm'、ΦPSII和qP;而且显著提高同时期的NPQ,表明干旱胁迫使2种玉簪的光合作用原初反应过程受到部分破坏,并造成了PSII的结构性伤害。此外,中度和重度干旱胁迫处理15或30 d后复水15 d,Fv/Fm、Fv'/Fm'、ΦPSII、qP和NPQ均能够得到有效恢复(图4A~图4J),表明30 d的干旱胁迫未造成光合细胞器的不可逆损伤。而干旱胁迫及复水对玉簪属植物生长和光合作用的影响机制尚需进一步补充分子证据来揭示。
[1]田其云,曹艳英.我国干旱半干旱地区治理环境资源问题的技术规范探讨[J].干旱区资源与环境,2005,19(3):98-103.
[2]Sam J C.In Hosta heaven[J].American Nurseryman,1990,10:121-135.
[3]Zhang J Z,Wang W,Sun G F,et al.Photosynthesis of Hosta under light and controlled release nitrogen fertilizer[J].Russian Journal of Plant Physiology,2011,58(2):261-270.
[4]Liu F.Biomass partitioning,specific leaf area,and water use efficiency of vegetable amaranth(Amaranthus spp.)in response to drought stress[J].Scientia Horticulturae,2004,102(1):15-27.
[5]任庆成,杨铁钊,刘培玉,等.植物抗旱性研究进展[J].中国农学通报,2009,25(15):76-79.
[6]崔秀妹,刘信宝,李志华,等.不同水分胁迫下水杨酸对分枝期扁蓿豆生长及光合生理的影响[J].草业学报,2012,21(6):82-93.
[7]温翠平,李威,漆智平,等.水分胁迫对王草生长的影响[J].草业学报,2012,21(4):72-78.
[8]Dai Y J,Shen Z G,Liu Y,et al.Effects of shade treatments on the photosynthetic capacity,chlorophyll fluorescence,and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg[J].Environmental and Experimental Botany,2009,65(2-3):177-182.
[9]关义新,戴俊英,林艳.水分胁迫下植物叶片光合的气孔和非气孔限制[J].植物生理学通讯,1995,31(4):293-297.
[10]姚庆群,谢贵水.干旱胁迫下光合作用的气孔与非气孔限制[J].热带农业科学,2005,25(4):80-85.
[11]宋家壮,李萍萍,付为国.水分胁迫及复水对虉草生理生化特性的影响[J].草业学报,2012,21(2):62-69.
[12]张起源.水分胁迫对2种玉簪生长及光合特性的影响[D].长春:吉林农业大学,2011.
[13]肖强,叶文景,朱珠,等.利用数码相机和Photoshop软件非破坏性测定叶面积的简便方法[J].生态学杂志,2005,24(6):711-714.
[14]Arnon D I.Copper enzymes in isolated chloroplasts:Polyphenooxidase in Beta vulgaris[J].Plant Physiology,1949,24:1-15.
[15]王巍,董然,李晓东,等.控释氮肥对紫萼玉簪生长和光合特性的影响植物研究[J].植物研究,2009,29(5):544-548.
[16]Zhang J Z,Shi L,Shi A P.Photosynthetic responses of four Hosta cultivars to shade treatment[J].Photosynthetica,2004,42(2):213-218.
[17]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(3):317-345.
[18]Schreiber U,Bilger W,Neubauer C.Chlorophyll florescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[J].Ecological Studies,1995,100:49-70.
[19]Csintalan Z,Proctor M C F,Tuba Z.Chlorophyll fluorescence during drying and rehydration in the mosses Rhytidiadelphus loreus(Hedw.)Warnst.,Anomodon viticulosus(Hedw.)Hook.& Tayl.and Grimmia pulvinata(Hedw.)Sm[J].Annals of Botany,1999,84:235-244.
[20]何炎红,郭连生,田有亮.白刺叶不同水分状况下光合速率及其叶绿素荧光特性的研究[J].西北植物学报,2005,25(11):2226-2233.
[21]许大全,张玉忠,张荣铣.植物光合作用的光抑制[J].植物生理学通讯,1992,28(4):237-243.
[22]Fryer M J,Andrews J R,Oxborough K,et al.Relationship between CO2assimilation,photosynthetic electron transport,and active O2metabolism in leaves of maize in the field during periods of low temperature[J].Plant Physiology,1998,116:571-580.
[23]Maxwell K,Johnson G N.Chlorophyll fluorescence-a practical guide[J].Journal of Experimental Botany,2000,51(345):659-668.
[24]Dias P C,Araujo W L,Moraes G A B K,et al.Morphological and physiological responses of two coffee progenies to soilwater availability[J].Journal of Plant Physiology,2007,164(12):1639-1647.
[25]Ivanov B,Edwards G.Influence of ascorbate and the Mehler peroxidase reaction on non-photochemical quenching of chlorophyll fluorescence in maize mesophyll chloroplasts[J].Planta,2000,210(5):765-774.
