大明竹属部分植物ISSR-PCR反应体系优化及有效引物筛选
2013-12-24黄树军肖永太荣俊冬何天友陈凌艳郑郁善
黄树军,黄 婷,肖永太,荣俊冬,杨 阳,何天友,陈凌艳,郑郁善,
(1.福建农林大学林学院;2.福建农林大学园林学院,福建 福州350002)
大明竹属(Pleioblastus)植物隶属竹亚科(Bambusoideae),我国有20余种,多分布于长江中下游各地,分布零散[1].该属竹子形态优美,生态净化能力强,为庭园景观绿化的优良植物.
竹类植物的生长发育规律都较为特殊,以花、果实等形态为主的传统植物分类方法对竹子进行分类较为复杂、困难,竹子分类不一[2-4],学术上颇有争议[5].随着现代分子生物技术的飞速发展,分子标记技术在竹子分类及遗传多样性研究方面得到了广泛应用[6-11],从分子水平上辅助分类[12],有助于解决分类争议,对鉴定种质资源起重要作用.简单重复序列间扩增(inter simple sequence repeats,ISSR)是由Zietkiewicz提出,具有较好的稳定性及多态性[13].近年来,ISSR技术对竹类植物的研究报道较多,但关于大明竹属植物的相关报道不多.目前大明竹属部分植物的分类还存在争议[14],运用生物技术对大明竹属植物的种间亲缘关系的研究报道较少.利用ISSR技术可对大明竹属植物的遗传多样性进行研究.ISSR技术基于PCR的扩增,该扩增体系受诸多因素的影响[15].为了确定ISSR分析的可靠性,对ISSR-PCR反应体系及扩增程序优化选择是极有必要的.本试验利用单因素试验方法对大明竹属部分植物的反应体系进行了优化,建立了适合大明竹属植物的PCR反应体系及扩增程序,并筛选了18条对大明竹属植物有效的引物,旨在为大明竹属植物的遗传多样性及鉴定分类等方面研究提供参考.
1 材料与方法
1.1 材料
1.1.1 样品来源 选取栽植于福建农林大学百竹园大明竹属25个竹种(表1)的嫩叶,每个品种取3-5株,用冰壶及变色硅胶迅速干燥,并在-80℃的低温下保存,以备提取DNA.

表1 大明竹属25个竹种的情况Table 1 The 25 species of Pleioblastus in the present study
1.1.2 仪器 主要仪器有LabCycler PCR仪、DYY-8C电泳仪、DYCP-31DN电泳槽、JS-680全自动数码凝胶成像分析仪等.
1.1.3 试剂 10 × PCR Buffer、Taq DNA 聚合酶、RNA 酶、DNA Ladder Marker、dNTPs Mixture、MgCl2、100条随机引物(哥伦比亚大学公布)、琼脂糖等购于上海生工生物工程技术服务有限公司;核酸染料Gold View购于上海赛百盛公司;液氮购于福州市第二化工厂;硼酸、无水乙醇、溴酚蓝、三羟基氨基甲烷、乙二胺四乙酸二钠、蔗糖均为国产分析纯.
1.2 基因组DNA的提取
大明竹属植物基因组DNA采用杭州博日公司Biospin植物基因组DNA提取试剂盒(Cat#BSCl3S1)提取[16-17],所提取的DNA的完整性、浓度、纯度经电泳及紫外分光光度计测定,满足试验要求,并保存于-20℃的冰箱中供ISSR分析.
1.3 ISSR反应体系及扩增程序的建立及优化
1.3.1 ISSR-PCR原初体系及扩增程序的建立 参考孙志娟等[18]的方法,将PCR反应体积设定为20 μL,含 40 ng 模板 DNA、0.5 μmol·L-1引物、0.5 mmol·L-1dNTPs、2 μL 10 × PCR Buffer、1.0 U Taq DNA 聚合酶、2.0 mmol·L-1Mg2+.筛选时所应用的扩增程序固定为:94℃预变性5 min;94℃变性30 s,55℃复性30 s,72℃延伸90 s,循环40次;72℃延伸7 min,4℃保存.
1.3.2 ISSR-PCR反应体系的优化 以大明竹属25个竹种的DNA样品为模板,利用UBC811引物在Lab-Cycler PCR仪上筛选ISSR扩增体系.以建立的ISSR-PCR原初体系为基础,设计不同浓度(用量)的Mg2+、Taq DNA聚合酶、引物、dNTPs、模板DNA(表2),每次扩增改变其中的某一因子,研究此因子对ISSR扩增反应的影响,确定各因子浓度(用量)并综合检验体系的扩增效果.
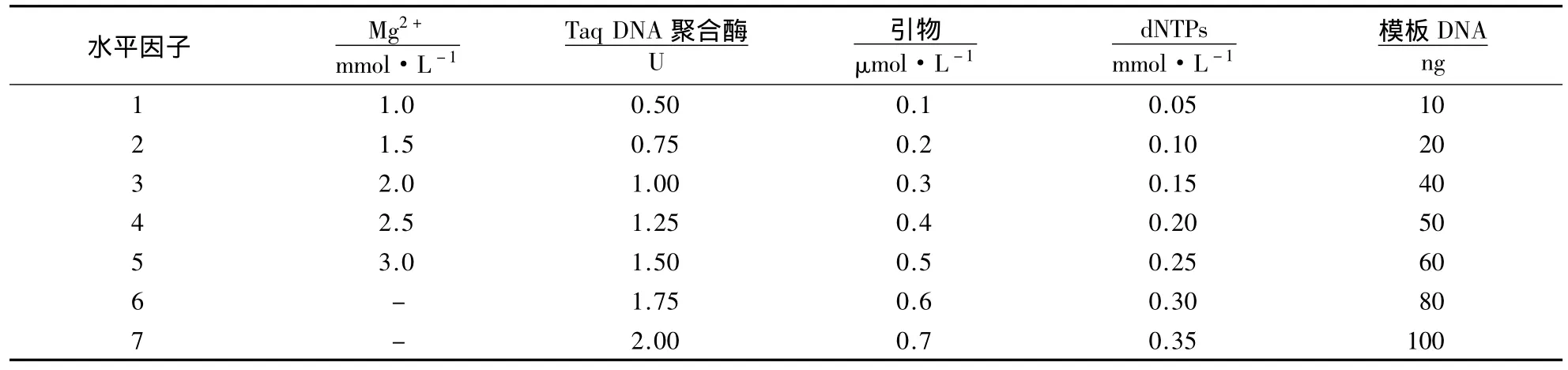
表2 ISSR扩增体系筛选1)Table 2 Design of optimal ISSR reaction system
1.4 ISSR有效引物的筛选及反应体系的检验
用100条随机引物对任意一份DNA样品进行PCR扩增,在已优化的反应体系及扩增程序下进行.对扩增产物进行电泳,并于凝胶成像分析仪上观察拍照,筛选有效的ISSR引物.有效引物需符合如下条件:(1)条带清晰,不模糊,不弥散;(2)空白中无或少假带;(3)对所有样品均有质量好的条带.以大明竹属25个竹种提取的DNA作为模版,用筛选过的ISSR引物在已优化的反应体系及扩增程序下进行PCR扩增,检验其效果及重复性.
1.5 ISSR有效引物退火温度的确定
对筛选过的随机引物,依据Tm=2×(A+T)-4×(C+G)确定引物的理论退火温度.式中,Tm表示DNA的溶解温度,A表示腺嘌呤个数,T表示胸腺嘧啶个数,C表示胞嘧啶个数,G表示鸟嘌呤个数.在比引物Tm低5℃的基础上,设置6个退火温度梯度,在已优化的反应体系及扩增程序下进行PCR扩增,确定引物的最佳退火温度.
2 结果与分析
2.1 ISSR反应体系的建立
2.1.1 扩增程序的优化 PCR扩增程序分为变性、复性和延伸3个阶段,对扩增时间、温度及循环次数进行优化.不同物种的变性和延伸温度一般差别不大,变性温度为94-95℃,延伸温度为72℃;复性温度是影响特异性的重要因子;循环次数对扩增量也有影响,一般在35-40个循环.经过UBC811引物的初步筛选,在原扩增程序的基础上确定大明竹属植物的扩增程序为:94℃预变性5 min;94℃变性60 s,55℃复性45 s,72℃延伸90 s,循环40次;72℃延伸7 min,4℃保存.
2.1.2 Mg2+浓度的确定 Mg2+是Taq DNA聚合酶维持活性的重要因素.Mg2+浓度不但对酶活性和忠实性有影响,还影响产物的特异性、产物与模板的解链温度、引物退火、引物二聚体形成等.若Mg2+浓度过高会增加非特异性扩增产物,使条带模糊;若Mg2+浓度过低则Taq DNA聚合酶的扩增效率较低,扩增产物就少.从图1可以看出:Mg2+浓度为2.0和2.5 mmol·L-1时可扩增出较清晰的条带,其中以2.5 mmol·L-1扩增的条带多态性和亮度最好;当Mg2+浓度大于或小于2.5 mmol·L-1时,条带的多态性和清晰度均较差.可见,Mg2+浓度对扩增结果有较大的影响,对PCR扩增极为重要.
2.1.3 Taq DNA聚合酶用量的确定 Taq DNA聚合酶的作用是将dNTPs添加到双链DNA引物链上,使聚合形成新DNA链.Taq DNA聚合酶的用量由酶活性、反应体积、酶耐热性等因素决定.若Taq DNA聚合酶用量过高,容易造成非特异性扩增[1],过低则造成扩增产物少.从图2可以看出,Taq DNA聚合酶用量低于1.0 U时,其扩增强度弱,而0.5 U的用量则没有扩增结果.这可能是由于Mg2+浓度固定时,Taq DNA聚合酶的减少会使Mg2+对酶的激活能力相对减弱,导致扩增量下降.当Taq DNA聚合酶用量为1.0 U时,扩增条带最多;当用量大于1.0 U时,条带变少,造成了非特异性扩增.可见,Taq DNA聚合酶的用量以1.0 U为宜.
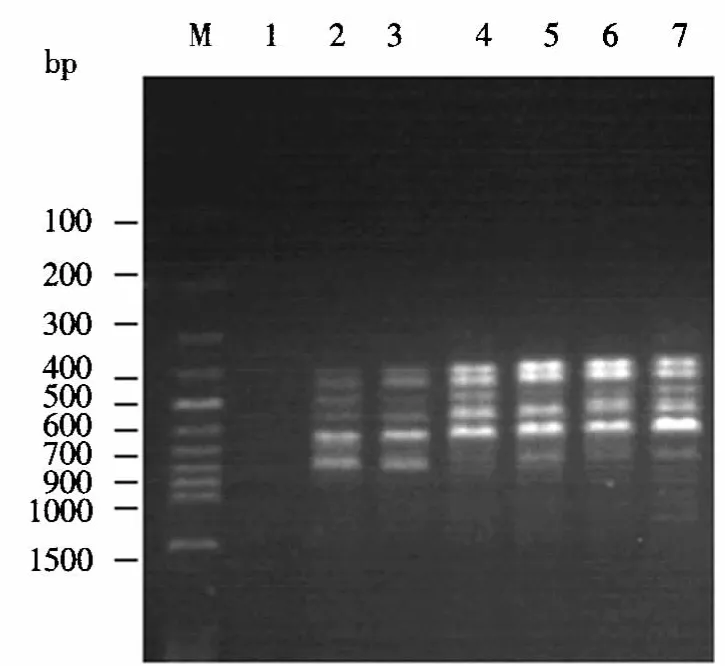
图1 Mg2+浓度对ISSR扩增的影响Fig.1 The effect of concentration of Mg2+on the amplification of ISSR
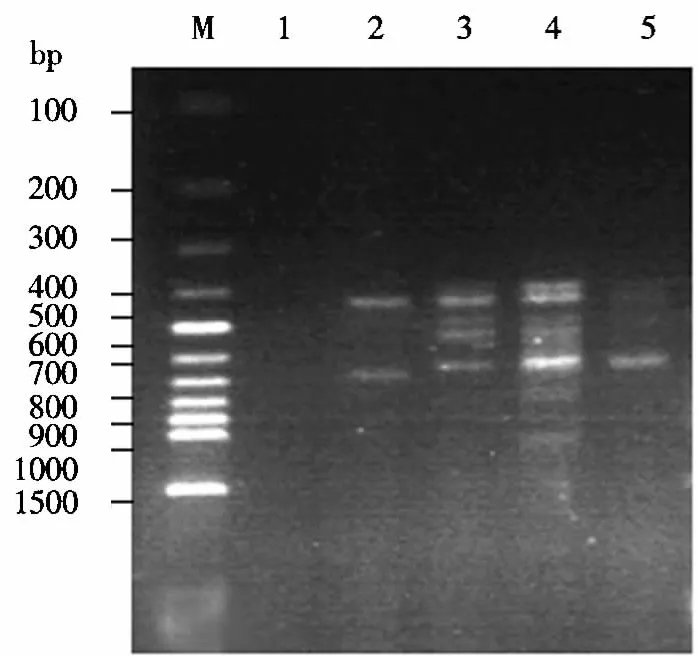
图2 Taq DNA聚合酶用量对ISSR扩增的影响Fig.2 The effect of concentration of Taq DNA polymerases on the amplification of lSSR
2.1.4 dNTPs浓度的确定 dNTPs是PCR扩增的底物,dNTPs浓度对扩增条带的数量及亮度存在较大影响.dNTPs浓度过低会导致引物与底物的酶促反应速度下降,扩增量减少;dNTPs浓度过高,一方面会与Mg2+发生鳌合,使Mg2+浓度降低,从而影响Taq DNA聚合酶的活性,另一方面会导致碱基错配,降低产物的特异性.因此,确定dNTPs的浓度是非常重要的.图3表明:dNTPs浓度为0.15 mmol·L-1时,扩增条带清晰且带数多,效果最好;浓度高于0.15 mmol·L-1时,扩增条带则变浅,部分条带消失,这可能是由于抑制了Taq DNA聚合酶的活性从而影响了扩增效果;浓度低于0.15 mmol·L-1时,扩增条带数变少,且呈弥散状,这可能是由于Mg2+不能有效激活Taq DNA聚合酶,导致扩增量减少.可见,dNTPs浓度以0.15 mmol·L-1为宜.
2.1.5 引物浓度的确定 引物浓度偏高时容易导致引物之间形成二聚体,还容易引起非特异性扩增及错配,同时引物之间会产生竞争,使扩增量大幅下降;引物浓度过低时,引物与模板DNA结合的机率降低,反应提前结束,使扩增条带变浅甚至没有条带.图4表明:引物浓度为0.1和0.2 μmol·L-1时,没有出现扩增条带;浓度为 0.3 和 0.4 μmol·L-1时出现不清晰条带;当浓度大于 0.5 μmol·L-1时,条带很亮但背景模糊,这可能由非特异性扩增导致.经综合考虑,引物浓度以0.5 μmol·L-1为宜.

图3 dNTPs浓度对ISSR扩增的影响Fig.3 The effect of concentration of dNTP on the amplification of lSSR
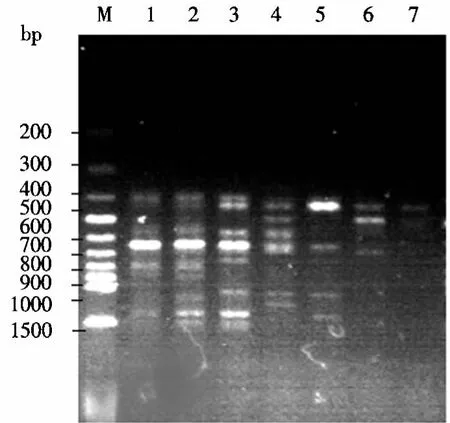
图4 引物浓度对ISSR扩增的影响Fig.4 The effect of concentration of primer on the amplification of lSSR
2.1.6 模板DNA用量的确定 PCR扩增对模板DNA用量及纯度的要求不高,仅2个拷贝模板或细胞粗提物即可进行PCR扩增.但为了确保扩增效率及特异性,仍需一定量的模板DNA,以避免交叉污染导致反应失败.图5表明,模板DNA用量为10-100 ng时,条带的清晰度相似,表明模板DNA用量对扩增效果的影响较小,较大范围的用量均能扩增出清晰条带.但当模板DNA用量不足时,会降低扩增效率,引物与模板有效配对较难;若模板DNA用量太大,引物耗尽过早,会造成退火发生在PCR产物3'端与模板间或产物间,导致延伸中止,条带呈弥散状.根据图5中条带的清晰度,模板DNA用量以50 ng为宜.
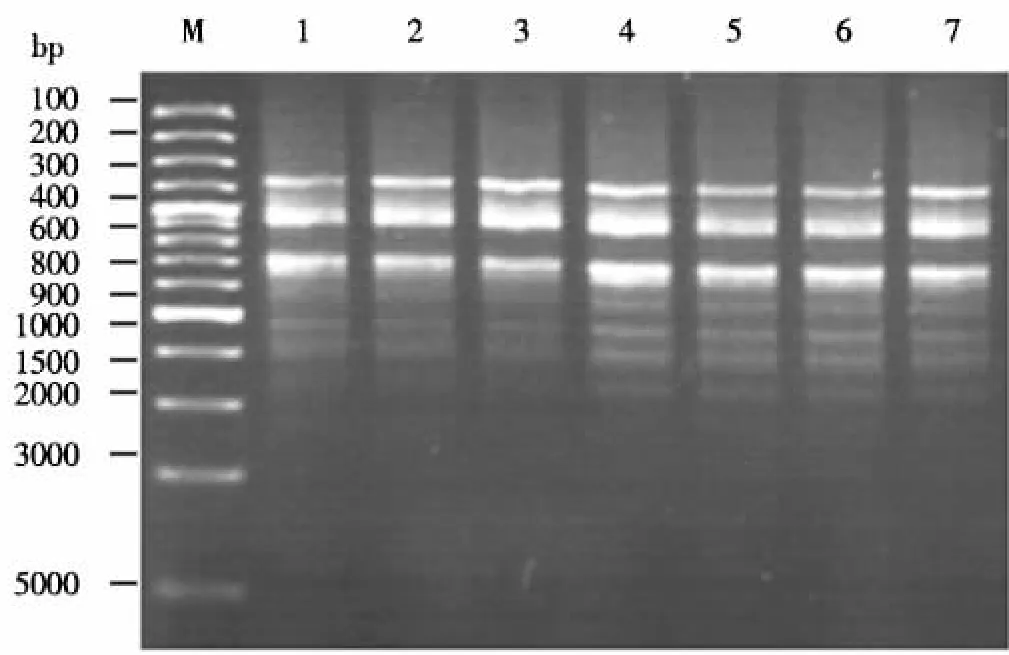
图5 模板DNA用量对ISSR扩增影响Fig.5 The effect of concentration of DNA template on the amplification of lSSR
2.1.7 ISSR-PCR反应体系各因子的终浓度(用量) 采用单因素试验方法,对影响PCR扩增的5个因子进行优化并检验,最终确立大明竹属植物 20 μL 反应体系含 50 ng模板 DNA、0.5 μmol·L-1引物、0.15 mmol·L-1dNTPs、2 μL 10 × PCR Buffer、1.0 U Taq DNA 聚合酶、2.5 mmol·L-1Mg2+.
2.2 有效引物的筛选
利用已优化的大明竹属植物ISSR-PCR反应体系及扩增程序,对选取的100条随机引物进行筛选(图6),最终筛选出18条条带清晰、多态性丰富且重复性高的有效引物(表3).
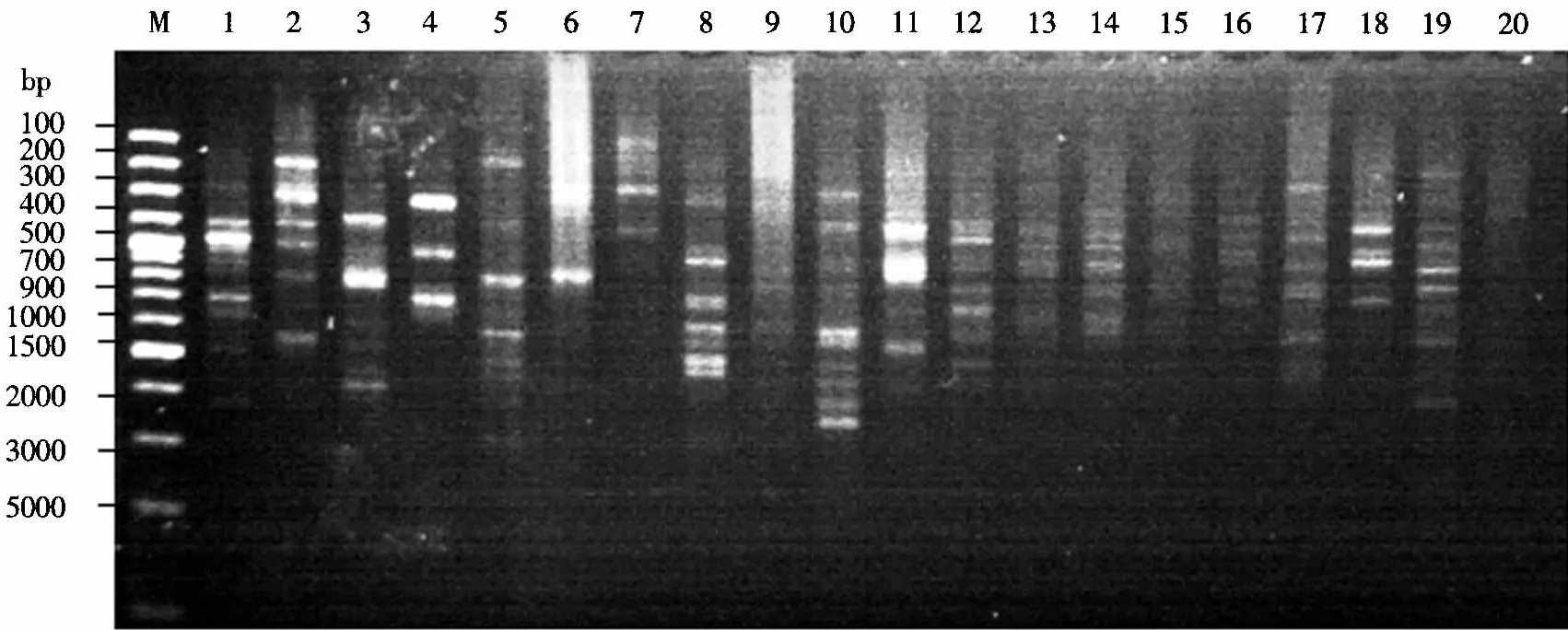
图6 大明竹属植物部分引物的ISSR扩增电泳图谱Fig.6 Electrophoretogram of ISSR amplification of some primers in Pleioblastus
2.3 退火温度的确定
退火温度会影响扩增条带的带谱,与引物及物种的序列相关[19].退火温度一般设定比引物的理论退火温度低5℃,然后以2℃的幅度逐级增大.退火温度较高时会影响引物二聚体和非特异性产物的形成,可在设定的较高退火温度下先进行5个循环,再在较低的温度下进行余下循环来提高产物的特异性.ISSR引物对退火温度的要求严格,每一条引物的退火温度不尽相同.退火温度越高,产物的特异性就越高,但扩增量就会减少;反之,温度越低,则扩增量越高,但容易引起引物与模板错配.根据上述规律,确定已筛选的18条ISSR引物的最适退火温度为49.2-55.2℃(表3).
2.4 ISSR有效引物及优化体系的检验
以大明竹属25个竹种的DNA为模版,用筛选过的ISSR引物在已优化的反应体系及扩增程序下进行PCR扩增,扩增条带清晰度高、多态性丰富、重复性高(图7).
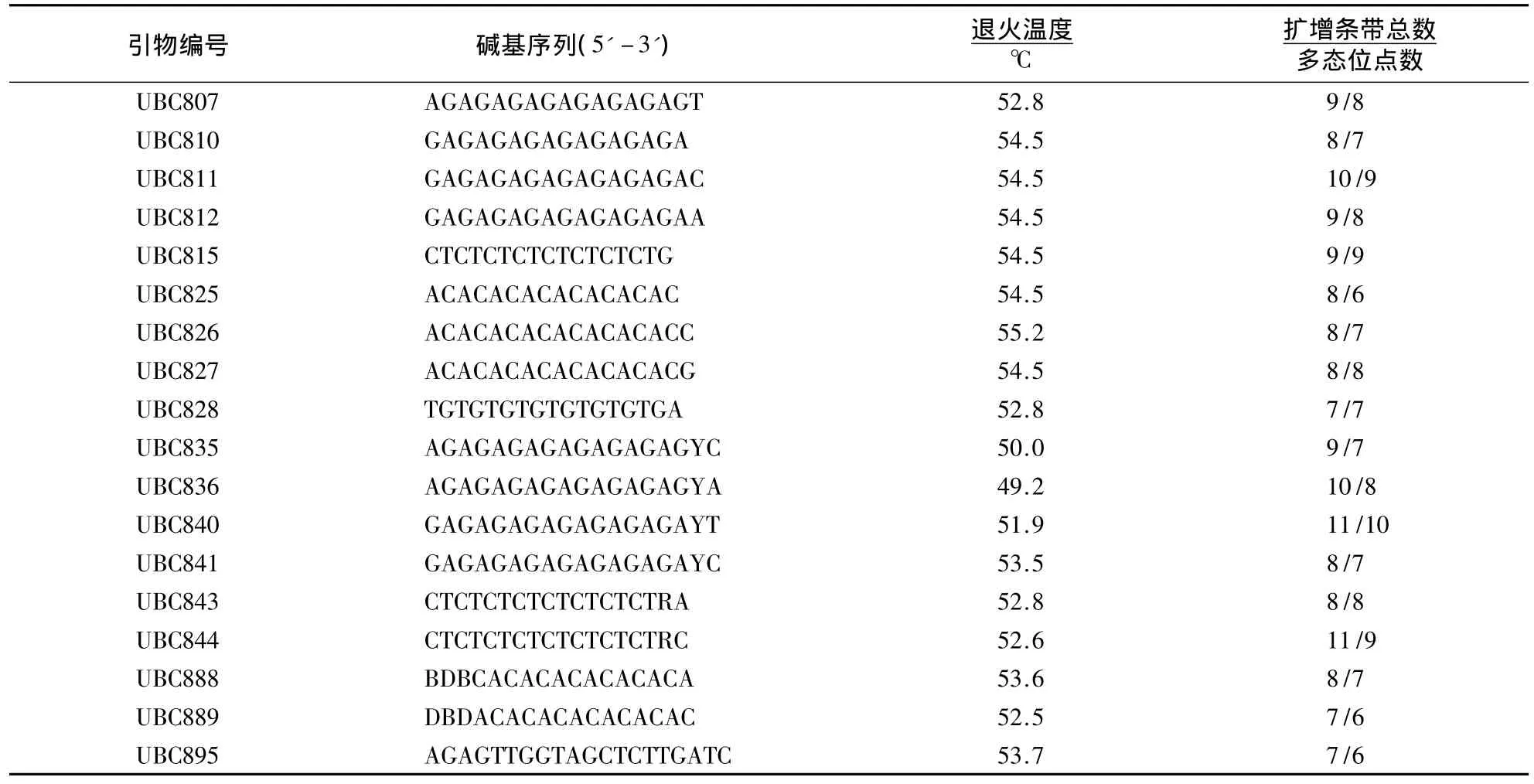
表3 大明竹属植物的ISSR有效引物Table 3 The sequence of ISSR primers in Pleioblastus
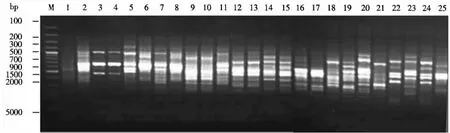
图7 引物UBC840对大明竹属植物的ISSR扩增电泳图谱Fig.7 The electrophoretogram of ISSR amplification by primer UBC840 for Pleioblastus
3 讨论与结论
影响PCR扩增的因素很多,有效性、特异性及忠实性为检验扩增效果的指标,但高特异性的影响因子可能与高扩增量的影响因子存在差异,因此在建立PCR反应体系时,需要确定哪些参数指标最重要,并据此优化反应条件.在PCR反应体系的建立及优化中,单因素试验方法得到了广泛的应用[20-21],但因单因素试验没有考虑各因子的交互作用,因此略有缺陷.正交试验恰好能弥补此缺陷,这种方法已逐渐在该领域应用[22-24].正交试验虽然可确定各因子影响的主次关系,但其对技术要求高,加样时间较长,可能易引起模板断裂或Taq DNA聚合酶失活,影响扩增结果.本试验在前人研究的基础上,以大明竹属25个竹种的DNA为模板,UBC811为引物,采用单因素试验方法,先对反应体系及扩增程序进行优化,确定各因子浓度(用量)后进行扩增检验;在已优化反应体系及扩增程序的基础上,对有效引物进行筛选,并确定引物的退火温度;以大明竹属25个竹种的DNA为模版,用18条ISSR引物在已优化的反应体系及扩增程序下进行扩增.
本试验采用单因素试验方法,对影响大明竹属植物PCR反应的各因子及扩增程序进行了优化,建立了ISSR反应体系,并从初选的100条引物中筛选出18条条带清晰、多态性好、重复性高的有效引物,为ISSR分析大明竹属植物的遗传多样性及遗传结构提供参考.优化后的大明竹属植物ISSR-PCR的20 μL反应体系含 2.0 μL 10 × PCR Buffer、2.5 mmol·L-1Mg2+、0.15 mmol·L-1dNTPs、0.5 μmol·L-1引物、1.0 U Tap DNA聚合酶、50 ng模板DNA、10.6 μL灭菌ddH2O.扩增程序为:94℃预变性5 min;94℃变性60 s,55℃复性45 s,72℃延伸90 s,循环40次;72℃延伸7 min,4℃保存.
[1]中国科学院植物研究所.中国植物志:第九卷第一分册[M].北京:科学出版社,1996.
[2]甘小洪,丁雨龙.竹类结构植物学研究进展[J].竹子研究汇刊,2002,21(1):11-17.
[3]郭振林,李德铢.竹亚科系统学和生物地理学研究进展及存在的问题[J].云南植物研究,2002,24(4):431-438.
[4]陈双林,应杰.竹子的观赏价值及开发利用[J].竹子研究汇刊,2000,19(2):13-17.
[5]赵奇僧,汤庚国.中国竹子分类的现状和问题[J].南京林业大学学报:自然科学版,1993,17(4):1-8.
[6]LOH J P,KIEW R,SET O,et al.A study of genetic variation and relationships within the bamboo subtribe Bambusinae using amplified fragment length polymorphism[J].Annals of Botany,2000,85(5):607-612.
[7]HODKINSON T R,RENVOIZE S A,CHONGHAILE G N,et al.A comparison of ITS nuclear DNA sequence data and AFLP markers for phylogenetic studies in Phyllostachys(Bambusoideae,Poaceae)[J].Journal of Plant Research,2000,11:259-269.
[8]LIN X C,RUAN X S,LOU Y F,et al.Genetic similarity among cultivars of Phyllostachys pubescens[J].Plant Systematics and Evolution,2009,277:67-73.
[9]郭小勤,李犇,阮晓赛,等.利用ACGM分子标记研究10个毛竹不同栽培变种的遗传多样性[J].林业科学,2009,45(4):28-32.
[10]武建云,邓玉营,丁雨龙.篌竹变种RAPD分析[J].常州工学院学报,2008,21(1):59-63.
[11]娄永峰,杨海芸,张有珍,等.部分竹类植物遗传变异的AFLP、ISSR和SRAP分析[J].福建林学院学报,2011,31(1):38-43.
[12]郑蓉,郑维鹏,方伟.DNA分子标记在竹子分类研究中的应用[J].福建林业科技,2006,33(3):162-165.
[13]江泽慧.世界竹藤[M].沈阳:辽宁科学技术出版社,2002.
[14]杨光耀,赵奇僧.苦竹类植物RAPD分析及其系统意义[J].江西农业大学学报,2000,22(4):551-553.
[15]李艳,江玉梅,鲁顺保,等.突托蜡梅ISSR引物反应条件的优化与筛选[J].武汉植物学研究,2008,26(3):245-250.
[16]ZIETKIEWICZ E,RAFALSKI A,LABUDA D.Genome fingerprinting by simple repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[17]IUORAS M,PATRASCU M,VASILE C,et al.A marker genes collection and RAPD markers for recessive branching in sunflower[J].Helia,1999,22(30):29-35.
[18]孙志娟,项艳,汪结明,等.刚竹ISSR反应体系的正交优化[J].竹子研究汇刊,2007,26(4):17-21.
[19]姜静,杨传平,刘桂丰,等.桦树ISSR-PCR反应体系的优化[J].生态学杂志,2003,22(3):91-93.
[20]黄宇,荣俊冬,李凤涛,等.九节茶ISSR反应体系的建立及优化[J].福建农林大学学报:自然科学版,2009,38(2):139-143.
[21]曾亮,李敏权,杨晓明.等.豌豆ISSR-PCR反应体系的建立和优化[J].草地学报,2012,20(3):536-539.
[22]郑世群,刘金福,吴则焰,等.孑遗植物水松基因组DNA提取及ISSR反应体系建立[J].福建农林大学学报:自然科学版,2013,42(2):158-161.
[23]沈浩,刘登义.遗传多样性概述[J].生物学杂志,2001,18(3):5-8.
[24]胡守荣,夏铭,郭长英,等.林木遗传多样性研究方法概况[J].东北林业大学学报,2001,29(3):72-75.
