从非变性聚丙烯酰胺凝胶中快速高效回收DNA片段
2013-12-23周颐王忆平
周颐 王忆平
(北京大学生命科学学院,北京 100871)
在分子生物学试验中,常常要对通过PCR扩增获得的目的DNA片段进行回收和纯化,除去非特异性的DNA片段[1]。鉴于琼脂糖凝胶电泳的分辨率在回收小片段DNA时存在较大的局限性[2,3],小片段DNA的回收纯化往往需要借助于分辨率更高的聚丙烯酰胺凝胶电泳(PAGE)或高效液相色谱(HPLC),以满足分子生物学中要求较高的试验[4,5]。虽然高效液相色谱是一个强有力的分析工具,但使用其回收DNA耗时长,价格昂贵且只能单线程操作[6],而聚丙烯酰胺凝胶电泳由于耗时短,价格经济,同时可操作回收多个样品且易掌握,被广泛应用于小片段DNA的回收纯化[7,8]。
针对从聚丙烯酰胺凝胶电泳中回收目的DNA,目前报道了几种常用的回收方案(挤压回收法[9]、凝胶浸泡法[10]、磁珠法[11]等),并且生物公司(Qiagen,OMEGA,Biospin等)也研发了相应的回收试剂盒,但冗繁的操作流程和高昂的费用以及时间成本,极大地限制了它们的使用。考虑到从PAGE凝胶中回收DNA的困难,主要在于以C-C键聚合的PAGE胶,其分子结构非常紧密,在高温下又不会像琼脂糖一样熔化[12],而挤压、凝胶浸泡等方法由于耗时久,胶的破碎度低,限制了DNA的释放,回收效率差。本试验综合考虑了以上存在的问题,结合前人的研究成果[13-15],探索一种简单快捷的通过增强PAGE凝胶的破碎度,从非变性聚丙烯酰胺凝胶中最大程度地释放并回收纯化DNA片段的方法,并将回收后的DNA样本用于后续的凝胶阻滞试验,旨在验证这种纯化方法的实用性和可行性。
1 材料与方法
1.1 材料
长度在186-200 bp,通过限制性内切酶EcoR I,Hind III克隆到pUC18载体上的大肠杆菌merR的一系列启动子。
Bio-Rad 30%(29∶1)丙烯酰胺储液,ddH2O,过硫酸铵,TEMED,6×loading buffer(0.25%溴酚蓝、0.25%二甲苯青、40%蔗糖),Trans2K DNA ladder marker,Easy Pfu supermix,无水乙醇或异丙醇,醋酸钠(pH5.2,3 mol/L),Tiangen琼脂糖胶回收试剂盒,Roche DIG Gel Shift Kit(2ndGeneration),天恩泽溴化乙锭(EB)清除剂,天恩泽PAGE回收DNA试剂盒,GE Health NanoDrop ND-1000。
1.2 方法
1.2.1 PCR扩增目的片段 使用Bio-Rad PCR仪C1000进行DNA片段扩增。50 μL反应体系包括:25 μL全式金2×Easy Pfu supermix,正反向引物(10 μmol/L)各1 μL,质粒模板1 μL,50 ng,ddH2O 22 μL。反应条件:94℃ 2 min;94℃ 30 s,50℃ 30 s,72℃ 15 s,30个循环;72℃ 10 min。
1.2.2 PAGE胶电泳 6%浓度的非变性PAGE胶的制备参照分子克隆(第3版)[1](不同大小的DNA片段应选择适宜的凝胶浓度)。取10 μL 1%琼脂糖切胶回收的PCR产物加入2 μL 6×loading buffer(0.25%溴酚蓝,0.25%二甲苯青,40%蔗糖),混匀上样。150 V恒压电泳至二甲苯青接近胶板3/4处停,室温电泳即可,冰浴效果更佳。
1.2.3 溴化乙锭染色 小心撬开玻璃板,将胶轻轻拨入盛有0.5 μg/mL溴化乙锭的容器中,室温染色10 min。染色完毕后,用清水小心洗脱非特异性结合于凝胶上的溴化乙锭。
1.2.4 从PAGE中回收纯化DNA片段 在凝胶尚未干燥时,用干净的手术刀片将待回收的目的DNA片段小心的切割下来,放入干净的小号研钵中。若PAGE胶已经干燥并卷边,可将凝胶重新放入装有双蒸水的培养皿中,于脱色摇床上摇动约5 min,即可重新获得平整的凝胶用于切胶回收。将液氮小心的注入盛有目的DNA凝胶的研钵中,待液氮挥发,用干净的小号瓷杵,将固化后的凝胶碾成均匀的粉末,加入2倍胶体积的去离子水,用1 mL的移液器,充分吹吸混匀并转移至1.5 mL的eppendorf管中,14 000×g室温离心10 min。吸取上清至新的1.5 mL eppendorf管中,加入2倍体积预冷的无水乙醇或70%体积的异丙醇,1/10体积的3 mol/L的醋酸钠(pH5.2),-20℃静置20 min,14 000×g离心15 min。弃上清,预冷70%浓度乙醇漂洗2次(亦可更多次),真空抽干或室温待乙醇挥发完全,去离子水溶解即可,如需要去除溴化乙锭,可加入溴化乙锭清除剂处理24 h。
2 结果
2.1 目的DNA片段的获取
大肠杆菌merR系列启动子经由PCR扩增,产物通过1%的琼脂糖回收胶电泳检测的结果(图1)显示,目的DNA片段(大小在196-200 bp之间)通过PCR得到了有效地扩增,并且在1%的琼脂糖回收胶的分辨率下,除了目的条带以外,没有非特异性扩增的条带。

图1 PCR目的DNA片段1%琼脂糖电泳图(回收胶)
2.2 两种回收目的DNA方法的比较
将图1中的目的条带从1%的琼脂糖回收胶上切下来,使用Tiangen琼脂糖胶回收试剂盒加以回收,回收产物经由1%的琼脂糖凝胶电泳检测,结果(图2)显示,回收的目的片段为单一DNA条带。

图2 琼脂糖凝胶回收纯化DNA的检测(1%琼脂糖电泳)
同时将图2中的样品(即琼脂糖切胶回收后的DNA片段),上样于浓度为6%的非变性聚丙烯酰胺凝胶电泳(图3)。比较图2和图3可以看出,琼脂糖电泳检测特异的单一条带经聚丙烯酰胺电泳后出现多条非特异性条带,这些非特异性条带可能会影响后续的凝胶阻滞试验的结果。

图3 琼脂糖凝胶回收纯化DNA的检测(6%非变性聚丙烯酰胺凝胶电泳)
将图1中的PCR扩增产物直接用于非变性聚丙烯酰胺凝胶电泳,接着进行回收纯化,得到图4的结果。由图4中的条带可见,经过非变性聚丙烯酰胺凝胶电泳回收纯化后,可以有效地消除非特异性条带的干扰。

图4 聚丙烯酰胺凝胶回收纯化DNA的检测(6%非变性聚丙烯酰胺凝胶电泳)
2.3 两种方法回收的DNA应用在凝胶阻滞试验检中的效果比较
进一步用凝胶阻滞试验检测不同方法下所回收的DNA片段的特异性情况。将图2中的启动子DNA样品用于凝胶阻滞试验(图3),检测启动子与转录调控蛋白CRP之间的相互作用,结果见图5。

图5 琼脂糖凝胶回收纯化DNA用于和CRP蛋白的凝胶阻滞电泳图
从图5可以看出,除了最下面的free DNA条带和最上面的目的阻滞条带以外,还有多条非特异的阻滞条带,这是由于不纯的DNA与蛋白间的非特异性结合造成的。而通过聚丙烯酰胺凝胶回收纯化的DNA用于同样的凝胶阻滞试验,发现除了单一目的阻滞带以外,没有其他非特异的阻滞带出现(图6)。

图6 聚丙烯酰胺凝胶回收纯化DNA用于和CRP蛋白的凝胶阻滞电泳图
2.4 三种不同方法回收DNA的定量评估
从电泳结果可以看出,同一DNA样本,通过PAGE回收纯化的DNA在纯度和特异性上,显著高于应用琼脂糖方法回收纯化的DNA。与此同时,DNA的回收率也是我们最为关心的指标之一。针对不同方法回收到的DNA得率的评估,在此将图1中的两个不同的PCR产物,平均分为一式3份(每份100 μL),通过3种方法加以回收(最后回收到相同溶解体积50 μL):a. Tiangen琼脂糖凝胶回收试剂盒回收;b.天恩泽PAGE回收DNA试剂盒回收(浸泡煮沸法);c.利用“1.2方法”中PAGE回收,通过NanoDrop仪器来检测。用于校准零点的去离子水中也相应加入了溴化乙锭清除剂,以保持与回收的DNA样本中的一致性,结果见表1。
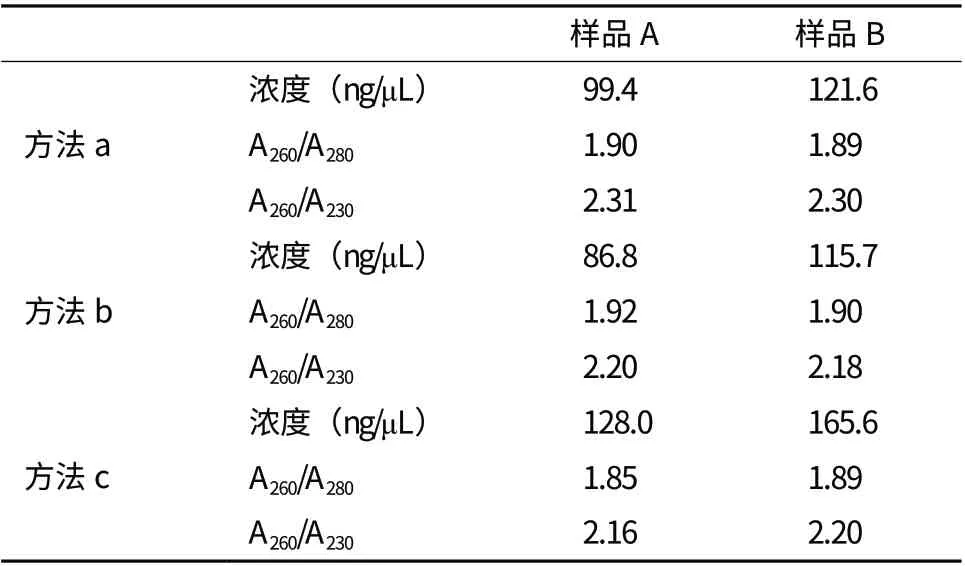
表1 三种不同方法回收DNA浓度及纯度的比较
从表1中可以了解到,将样品A和样品B通过3种方法回收后,用PAGE回收试剂盒回收的DNA浓度最低,其次是通过琼脂糖回收试剂盒回收的DNA,而采用本研究“1.2方法”中回收所获得的DNA浓度最高,且通过该方法回收的DNA在纯度上与两种回收试剂盒回收获得的DNA纯度相当。
3 讨论
尽管近年来有许多关于DNA回收、纯化方法的报道和比较,但基本上这些方法都是基于琼脂糖凝胶的回收和纯化方法的改良,针对从PAGE胶中回收和纯化DNA方法的报道极少[16-18]。由于聚丙烯酰胺凝胶在高温下不熔,强韧致密的结构又限制了DNA的释放,煮沸、挤压、捣碎、浸泡的处理都不甚理想,严重影响了回收效率[12]。就目前报道的方法来看,有的回收率低,有的操作繁琐,有的价格昂贵,因此完善而高效的回收方案亟待探索。本试验在沿用一贯采用的乙醇沉淀DNA方法的基础上,借助液氮对聚丙烯酰胺凝胶的固化作用,通过研磨固化后的凝胶成粉末,破坏凝胶的结构,最大限度的从凝胶中释放DNA,从而提高DNA的回收率。与以往报道的回收DNA片段的方法不同的是:由于不需要反复挤压、浸泡PAGE胶,整个试验所需操作时间短,随即避免了因凝胶长时间浸泡以及煮沸法而导致DNA降解[15];尽管磁珠法回收DNA效率高,但磁珠价格昂贵,提高了试验成本[11],而本方法则没有耗材依赖性;无需借助组织研磨仪等高级器材[14],摒弃了对仪器的依赖性。
在定量评估不同方法回收DNA的效率上,本研究的方法相较于另外两种方法而言,能够获得较高的DNA浓度,且维持与试剂盒纯化回收的DNA相当的纯度。通过一般PAGE试剂盒回收DNA得率低的原因主要是:捣碎、浸泡、煮沸的方法无法最大限度释放PAGE胶中的DNA,导致溶解在液相中待回收DNA样品量降低;用琼脂糖回收试剂盒回收的DNA,得率高于用PAGE回收试剂盒回收的结果,但仍低于“1.2方法”中所获得的DNA,究其原因,是因为吸附柱上的DNA在较小洗脱体积时不能最大限度的洗脱下来,仍有部分DNA残留在洗脱柱上,而如果用较大体积洗脱,固然能获得最大量的总DNA,却牺牲了单位体积的DNA浓度,不能达到试验的要求。
使用本方法回收纯化DNA要注意的是:(1)当用双蒸水充分溶解被研磨成粉末中的DNA,并通过离心分离上清和下层胶碎片后,在用移液器吸取上清的过程尽量不要吸入下层碎片,以免影响乙醇沉淀的效果;(2)为了加大上样量,可以在配胶时使用1.5 mm的梳子,或者将样品先通过琼脂糖电泳回收浓缩再上样聚丙烯酰胺凝胶电泳;(3)切胶用的刀片要干净,所切条带要尽量细;(4)用于研磨的研钵要清洗干净,避免DNA交叉污染;(5)无水乙醇,醋酸钠和75%的乙醇都要提前预冷。由于本试验中所研究的目的DNA长度约有200 bp,而分子生物学研究中往往要用到更短的DNA片段(< 50 bp),如果通过本方法回收纯化这类小片段,首先要选择合适的丙烯酰胺储液(丙烯酰胺/甲叉双丙烯酰胺混合液,19∶1),同时提高用于电泳的聚丙烯酰胺胶的浓度以加大分辨率,另外在乙醇沉淀的过程中要相应地延长冰浴时间和离心时间。对于单链寡核苷酸的回收也可参考使用本方法,考虑到用于分离单链寡核苷酸的凝胶中含有尿素,因此在最后洗涤的时候要相应多洗涤两次以除去尿素。
4 结论
通过研磨固化的凝胶以最大限度释放凝胶中的DNA,从而快速高效地从非变形聚丙烯酰胺凝胶中回收DNA片段的方法。通过不同试验手段检测,该方法回收纯化的DNA特异性强,得率高,纯度较好。因此,对于那些需要高纯度DNA样品的分子生物学试验而言,是一种简单经济,能够被广大的实验室所采纳接受的方法。
[1] Sambrook J, Russell DW. Molecular cloning:A laboratory manual. 3rd ed [M].New York:Cold Spring Harbor Laboratory Press, 2001:636-648.
[2] 赵培, 王振英, 彭永康.琼脂糖和聚丙烯酰胺凝胶电泳技术检测小麦基因组DNA RAPD扩增产物的方法学比较[J].中国生物工程杂志, 2003, 23(8):96-100.
[3] 王霞, 王烨, 李琳琳, 等.琼脂糖和聚丙烯酰胺凝胶电泳检测肠道菌群基因扩增产物的方法学比较研究[J].新疆医学, 2008, 38:136-138.
[4] 翟红, 刘庆昌.甘薯胚性悬浮细胞遗传转化的研究[J].中国农业科学, 2003, 36:487-491.
[5] Hideaki T, Hiroji A. A common role of CRP in transcription activation:CRP acts transiently to stimulate events leading to open complex formation at a diverse set of promoters [J]. The EMBO Journal, 1998, 17:1759-1767.
[6] 黎朋.荧光标记DNA片段高效液相色谱质谱分析及荧光特性研究[D].北京:生物能源与环境计量科学和测量技术研究所, 2010.
[7] Xu M, Busby SJW. Activation and repression at the Escherichia coli ynfEFGHI operon promoter [J]. Journal of Bacteriology, 2009, 191(9):3172-3176.
[8] Seoh HK, Tai PC. Catabolic repression of secB expression is positively controlledby cyclic AMP (cAMP) receptor protein-cAMP complexes at the transcriptional level [J]. Journal of Bacteriology, 1999, 181(6):1892-1899.
[9] 薛仁镐, 金圣爱, 孙世孟, 等.琼脂糖凝胶中DNA片段的挤压回收法.生物技术, 2006, 16(3):50-51.
[10] 王春, 陈琳玲, 许灿新, 等.简便快速的PCR产物回收方法[J].南华大学学报, 2005, 33(1):109-111.
[11] 杨百全, 王利君, 遇长春, 等.磁珠法回收纯化DNA样本[J].中国法医学杂志(增刊), 2006(1):10-11.
[12] 蒋志飞.活性自由基聚合法制备聚丙烯酰胺及其水凝胶的研究[D]. 重庆:重庆大学, 2007
[13] 高传军.一种从聚丙烯酰胺凝胶上回收D N A片段的简易方法[J].科技信息, 2009, 19:6
[14] 朱玉君, 樊叶杨, 庄杰云.从非变性聚丙烯酰胺凝胶回收纯化DNA样本[J].生物技术通报, 2010(1):193-195.
[15] 章蕾, 袁玲, 刘仲华, 等.从非变性聚丙烯酰胺凝胶中回收DNA小片段的两种方法比较[J].中国农学通报, 2011, 27:227-230.
[16] 朱晓峰, 安小平, 陈锦辉, 等.一种简便、高效、经济的从凝胶中回收DNA的方法[J].生物技术通讯, 2006, 17:603 -604.
[17] 庄飞云, 茅淑敏, 娄群峰, 等.简便实用的琼脂糖凝胶回收DNA片段方法[J].生物技术通讯, 2003, 14(3):202-203.
[18] 蒋安, 梁慧, 陈旭, 等.回收琼脂糖凝胶中DNA的简便方法[J].生物技术通报, 2006(2):102-103.
