安祖花组培快繁体系的建立
2013-12-23康黎芳李永平曹冬梅段九菊王云山
康黎芳,李永平,曹冬梅,张 超,段九菊,王云山
(山西省农业科学院园艺研究所,山西太原030031)
安祖花(Anthuium andraeanum Lind)是天南星科多年生草本植物,其花形独特,花色艳丽,已成为全球销售量仅次于热带兰的第二大商品花卉。安祖花生长缓慢,生长周期长,繁殖困难,一般采取分株繁殖的方式,但是繁殖率低,无法满足生产的需求。因此,开发一种新的安祖花繁殖方法非常必要。近年来,植物组培快繁技术被广泛应用于各种观赏植物的繁殖上。据报道,组培快繁技术已用于满天星[1]、蝴蝶兰[2-3]、凤梨[4-5]、大花蕙兰[6]、百合[7-8]等的繁殖上。目前,安祖花的繁殖主要是通过组培快繁的途径,很多研究指出,安祖花的不同品种及不同器官和部位对诱导条件的反应有所不同[9-21]。
本研究主要以安祖花的幼嫩叶片为外植体,研究其组培快繁的最佳培养基配方,寻找最优化的安祖花再生体系,从而为生产提供优质种苗。
1 材料和方法
1.1 试验材料
供试材料为安祖花,由山西省农业科学院园艺研究所花卉中心提供,选择生长健壮、叶色浓绿、无病斑的具有一定市场价值的品种阿里桑娜(Arizona)、阿米戈(Amigo)、亚特兰大(Atlanta)和情人红(SH Red)。
1.2 试验方法
1.2.1 不同灭菌时间对外植体污染率和存活率的影响 选取刚展开的幼嫩叶片、成叶、叶柄、花梗、花序、根和苞片,用自来水冲洗10~15 min,然后转入0.1%HgCl2溶液中消毒。试验设3个处理:0.1%HgCl2分别灭菌5,10,15 min,用无菌水冲洗3~4次备用。每瓶接种5~6块,10 d后统计不同灭菌时间对不同外植体灭菌效果的影响。
1.2.2 愈伤组织诱导培养基筛选 试验选用基本培养基5种(1/3 MS,1/3 MS(NH4NO3为200 mg/L),1/2 MS,MS(NH4NO3为200 mg/L),MS),附加不同质量浓度的6-BA(0.5,1.0,1.5,2.0 mg/L)和2,4-D(0.05,0.1,0.2,0.5 mg/L),蔗糖30 g/L,琼脂5 g/L,共80个处理。每处理5瓶,每瓶接种4块,重复3次。
1.2.3 不定芽分化增殖培养基筛选 试验选用基本培养基6种(1/3 MS,1/2 MS,MS,MS(NH4NO3为为720 mg/L)),附加不同质量浓度的6-BA(0,0.25,0.50,0.75,1.00 mg/L)或KT(0,0.25,0.50,0.75,1.00 mg/L),蔗糖30 g/L,琼脂5 g/L,共60个处理。每个处理5瓶,每瓶接种4块生长良好的愈伤块,重复3次。
1.2.4 生根培养基筛选 基本培养基为1/2 MS,分别附加不同质量浓度IBA(0.05,0.1,0.2,0.5,1.0mg/L)或NAA(0.05,0.1,0.2,0.5,1.0 mg/L),共10个处理。每处理5瓶,每瓶接种4块,重复3次。
2 结果与分析
2.1 灭菌时间对不同外植体灭菌效果的影响
外植体的选取关系到能否成功诱导出愈伤组织,是组培快繁成功的第1步,为了探讨不同的氯化汞处理时间对不同外植体污染的影响,分别选取幼叶、成叶、叶柄、花梗、花序、根和苞片进行不同灭菌时间的研究,其结果列于表1。
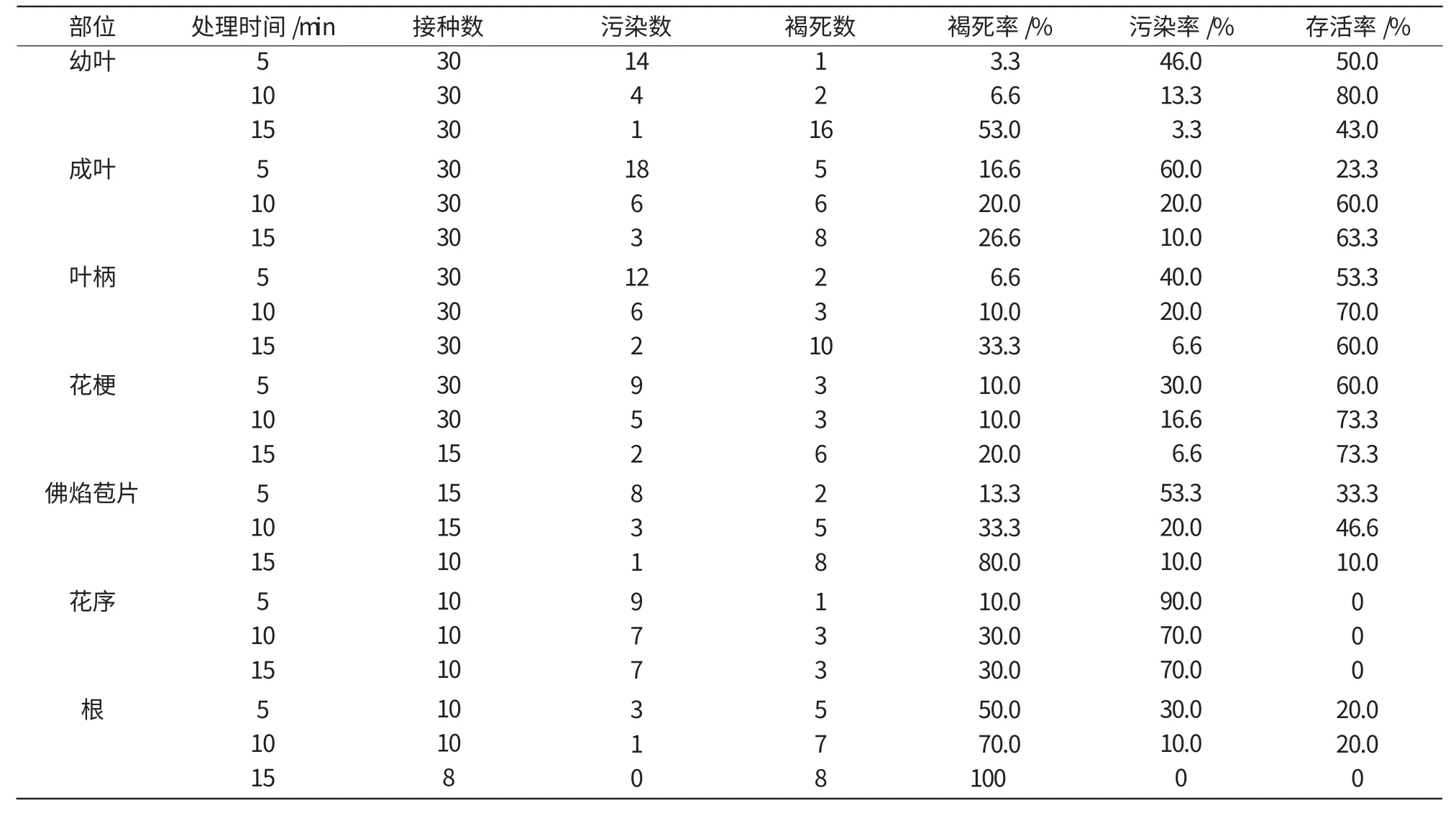
表1 灭菌时间对不同外植体灭菌效果的影响
一般情况下,如果材料消毒不彻底,在接种第3天左右即开始出现污染,在接种10 d后污染基本稳定。本试验结果(表1)表明,随着氯化汞消毒时间的增加,灭菌效果随之提高,污染率降低,其中,幼叶的污染率从5 min的46.0%减少到15 min的3.3%;成龄叶、叶柄等都有相同趋势。但随着消毒时间的增加,外植体的褐死率随之提高,造成存活率下降,其中,幼叶的存活率由10 min的80%降到15 min的43%。但由于幼叶5 min的污染率较高,所以,5 min的存活率反而比10 min的低。
综合考虑,安祖花的成叶、叶柄、花梗、佛焰苞片的消毒时间以氯化汞15 min为宜,幼叶以10 min为宜,而花序在试验的氯化汞浓度范围内全部污染。为了保证培养材料的无菌,避免污染带来的损失,灭菌时间在可能的范围内宜稍长一些。
2.2 不同外植体对愈伤组织诱导的影响
植物不同器官的脱分化能力不同,本试验的材料包括幼叶、成叶、叶柄、花梗、根、佛焰苞片、花序7个部分,其中,叶片和苞片根据不同部位剪成1 cm2大小,花梗、叶柄、根段切成0.5 cm长,花序切成0.5 cm2的小块,将以上材料接种于愈伤组织诱导培养基上。结果(表2)表明,不同部位诱导愈伤的难易程度不同,幼叶最易诱导形成愈伤组织,其次是花序,而成熟的叶片、花梗和根段在供试的安祖花品种中均未诱导出愈伤。不同品种的安祖花外植体诱导愈伤组织的难易程度也不尽相同,如阿里桑娜和情人红可以用叶柄诱导出愈伤组织,而阿米戈和亚特兰大诱导失败。因此,综合考虑取材的难易等因素,安祖花组培外植体以选择生长10 d左右的幼叶为佳。
2.3 愈伤组织诱导培养基筛选
对5个基本培养基配方附加不同浓度的6-BA和2,4-D共计80个配方的研究发现,在叶片愈伤组织的诱导过程中细胞分裂素的作用非常明显,无论是培养20 d还是60 d,均以6-BA 0.5 mg/L愈伤组织诱导率最高,此后随6-BA浓度增加愈伤组织诱导率下降(表3)。
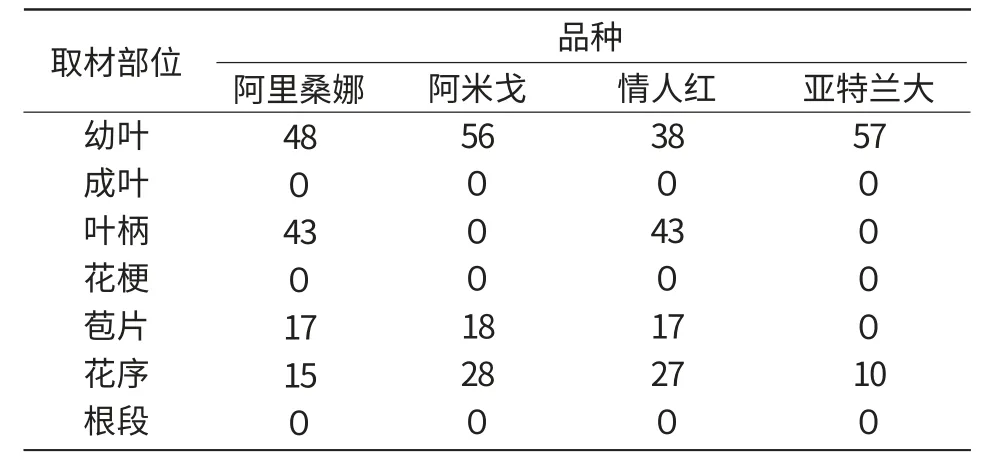
表2 不同取材部位对愈伤组织诱导率的影响%
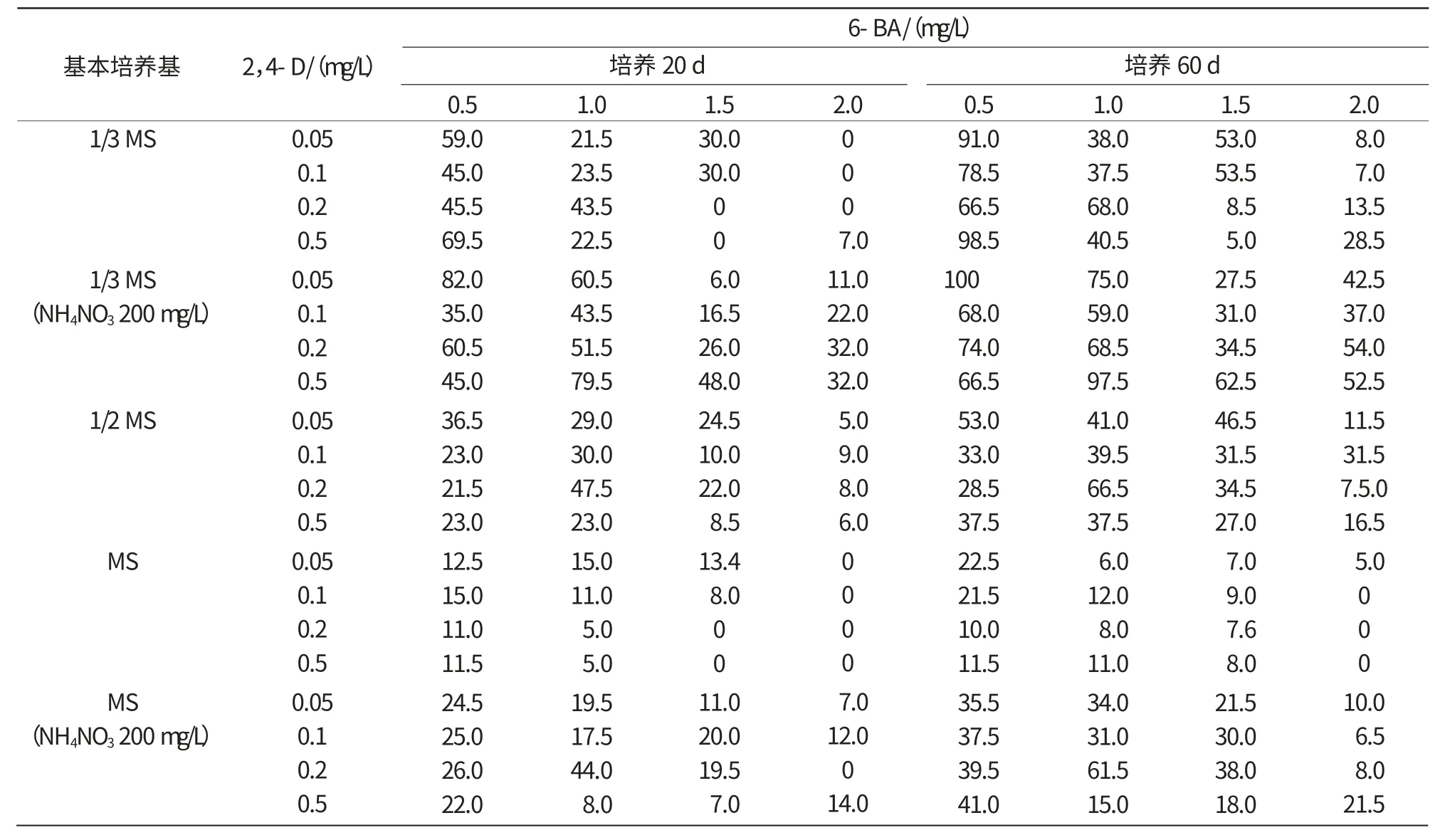
表3 不同培养基配比对阿里桑娜愈伤组织诱导率的影响%
2.4 不定芽分化增殖培养基筛选
每个处理接种20块生长良好的愈伤组织,观察不同处理对愈伤组织不定芽分化的影响,结果显示,只有4个配方有较多的芽形成,其余配方或愈伤组织褐化或发芽数极少而不具有统计意义。4个配方的分化结果列于表4。
由表4可知,6-BA为1 mg/L时繁殖系数较高,但在6-BA定量的情况下,1/2 MS繁殖系数显著高于1/3 MS。说明在4个配方中,以1/2 MS+6-BA 1 mg/L诱导不定芽分化培养基效果最好,其次为1/3 MS+6-BA 1 mg/L。
各品种虽然在不同的调查天数发芽率不同,但是对培养基的反应基本一致,均以1/2 MS+6-BA 1 mg/L+琼脂6 g/L+蔗糖30 g/L最好。在对4个品种的调查中发现,各个品种芽分化的能力不一,以阿里桑娜最容易进行芽的分化。
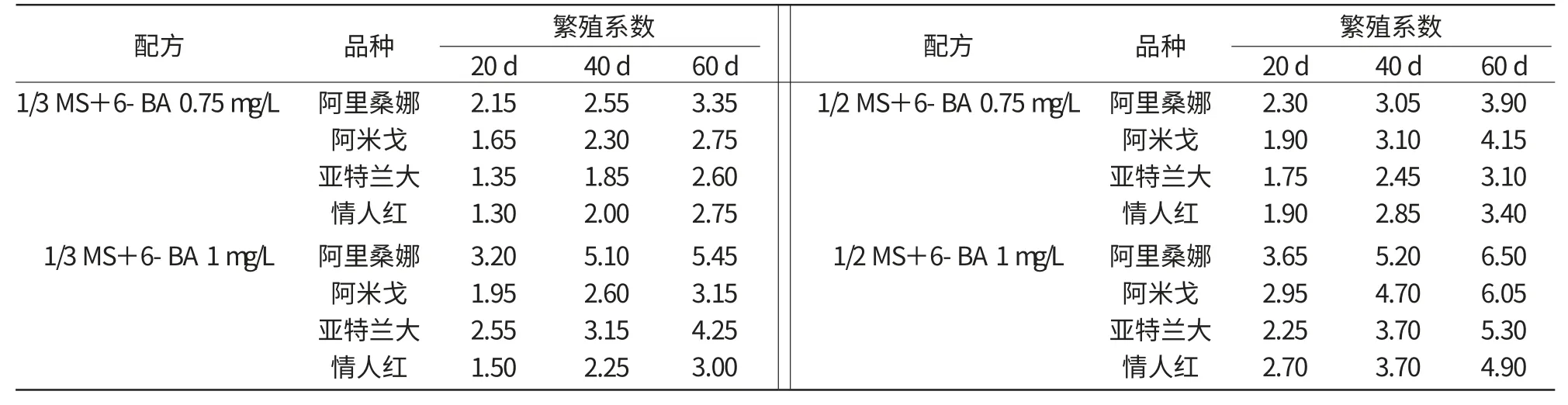
表4 不同培养基配方对不定芽分化的影响
2.5 生根培养基筛选
试验结果(表5)表明,在生根培养基中附加IBA的生根率极显著高于附加NAA的培养基,其中,在附加IBA的各质量浓度中,以IBA 0.05 mg/L生根率最高,显著高于附加IBA 1 mg/L的培养基,而与附加IBA 0.1,0.2,0.5 mg/L的生根率间没有显著差异。安祖花试管苗生根培养基以1/2 MS+IBA 0.05 mg/L+琼脂6 g/L+蔗糖30 g/L最佳。
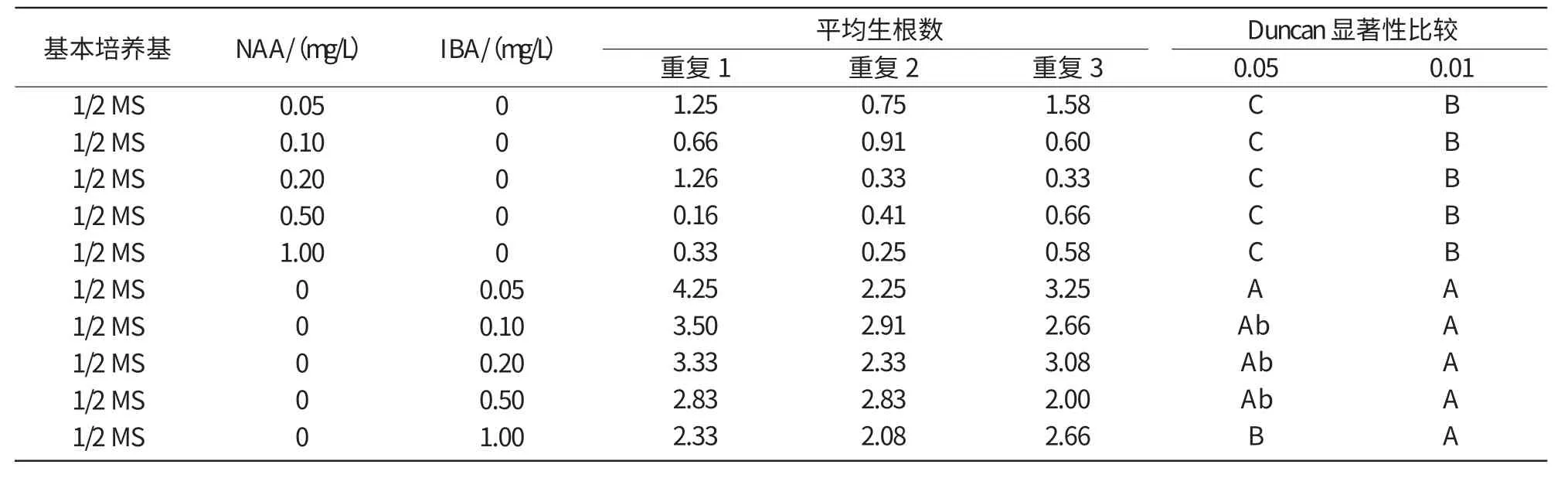
表5 不同培养基配方对阿里桑娜生根的影响
3 讨论
外植体进行彻底的消毒灭菌是组培快繁的前提和保证,目前关于安祖花外植体消毒的研究并不多。凌雷[17]研究认为,最佳消毒方法是流水冲洗30 min后,用70%酒精浸泡60 s。陈华等[18]研究认为,茎、叶、叶柄的最佳消毒条件分别为0.1%氯化汞消毒15~20,5~7,10~12 min。本试验结果显示,氯化汞对不同外植体的消毒能力不同,一般外植体以氯化汞消毒10~15 min为宜,但是花序组织在试验的氯化汞浓度范围内,接种后或污染或褐化死亡,最后的成活率为0,这可能是由于花序组织细胞或细胞间隙比叶片等其他部位更适合内生菌生存所导致的。
基本培养基保证了培养物的生存与最低的生理活动,但只有配以合适浓度的植物激素才能诱导细胞的分裂、愈伤组织的形成和增殖、芽的分化等生理过程[16]。本试验结果表明,在叶片愈伤组织的诱导过程中,细胞分裂素的作用非常明显,当附加6-BA为0.5 mg/L时愈伤组织形成最多,而2,4-D的作用不太明显,与前人的研究结果存在一定的差异[10-12,18],可能是由于供试的外植体叶片的年龄、部位、取材时间不同或培养条件的不同所造成的[19]。本试验的结果还表明,无机盐的浓度对愈伤组织的形成至关重要,在某种程度上起着决定作用,当基本培养基为1/3 MS,硝酸铵质量浓度降到200 mg/L时,愈伤组织形成数量最多,而且可以缩短愈伤组织形成的时间,这与刘炤[20-22]等报道的结果基本一致,但是硝酸铵的最佳浓度略有不同,这可能是由于供试材料选取的品种不同所造成的。
外植体经过40~50 d诱导愈伤组织培养后,可将愈伤组织转接到分化培养基上增殖。本试验结果表明,以1/2 MS+6-BA 1 mg/L+琼脂6 g/L+蔗糖30 g/L为最佳培养基,这与前人的研究结果不完全相同[15-19]。
安祖花试管苗生根比较容易,在小苗的分化过程中常伴有根的生成。本试验结果表明,生根培养基以1/2 MS+IBA 0.05 mg/L+琼脂5 g/L+蔗糖30 g/L最佳,而且在生根培养基中附加IBA的生根率极显著高于附加NAA的培养基,与已有的报道略有差异[9,13],可能是由于所使用的外植体材料及培养条件不同所引起的。
[1]汪国鲜,杨春梅,阮继伟,等.满天星不同品种组培苗增殖研究[J].北方园艺,2013(1):124-126.
[2]赵滢,杨树华,李秋香,等.热激处理对蝴蝶兰组培褐变的抑制及其生理机制[J].北京林业大学学报,2013,35(1):103-108.
[3]李娜.蝴蝶兰组培快繁技术的研究进展[J].广东农业科学,2007(11):44-46.
[4]龚明霞,何铁光,黄如葵,等.观赏凤梨组培快繁技术研究进展[J].广西农业科学,2010(5):412-415.
[5]关丽霞,修红旭,杨倩,等.3种观赏凤梨花蕾的离体培养和快速繁殖[J].安徽农业科学,2009,37(5):1999-2000.
[6]张春丽,丁义,何松林,等.不同培养基支持体对大花蕙兰试管苗生长的影响[J].河南科学,2010,28(6):677-680.
[7]杨懋勋,单振菊,陈志云,等.4种观赏百合的组培快繁技术研究[J].广东农业科学,2012(2):37-39.
[8]袁雪,钟雄辉,李晓昕,等.铁炮百合的胚性愈伤组织诱导和植株再生[J].核农学报,2012(3):454-460,477.
[9]汪希强,陶佩琳,张旭东,等.红掌组培快繁技术优化研究[J].安徽农业科学,2012,40(33):16052-16053,16080.
[10]兰芹英,李启任,何慧英,等.红掌愈伤组织诱导和芽的分化[J].园艺学报,2003,30(1):107-109.
[11]兰芹英,仇玉萍,张远辉,等.不同红掌品种的叶片、叶柄和茎段愈伤组织的诱导及植株再生[J].西北植物学报,2003,23(6):1006-1009.
[12]夏时云,麦瑜玲,许继勇,等.提高红掌叶片愈伤组织诱导和植株分化及壮苗率的技术研究[J].中国农学通报,2005,21(2):45-48.
[13]王勇,杨元,吴国智,等.红掌组培苗两种生根培养方法的比较研究[J].天津农业科学,2009,15(4):27-29.
[14]潘学峰,潘海,洪世军,等.红掌叶片愈伤组织的诱导与植株再生[J].海南大学学报,2000,18(2):144-149.
[15]肖三元,梁国平.红掌组织培养及快速繁殖[J].云南热作科技,2000,23(2):12-13.
[16]吕复兵,王碧青,廖飞雄,等.红掌叶片离体培养与植株再生研究[J].广东农业科学,2002(6):25-26.
[17]凌雷.红掌快速繁育最适培养条件的筛选研究[J].现代农业科技,2011(11):212-213.
[18]陈华,吴子平.粉女郎红掌组培快繁技术研究[J].安徽农学通报,2010,16(21):55-57.
[19]关丽霞,谢永刚,彭世勇,等.红掌叶不同部位愈伤组织的诱导及植株再生[J].辽宁农业职业技术学院学报,2007,9(1):25-27.
[20]刘炤,刘国锋,张翼.NH4NO3及碳源对红掌愈伤组织诱导影响的研究[J].北方园艺,2011(24):152-154.
[21]郭维明,赵云鹏,文方德.花烛愈伤组织不同继代培养的再分化差异[J].园艺学报,2004,31(1):69-72.
