稻田生态系统中植硅体的产生与积累
——以嘉兴稻田为例
2013-12-20李自民宋照亮姜培坤
李自民,宋照亮,2,3,* ,姜培坤,2
(1.浙江农林大学环境与资源学院,临安 311300;2.浙江农林大学浙江省森林生态系统碳循环与固碳减排重点实验室,临安 311300;3.中国科学院地球化学研究所环境地球化学国家重点实验室,贵阳 550002)
植硅体(Phytoliths)俗称植物蛋白石(plant opal),是植物在生长过程中依靠根系吸收土壤中可溶性的二氧化硅(SiOH4,即单硅酸),在蒸腾等作用下,沉淀在植物的细胞壁、内腔和细胞壁间的无定形二氧化硅[1-2]。随着植物的死亡,植物残体在微生物分解等作用下,大量的植硅体释放到土壤中[3],由于其较强的抗分解能力,可以长时间的保存在土壤和沉积物中[4],在第三纪[5]甚至晚白垩纪的土壤层中都可以发现[6]。
目前,有关植硅体的研究主要是在以下几个方面开展:农业考古[7-9]、碳同位素研究[10-12]、古气候重建[13-16]、植硅体固定大气中 CO2的潜力[17-21]、植硅体放射性定年[22-23]及植物分类学[1,24]等。植硅体作为生物硅(biogenic silica)的一个组成部分,在全球硅的生物地球化学循环中起着重要作用[25-26],但对不同植物植硅体含量[21]及植硅体在生物硅库中的含量变化研究较少[27]。
世界上种植水稻的国家有111个,其中中国是水稻种植面积最大的国家,2011年的水稻种植面积高达2.96×107hm2[28],约占世界的 35%[29]。水稻是积累硅较强的禾本科植物,其干物质含硅(SiO2) 量高达15%[30],对陆地表层生物硅的生物地球化学循环可能有重要影响[31]。水稻土中植硅体形态特征及其演化等目前已有较多研究[32-36],但水稻生态系统中植硅体的产生和积累通量及其影响因素如何目前并不清楚。本文选取杭嘉湖平原水稻种植基地的不同品种水稻及其表层土为研究对象,通过对不同品种水稻各个器官和表层土中植硅体的含量分布特征分析,并利用水稻干物质产生与归还等数据,来阐明水稻生态系统中植硅体产生和积累规律,为了解植硅体在稻田生态系统硅和碳生物地球化学循环中的作用提供科学参考。
1 材料与方法
1.1 研究区概况
嘉善县位于太湖流域的杭嘉湖平原,地处中亚热带北缘,气候温和,雨量充沛。全县水稻种植面积1.823万hm2,其中单季稻1.611万hm2,是浙江省重要的商品粮基地之一。试验地选择在嘉善县西塘镇邗上村的强农兴农示范工程、农作物新品种区域试验和展示示范基地(30°56'06.3″N,120°51'52.9″E),面积 83.33hm2,核心区面积15.67hm2。2007年至2010年,在同一块试验地内,对祥湖301、嘉花11、浙粳37、宁81、秀水09等5个品种水稻进行了对比试验。试验期间,祥湖301、浙粳37、宁81、秀水09、嘉花11平均667m2产分别为541.3、584.2、586、516.5、600kg。
1.2 样品采集
样品采集选择在2010年10月份水稻成熟期,成熟期水稻植硅体含量最大[37-38],在每个品种稻田中,分别采集水稻表层土(0—10cm)、根、茎鞘、叶和稻穗等样品。采集方法是在每一个品种稻田中200cm的范围内选择7个穴,每个穴采集10—15株水稻,连根拔起,混匀后放在塑料布上,轻轻敲打根部,去除杂草、石块后,用不锈钢剪刀于水稻露地处剪断,收集稻根,分别再采集稻穗、茎、叶和鞘,编号装袋。同时采集每个穴对应的水稻植株样品附近0—10cm的表层土,最后把7个穴的土壤混合成一个土样,约500g。
1.3 样品处理和分析
1.3.1 土壤样品
采集的土样,经自然风干后,挑根,研磨先过10目筛,供土壤硅、磷有效态的分析测试,然后均匀的取出三分之一10目筛土样过100目筛供土壤全硅分析。土壤pH、有机质、有效磷、有效硅、总硅等含量按文献[39]方法测定。土壤植硅体的提取按照文献[31]方法提取,但略有变动,为了提取土壤中更高纯度的植硅体含量,每份样品都要进行多次加重液重复提取,同时重液密度维持在2.38左右。
1.3.2 植物样品
采集的水稻植株各器官根、茎、鞘、叶和穗先分别用自来水多次冲洗,根用超声波清洗过后,和其它器官一起再用去离子水反复冲洗干净,放置鼓风烘箱中105℃进行杀青30min,最后放在鼓风烘箱中75℃烘干至恒重,称其干重。各器官剪碎后混匀,分成两份,其中一份用不锈钢植物粉碎机粉碎,其中一份用剪刀剪至1cm左右供以植硅体提取分析。样品的总硅含量按照文献[39]方法测定。植物样品植硅体的提取按照微波消解的方法来提取[40],同时用Walkley-Black方法彻底地除去植硅体外面多余的有机质[41]。提取出的植硅体放在干燥过的离心管内(已称重),在鼓风烘箱中75℃干燥24h,然后称重得出植硅体质量[40]。
1.4 数据处理
本文的结果数据为3次重复的平均值,数据进行方差分析,并用新复极差法进行多重比较。数据的统计分析均在Microsoft、Excel和DPS等软件上进行。
2 结果与分析
2.1 水稻土壤的理化参数与植硅体含量
表1给出了不同品种稻田表层土壤的基本理化参数和植硅体含量变化。不同品种水稻表层土pH值变化不大,均值为5.87,呈现为弱酸性。水稻表层土壤有机质较丰富,变换范围为15.16—19.62g/kg,平均值为22.86g/kg。土壤总SiO2和有效硅含量在不同水稻表层土中变化不大,之间差异不是很明显,均值分别为667.03g/kg和227.11mg/kg。有效态Fe2O3含量在不同水稻表层土壤中有较大的变化,变化范围为704.89—1943.51mg/kg,均值为1332.63mg/kg。不同品种水稻表层土壤中有效磷含量较高,变化范围为24.73—52.60mg/kg,均值为 35.23mg/kg。
不同品种水稻表层土植硅体含量差异不显著(11.62—19.24g/kg之间,平均值为15.63g/kg),其中嘉花11土壤层最高19.24g/kg,祥湖301最低11.62g/kg。
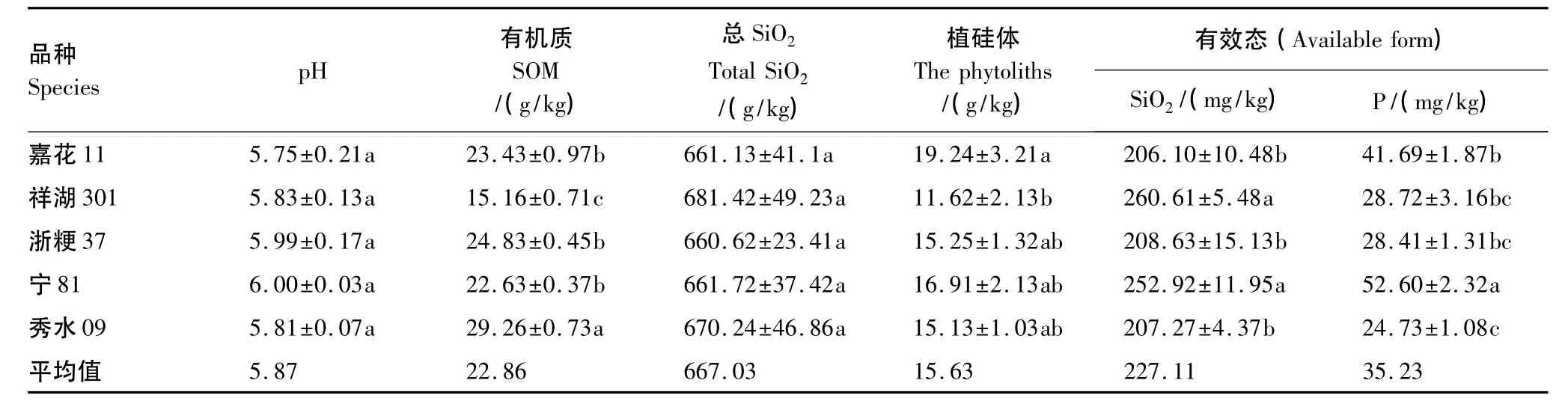
表1 不同品种水稻表层土壤的基本理化参数和植硅体含量Table 1 The basic physicochemical parameters of surface soil from different rice species
2.2 植硅体在不同品种水稻各器官中分布特征
表2给出了稻田生态系统中植硅体的含量变化范围。不同品种水稻植硅体含量有一定的差异(40.54—51.40g/kg,均值为46.54g/kg),其中嘉花 11 最高(51.40g/kg),其次是祥湖 301(50.00g/kg)和宁 81(46.40g/kg),浙粳37(40.54g/kg)和秀水09(44.36 g/kg)最低。
不同品种水稻各器官中植硅体含量均表现出相同的分布趋势:鞘>叶>茎>根>穗(表2)。鞘部植硅体含量最高,明显高于其余各器官,其变化范围较大在103.06—144.04g/kg之间,均值为119.86g/kg;其次是叶,水稻叶部植硅体含量变化为55.52—79.30g/kg,均值是70.39g/kg;水稻茎部植硅体含量变化较小,在30.90—40.16g/kg之间,平均值是37.61g/kg;根部植硅体含量变化较大,范围在22.42—38.24g/kg之间,均值是32.41g/kg;穗部植硅体含量最低,含量变化在 15.23—27.18g/kg 之间,均值为22.29g/kg(表 2)。
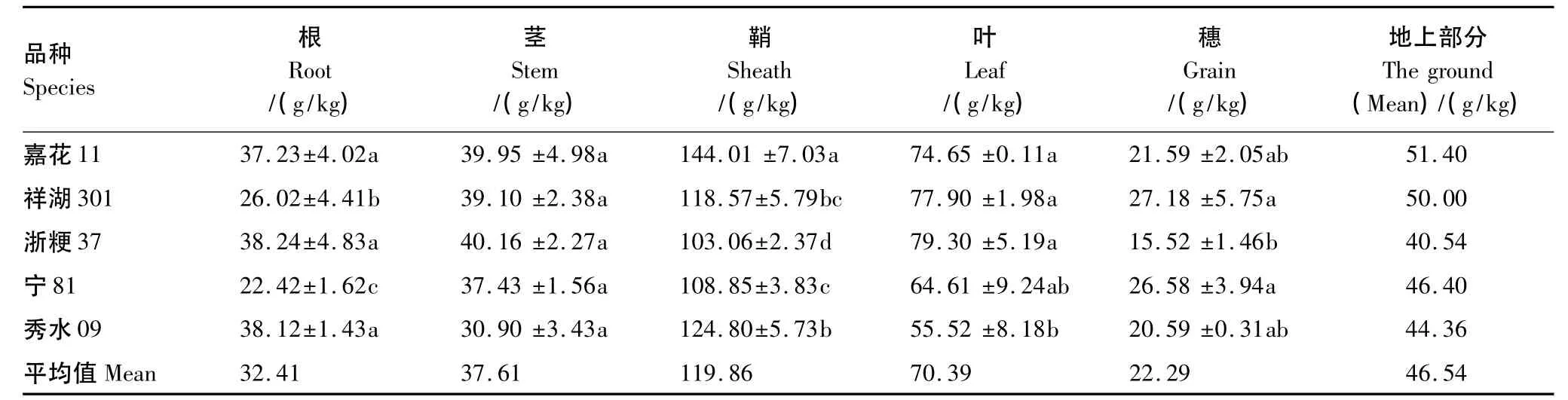
表2 稻田生态系统中水稻各器官和地上部分及其表层土壤中植硅体的含量变化Table2 The variation of phytolith content from different rice organs,the aboveground and surface soil in rice ecosystem
3 讨论
3.1 稻田生态系统中植硅体含量的影响因素
在土壤总硅及有效硅含量差异不显著的情况下,水稻基因的不同,不同品种水稻对硅的吸收能力不同,植硅体在每个水稻植株及其各个器官中的含量也有一定的差异[30],总体上表现出,嘉花11、宁81和祥湖301植硅体含量较高于浙粳37和秀水09。在植物蒸腾的作用下,植硅体在水稻植株中各器官中的分布均呈现出相同的分布趋势:鞘>叶>茎>根>穗[42]。由表2可以看出,稻田生态系统中0—10cm土壤层植硅体含量明显低于水稻各器官中的,引起这个差异的原因,主要是以前的水稻植株在收割以后并没有全部归还于土壤中,仅仅剩下根部残茬留在土壤,例如本实验中祥湖301稻田,有机质含量很低,其表层土中植硅体含量也明显低于其它稻田表层土中的。此外,归还到土壤中的植硅体会受到一些人为的扰动、侵蚀和沉积事件等的影响,造成部分植硅体的损失[25]。所以,土壤中的植硅体含量与植物中相比会相对少很多。
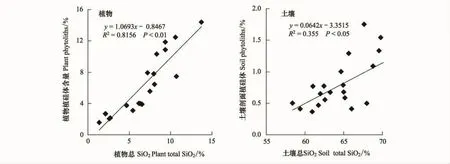
图1 稻田生态系统中植硅体与总SiO2之间的相关性(土壤剖面的数据来自文献[31])Fig.1 The correlation of the phytoliths and total SiO2 in rice ecosystems
从图1可以看出水稻植株植硅体与其总SiO2有强的的正相关性,为R2=0.8156(P<0.01)[31],表明水稻植株富硅能力强的部分,其植硅体含量也高。因此,为了提高植物植硅体的含量,可以选择一个高硅吸收作物(例如,嘉花11)进行推广。前人的研究也发现通过施用钢渣等硅肥可以明显的增加植物吸收的硅含量[43-44],或许那些影响植物硅吸收的因素,最终可能也会对植物植硅体的积累产生一定的影响,因此可以通过硅调控机制来增加植物的硅含量,进而来提高植物植硅体的含量就显得科学可行。
由图1还可以看出土壤中植硅体与其总SiO2有较强的正相关性,R2=0.355(P<0.05)[31]。表明,随着土壤中总硅的含量升高,其植硅体含量也在慢慢的增加。虽然植硅体占土壤总SiO2比例很少,但是由于植硅体较强抗分解能力,可以非常稳定的保存在土壤和一些沉积层中。
土壤中有效硅和有效磷及pH对植物和土壤中植硅体含量影响不显著(表1)。
3.2 稻田生态系统中植硅体及其包裹碳的产生和积累通量
为了更好地了解水稻植株各器官植硅体的产生通量,本研究对每个样品的产量和干重都进行了统计分析。穗、鞘、叶、茎和根各个器官占干物质量百分比分别为:58%、14%、9%、12%和7%,依据对个5个水稻品种连续3a的实验结果平均产量,对每个水稻品种地上和地下部分植硅体产生通量进行了估算(图2),其中嘉花 11(1483.41 kg hm-2a-1),宁 81(1308.08 kg hm-2a-1)和祥湖301(1301.81 kg hm-2a-1)地上部分植硅体产生通量,略高于浙粳 37(1139.23 kg hm-2a-1)和秀水09(1102.12 kg hm-2a-1)。地下部分植硅体产生通量,嘉花 11(80.88 kg hm-2a-1),浙粳37(80.89 kg hm-2a-1)和秀水09(71.29 kg hm-2a-1)明显高于祥湖301(51.00 kg hm-2a-1)和宁81(47.57 kg hm-2a-1)。在嘉兴水稻种植区选择高植硅体量和高产量的水稻品种嘉花11进行推广种植,对水稻植硅体产生通量的增加有一定的作用。
5个品种水稻单季的平均产量是8484 kg/hm2。利用5个品种水稻各器官植硅体含量平均值,得出水稻植株各器官根、茎、鞘、叶和穗植硅体产生通量分别为 66.15、131.65、491.08、185.36 和395.35 kg hm-2a-1,地上部分植硅体产生通量为 1203.44 kg hm-2a-1,地下部分植硅体产生通量为 66.15 kg hm-2a-1,水稻植株产生通量为1269.59 kg hm-2a-1。尽管水稻植株植硅体的产生通量很大,但是人为对水稻植株的干扰比较大,实际上植硅体在土壤中年归还量并不等于水稻植株植硅体的年产生量。例如,人为收割水稻时,仅仅是根及大约三分之一的茎杆留在了土壤中,而此时植硅体归还通量约是110.03 kg hm-2a-1;而机器收割水稻时可能会让大约三分之二的地上部分茎叶留在土壤中,此时大大增加了植硅体的归还量,大约是604.87 kg hm-2a-1。

图2 5个品种水稻地上和地下部分植硅体产生通量Fig.2 The fluxes of the aboveground and underground phytoliths production in five rice species
稻田0—10cm土壤的平均容重为1.22g/cm3,表层土壤植硅体平均含量为16.55g/kg,假设利用文献[31]同一地区稻田0—50cm土壤剖面的水稻种植年限为50a,那么植硅体在0—10cm土壤中的积累通量为40.38 kg hm-2a-1。而这个年积累量基本上接近水稻根部的植硅体年归还量,这主要是原因可能是,在实验基地水稻成熟以后,基本上都是人为收割的,残留在稻田中秸秆非常少,主要是水稻根茬残留于稻田中,表层土的植硅体积累率就较低。因此,为了提高稻田生态系土壤植硅体的积累通量,增加水稻秸秆的还田就显得比较重要。
由于植物植硅体中包裹碳的含量大约为1%—6%[17-19],水稻植株通过植硅体包裹大气中CO2的通量约为 46.55—279.31 kg hm-2a-1,稻田土壤中植硅体包裹大气中 CO2的通量约为 1.48—8.88 kg hm-2a-1。综上所述,选择一种高植硅体量和高产量的水稻品种(嘉花11),进行推广种植,同时提高水稻秸秆的还田,对提高水稻植株植硅体碳汇有较好效果。
4 结论
(1)不同品种水稻植株及其各器官植硅体的含量有一定的差异,嘉花11、宁81和祥湖301植硅体含量略高于浙粳37和秀水09,各器官中植硅体的分布趋势均表现为:鞘>叶>茎>根>穗>表层土,并且土壤和水稻植株中植硅体与其总SiO2都呈现出较显著的正相关性。
(2)不同品种水稻植硅体产生通量有一定的差异,地上和地下部分植硅体的产生通量嘉花11普遍高于其它品种。水稻植株地上部分植硅体产生通量为1203.44 kg hm-2a-1,地下部分植硅体产生通量为66.15 kg hm-2a-1,植株总植硅体产生通量为1269.59 kg hm-2a-1。植硅体在种植50a的稻田0—10cm的土壤中的积累通量为:40.38 kg hm-2a-1,仅相当于水稻植株根的归还量,表明在水稻收割以后地上部分秸秆归还量较少。
(3)水稻植株植硅体固定大气中CO2的通量为46.55—279.31 kg hm-2a-1,稻田土壤中植硅体包裹大气中CO2的通量约为1.48—8.88 kg hm-2a-1。选择一种高植硅体量和高产量的水稻品种(如嘉花11)进行推广种植,可提高水稻植株植硅体的产生和积累通量以及植硅体碳汇。
[1]Piperno D R.Phytolith Analysis:An Archaeological and Geological Perspective.San Diego:Academic Press,1988.
[2]LüH Y,Jia JW,Wang W M,Wang Y J,Liu K B.On the meaning of phytolith and its classification in gramineae.Acta Micropalaeontologica Sinica,2002,19(4):389-396.
[3]Alexander A,Meunier JD,Colin F,Koud JM.Plant impact on the biogeochemical cycle of silicon and related weathering processes.Geochimica et Cosmochimica Acta,1997,61(3):677-682.
[4]Parr J F,Sullivan L A.Soil carbon sequestration in phytoliths.Soil Biology and Biochemistry,2005,37(1):117-124.
[5]Strömberg C.Using phytolith assemblages to reconstruct the origin and spread of grass-dominated habitats in the great plains of North America during the late Eocene to early Miocene.Palaeogeography,Palaeoclimatology,Palaeoecology,2004,207(3/4):239-275.
[6]Prasad V,Strömberg CA E,Alimohammadian H,Sahni A.Dinosaur coprolites and the early evolution of grasses and grazers.Science,2005,310(5751):1177-1180.
[7]Lu H Y,Zhang J P,Wu N Q,Liu K B,Xu D K,Li Q.Phytoliths analysis for the discrimination of foxtail millet(Setaria italica)and common millet(Panicum miliaceum).PLoSONE,2009,4(2):e4448.
[8]Ranere A J,Piperno DR,Holst I,Dickau R,Iriarte J.The cultural and chronological context of early Holocenemaizeand squash domestication in the Central Balsas River Valley,Mexico.Proceedings of the National Academy of Sciences of the United States of America,2009,106(13):5014-5018.
[9]Li X Q,Zhou X Y,Zhang H B,Zhou J,Shan X,Dodson J.The record of cultivated rice from archaeobiological evidence in northwestern China 5000 years ago.Chinese Science Bulletin,2007,52(10):1372-1378.
[10]Kelly E F,Amundson R G,Marino B D,Deniro M J.Stable isotope ratios of carbon in phytoliths as a quantitative method of monitoring vegetation and climate change.Quaternary Research,1991,35(2):222-233.
[11]Krull E S,Skjemstad JO,Graetz D,Grice K,Dunning W,Cook G,Parr J F.13C-depleted charcoal from C4grasses and the role of occluded carbon in phytoliths.Organic Geochemistry,2003,34(9):1337-1352.
[12]Wang Y J,LüH Y,Wang G A,Yang H,Li Z.Analysis of carbon isotope in phytoliths from C3and C4plants and modern soils.Chinese Science Bulletin,2000,45(19):1804-1808.
[13]Carter J A.Phytolith analysis and paleoenvironmental reconstruction from Lake Poukawa Core,Hawkes Bay,New Zealand.Global and Planetary Change,2002,33(3/4):257-267.
[14]Lu H Y,Wu N Q,Yang X D,Yang X D,Jiang H,Liu K B,Liu T S.Phytoliths as quantitative indicators for the reconstruction of past environmental conditions in China I:phytolith-based transfer functions.Quaternary Science Reviews,2006,25(9/10):945-959.
[15]Bremond L,Alexandre A,Wooller M J,Hély C,Williamson D,Schäfer P A,Majule A,Guiot J.Phytolith indices as proxies of grass subfamilies on East African tropical mountains.Global and Planetary Change,2008,61(3/4):209-224.
[16]Ge Y,Jie D M,Guo JX,Liu H M,Shi L X.Response of phytoliths in Leymus chinensis to the simulation of elevated global CO2concentrations in Songnen Grassland,China.Chinese Science Bulletin,2010,55(32):3703-3708.
[17]Parr J F,Sullivan L A,Quirk R.Sugarcane phytoliths:encapsulation and sequestration of a long-lived carbon fraction.Sugar Tech,2009,11(1):17-21.
[18]Parr J F,Sullivan L A,Chen B H,Ye G F,Zhang W P.Carbon bio-sequestration within the phytoliths of economic bamboo species.Global Change Biology,2010,16(10):2661-2667.
[19]Parr JF,Sullivan L A.Phytolith occluded carbon and silica variability in wheat cultivars.Plant and Soil,2011,342(1/2):165-171.
[20]Song Z L,Wang H L,Strong P J,Li Z M,Jiang P K.Plant impact on the coupled terrestrial biogeochemical cycles of silicon and carbon:Implications for biogeochemical carbon sequestration.Earth-Science Reviews,2012,319-331.
[21]Zuo X X,Lü H Y.Carbon sequestration within millet phytoliths from dry-farming of crops in China.Chinese Science Bulletin,2011,56(32):3451-3456.
[22]Wilding L P,Brown R E,Holowaychuk N.Accessibility and properties of occluded carbon in biogenetic opal.Soil Science,1967,103(1):56-61.
[23]Mulholland S,Prior C.AMS radiocarbon dating of phytoliths//Pearsall D M,Piperno D R,eds.MASCA Research Papers in Science and Archaeology.Philadelphia:University of Pennsylvania,1993,10:21-23.
[24]Blackman E.Observations on the development of the silica cells of the leaf sheath of wheat(Triticum aestivum).Canadian Journal of Botany,1969,47(6):827-838.
[25]Clarke J.The occurrence and significance of biogenic opal in the regolith.Earth-Science Reviews,2003,60(3/4):175-194.
[26]Sommer M,Kacaorek D,Kuzyakov Y,Breuer J.Silicon pools and fluxes in soils and landscapes-a review.Journal of Plant Nutrition and Soil Science,2006,169(3):310-329.
[27]Borrelli N,Osterrieth M,Romanelli A,Alvarez M F,Cionchi J L,Massone H.Biogenic silica in wetlands and their relationship with soil and groundwater biogeochemistry in the Southeastern of Buenos Aires Province,Argentina.Environmental Earth Sciences,2012,65(2):469-480.
[28]National Bureau of Statistics of China,2012.http://www.stats.gov.cn/.
[29]Kögel-Knabner I,Amelung W,Cao Z H,Fiedler S,Frenzel P,Jahn R,Kalbitz K,Kölbl A,Schloter M.Biogeochemistry of paddy soils.Geoderma,2010,157(1/2):1-14.
[30]Wang Y J,Lu H Y.The Study of Phytolith and Its Application(in Chinese).Beijing:China Ocean Press,1993:1-228.
[31]Chen L M,Zhang GL.Phytoliths and its occluded organic carbon in a stagnic anthrosols chronosequence.Chinese Journal of Soil Science,2011,42(5):1026-1030.
[32]Gong Z T,Chen H Z,Yuan D G,Zhao Y G,Wu Y J,Zhang G L.The temporal and spatial distribution of ancient rice in China and its implications.Chinese Science Bulletin,2007,52(8):1071-1079.
[33]Huang F,Zhang M.Pollen and phytolith evidence for rice cultivation during the Neolithic at Longqiuzhuang,eastern Jianghuai,China.Vegetation History and Archaeobotany,2000,9(3):161-168.
[34]Lu J,Hu ZY,Cao ZH,Yang L Z,Lin X G,Dong Y H,Ding JL,Zheng Y F.Characteristics of soil fertility of buried ancient paddy at Chuodun site in Yangtze River Delta.Scientia Agricultura Sinica,2006,39(1):109-117.
[35]Cao Z H.Study of prehistoric irrigated paddys and ancient paddy soils in China.Acta Pedologica Sinica,2008,45(5):784-790.
[36]Cao Z H,Ding J L,Hu Z Y,Knicker H,Kögel-Knabner I,Yang L Z,Yin R,Lin XG,Dong Y H.Ancient paddy soils from the Neolithic age in China's Yangtze River Delta.Naturwissenschaften,2006,93(5):232-236.
[37]Norris A R,Hackney C T.Silica content of a Mesohaline Tidal Marsh in North Carolina.Estuarine,Coastal and Shelf Science,1999,49(4):597-605.
[38]Motomura H,Mita N,Susuki M.Silica accumulation in long-lived leaves of Sasa veitchii(Carrière)rehder(Poaceae-Bambusoideae).Annals of Botany,2002,90(1):149-152.
[39]Lu R K.Methods of Agricultural Chemical Analysis in Soil.Beijing:Chinese Agricultural Science and Technology Press,2000.
[40]Parr JF,Dolic V,Lancaster G,Boyd W E.A microwave digestion method for the extraction of phytoliths from herbarium specimens.Review of Palaeobotany and Palynology,2001,116(3/4):203-212.
[41]Walkley A,Black I A.An examination of the Degtjareff method for determining soil organic matter,and a proposed modification of the chromic acid titration method.Soil Science,1934,37(1):29-38.
[42]Ma JF,Yamaji N,Tamai K,Konishi S,Fujiwara T,Katsuhara M,Yano M.An efflux transporter of silicon in rice.Nature,2007,448(7150):209-212.
[43]Mecfel J,Hinke S,Goedel W A,Marx G,Fehlhaber R,Bǎucker E,Wienhaus O.Effect of silicon fertilizers on silicon accumulation in wheat.J Plant Nutr Soil Sci,2007,170:769-772.
[44]Zhang Y L,Liu M D,Wang Y J,Du L D.Effects of slag application on Si,Fe and Mn in paddy soil and rice plant.Chinese Journal of Soil Science,2003,34(4):309-311.
参考文献:
[2]吕厚远,贾继伟,王伟铭,王永吉,廖淦标.“植硅体”含义和禾本科植硅体的分类.微体古生物学报,2002,19(4):389-396.
[9]李小强,周新郢,张宏宾,周杰,尚雪,Dodson J.考古生物指标记录的中国西北地区5000 a BP水稻遗存.科学通报,2007,52(6):673-678.
[12]王永吉,吕厚远,王国安,杨辉,李珍.C3,C4植物和现代土壤中硅酸体碳同位素分析.科学通报,2000,45(9):978-982.
[16]葛勇,介冬梅,郭继勋,刘红梅,石连旋.松嫩草原羊草植硅体对模拟全球CO2浓度升高的响应研究.科学通报,2010,55(Z2):2735-2741.
[28]国家统计局,2012.http://www.stats.gov.cn/.
[30]王永吉,吕厚远.植物硅酸体研究及应用.北京:海洋出版社,1993:1-228.
[31]陈留美,张甘霖.水耕人为土时间序列的植硅体及其闭留碳演变特征.土壤通报,2011,42(5):1026-1030.
[34]卢佳,胡正义,曹志洪,杨林章,林先贵,董元华,丁金龙,郑云飞.长江三角洲绰墩遗址埋藏古水稻土肥力特征研究.中国农业科学,2006,39(1):109-117.
[35]曹志洪.中国史前灌溉稻田和古水稻土研究进展.土壤学报,2008,45(5):784-790.
[39]鲁如坤.土壤农业化学分析方法.北京:中国农业科技出版社,2000.
[44]张玉龙,刘鸣达,王耀晶,杜立达.施用钢渣对土壤和水稻植株中硅、铁、锰元的影响.土壤通报,2003,34(4):309-311.
