不同水分梯度下珍稀植物四数木的光合特性及对变化光强的响应
2013-12-20杨小飞许海龙邓晓保李玉武陈本雄张文富
邓 云,陈 辉,杨小飞,许海龙,邓晓保,李玉武,陈本雄,张文富
(1.中国科学院西双版纳热带植物园,勐仑 666303;2.中国科学院北京研究生院,北京 100049;3.西双版纳国家级自然保护区管理局勐腊管理所,勐腊 666300;4.普洱学院,普洱 665000)
四数木(Tetrameles nudiflora)属短序花科(Datiscaceae),四数木属(Tetrameles)植物,为东南亚热带特有,属于国家二级保护植物,是西双版纳季雨林群落冠层中主要的落叶树种之一[1-2]。已有研究表明,成年的四数木植株高大,冠幅延展,为许多鸟类提供了良好的筑巢场所[3],而该种具有的大型板根结构,有利于局部生境水分、营养的截流与汇集,进而促进整个群落的生境异质性及物种多样性[4],这对当地热带森林生态系统(尤其石灰山季雨林)功能和特征的发育与维持具有重要意义。然而,对版纳地区植被调查发现,四数木自然更新能力差,林下的幼苗、幼树极为少见,仅有少量成年植株散生于密林中,是当地的自然稀有种[5]。因此,了解四数木幼苗更新的特点和规律,将对该地区物种多样性保护工作具有重要价值。西双版纳地处热带北缘,水分、热量条件均不足[6],旱季(当年11月—翌年4月)旷地浅层土壤含水量(深度10 cm)一般为9.5%—19.8%,林下一般为13.6%—23.1%①中国科学院西双版纳热带雨林生态系统研究站2009—2011年土壤水分观测数据(TDR法)统计结果,水分的不足会对群落部分物种的生长、发育造成影响[7]。同时,由于成熟森林一般具有较高的郁闭度,林内光照不足,因此对林内有限光照和变化光强(光斑)的利用效率也成为制约物种竞争力的重要因素[8-9]。前期研究表明,虽然林下植物全天仅有10%的时间受到光斑照射,但光斑照射时间内的光量子通量密度总和可达到达该地点全天光通量密度的10%—80%[10],而在热带森林的林下植物中,有约30%—60%的日间碳同化都是在光斑下完成[11]。木本植物的幼苗更新被认为是森林群落演替、植被生态恢复等过程中非常关键的一步[12],相对成年植株而言,幼苗对其所处的环境因子变化更加敏感。因此,对四数木幼苗在强/弱光强切换条件下的光合适应能力进行研究,将有助于人们解释热带郁闭森林中四数木在幼苗阶段的存活及其受危原因。
本研究通过模拟本地典型土壤含水状况,结合一定的光强变化进行实验,旨在了解四数木幼苗在持续/变化光强下的光合适应能力以及土壤水分变化对其可能造成的影响,并探讨导致该物种稀有的可能机制,为该物种未来的保育工作提供基础性的研究参考。
1 实验方法
1.1 水分处理
实验在中国科学院西双版纳热带雨林生态系统研究站(21°55'N,101°16'E,海拔565 m)开展。2009年5月在当地采收四数木种子,萌发而得的幼苗于2009年7月23日移栽至花盆中(花盆直径28 cm,高18 cm,每盆1株。移入时苗高约5—10 cm),适应2个月后开始水分试验。控水管理于2009年10月至2010年1月间进行。水分梯度分为3个处理,饱和处理(ST)、对照处理(CT)、干旱处理(DT),每个处理5株重复。每3日使用WET三参数水分仪(Delta-T,英国)对土壤水分进行逐盆检查,当土壤体积含水量低于固定值(饱和处理30%,对照处理20%,干旱处理10%)时进行浇水,每盆每次浇水量固定为1200 ml(约合20 mm左右降雨量,主要考虑10—25 mm为本地雨量最多的降雨等级①中国科学院西双版纳热带雨林生态系统研究站多年观测数据(1961—2008,缺1970、1972—1974年)统计结果,详细数据未列出)。整个控水管理期间共重复测量20次土壤含水量。
1.2 光响应曲线
于2009年12月19日—2010年1月7日间使用LI-6400(LI-COR,美国)进行光响应曲线测定,所有光合测量工作控制在10:00—14:00进行(北京时。由于经度差异,当地地方时较北京时晚1 h 15 min)。测定前使用1000μmol-1m-2s-1光强诱导约 20 min,确定气孔完成诱导后开始试验。按照光强梯度 1800、1500、1200、900、600、300、150、70、30、15、0 μmol-1m-2s-1顺序进行测量,每个光强下适应 5 min 左右以使净光合速率(Pn)和气孔导度(Gs)达到稳定,以3 s间隔连续记录30 s,取平均值作为该光强下读数。每处理测5株,每株1片叶,共计5个重复。

式中,Pmax为最大净光合速率,Φ为弱光下光化学量子效率,C0为度量弱光下净光合速率趋于0的指标,PFD为光量子通量密度,文中以光合有效辐射(PAR)代替)。若方程通过适合性检验,拟合效果良好,则用下式计算光补偿点(LCP):

假定Pn达到Pmax的99%的PFD为光饱和点(LSP),则:

1.3 变化光强响应
由于当地森林群落内的间歇性强光约达 1600 μmol CO2m-2s-1[14],因此本试验以 1500 μmol-1m-2s-1光强对试验植株进行饱和光诱导。在光响应曲线测定完成后(此时光强为零),继续记录5 min黑暗下植株气体交换情况,之后使用1500μmol-1m-2s-1光强对试验植株进行重新诱导,以进行变化光强响应实验。诱导30 min后将光强降低至100μmol-1m-2s-1继续测量15 min。全过程均使用LI-6400自动记录功能进行监测,记录间隔30s。为避免长时间记录导致的数据漂移,每10 min对红外检测器进行1次自动匹配。每处理5个重复。
目前文献中常用达到最大光合速率90%作为时间划分的指标(T90)[15-16],但考虑连续观测时由于环境不可能完全稳定,即使光合达到稳定状态之后仍可能会有些许波动,且在未具体确定稳定点前判断各光合参数达到最大或稳定时的确切数值和时间起始位置本身也存在问题,因此,本研究中将每时刻前后1min数据进行滑动平均(即步长为5),以某时刻起连续4个滑动平均值(即某时刻后连续2 min)取值时刻较前一时刻(即30 s内)的相对变化率小于5%作为连续性时间序列长度截取的参考指标,以此在相对平滑的时间曲线上以统一定量的标准对特征值进行判断和挑选。
1.4 数据分析
使用SPSS19.0对数据进行单向方差分析,确认方差齐性后以S-N-K法进行组间两两比较。均值和标准误为Excel 2003计算结果。文中所用植物名以中国数字植物标本馆(简称CVH。网站:www.cvh.org.cn)中记录名称为准。
2 结果分析
2.1 土壤水分含量
10月23日—12月26日间实际处理的土壤水分含量如图1所示。干旱处理、对照处理和饱和处理土壤水分含量分别为(19.6±7.6)%、(24.6±7.7)%、(32.2±8.3)%,各组间土壤水分含量差异明显(F=8.889,P<0.01),分组处理效果良好。其中,实验中的干旱处理能够一定程度上代表当地旱季土壤水分的一般状况。
2.2 光响应曲线
2.2.1 常规光合参数
对各光强下不同水分处理组的净光合速率进行方差分析发现,自300μmol m-2s-1光强起,干旱处理组Pn值开始显著低于饱和处理组(P<0.05);而对照处理组Pn在整个光响应过程中始终介于饱和处理组和干旱处理组之间(图2),虽与二者存在一定差异,但并未达到显著水平。
王哲,洑颢,梁照恒,等.基于PS@Ag纳米探针和Si@Ag阵列基底的SERS特性的肿瘤标志物免疫检测[J].光子学报,2018,47(12):1228002
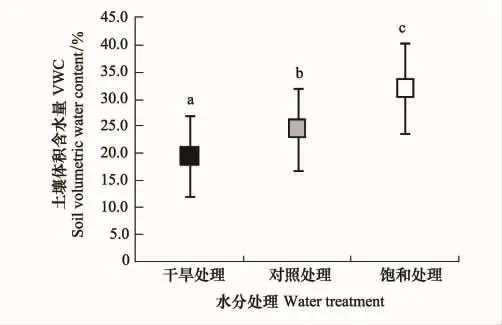
图1 3种水分处理下土壤水分差异情况(N=20)Fig.1 Soil water content under three water gradients

图2 3种水分梯度下四数木幼苗净光合速率随光强响应曲线(N=5)Fig.2 P n-PAR curves of Tetrameles nudiflora seedlings under three water gradients
其他光合参数方面,干旱处理下的蒸腾速率(Transpiration rate,Tr)和气孔导度(Stomatal conductance,Gs)始终显著小于其他两种处理(P<0.05,图3),而胞间CO2浓度(Intercellular CO2concentration,Ci)在150 μmol m-2s-1光强起显著低于其他处理(P<0.05,图3)。干旱处理的叶面水汽压亏缺(Vapor pressure deficit,VPD)在光响应曲线的全程均低于其他两种处理(图3),其中相对于饱和处理,其全程均处于显著较低水平(P<0.05)。
2.2.2 光饱和点与光补偿点
光饱和点与光补偿点计算结果(图4)表明,随干旱程度的加深,四数木光补偿点变化不明显,仍保持在12—15 μmol m-2s-1左右;但光饱和点则自饱和处理和对照处理的(1059±232) μmol m-2s-1和(1080±216)μmol m-2s-1下降为干旱处理下的(726±95) μmol m-2s-1,呈显著性降低(P<0.05)。
干旱处理同样导致了四数木幼苗最大光合速率的降低。饱和水分处理下Pmax可达(9.708±3.225)μmol CO2m-2s-1,而干旱处理下仅为(5.481±1.634) μmol CO2m-2s-1,下降幅度高达 44.3%,为显著性下降(P<0.05)。干旱严重限制了四数木幼苗能够达到的最大光合速率。

图3 3种水分梯度下四数木幼苗其他光合参数随光强响应曲线(N=5)Fig.3 Other photosynthetic parameters response to light curves of Tetrameles nudiflora seedlings under three water gradients

图4 3种水分处理下四数木幼苗光饱和点与光补偿点变化情况Fig.4 LCP and LSP of Tetrameles nudiflora seedlings under three water gradients
2.3 变化光强响应
2.3.1 响应时间
对交替光强下(图6)的不同水分处理进行连续观测发现,干旱处理下四数木幼苗自黑暗条件突然受到强光照射时需要(7.5±1.4)min 方能达到 Pn的稳定(表1),较对照处理((6.6±2.2)min)和饱和处理((6.9±0.7)min)耗时更长,但差异并不明显(P>0.05)。当光强自1500 μmol CO2m-2s-1突然降至100 μmol CO2m-2s-1时,各水分处理下的四数木幼苗Pn均会很快下降至一最低点,随后随时间推移而又逐渐上升至一稳定水平,呈V型曲线变化(图6)。不同水分处理下Pn下降至最低点的时间和恢复至稳定的时间均无显著性差异(F分别为 1.181 和 1.079,P 均大于0.05(表2)。
相对于Pn和Ci,气孔导度Gs在光强变化时大多能够在2 min内完成快速响应,响应过程呈阶梯状变化,不存在明显峰值(图6)。Tr和VPD对光强变化的响应也呈现出类似Gs的时间变化(图6),这可能与气孔导度是影响Tr和VPD的主要因素有关。
2.4 响应数值范围
虽然在光强变化的各个阶段中干旱处理组Ci数值仅表现为不明显的偏低(图6),但在1500μmol m-2s-1光强下干旱处理组Pn稳定值仍显著低于饱和处理(表2)。值得注意的是,虽然100μmol m-2s-1光强下干旱处理组Pn稳定值著低于饱和处理,但在光强刚刚到达100μmol m-2s-1时各组的Pn下降峰值并未呈现出显著性差异(表2),这可能暗示水分胁迫的强度可能主要体现在减少了能够发生可逆性脱离或失活的光合结构数量和功能,而这种胁迫环境对不能发生可逆性反应的其他光合组分影响不大。
干旱处理组的气孔导度全程低于其他处理(图6),各光强下的稳定读数显著低于饱和处理(表2)。光强变化时各处理组Gs数值响应迅速,呈明显的阶梯状变化,但并未出现明显峰值(表2)。各组的Tr和VPD数值变化规律与Gs基本相同(图6)。
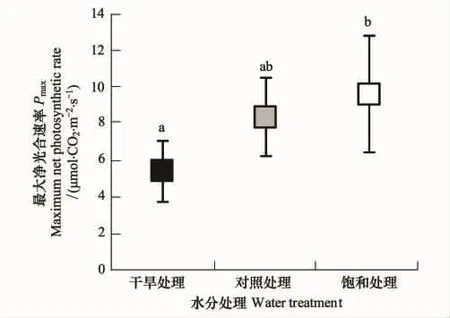
图5 3种水分处理下四数木幼苗最大光合速率变化情况(N=5)Fig.5 Pmax of Tetrameles nudiflora seedlings under three water gradients
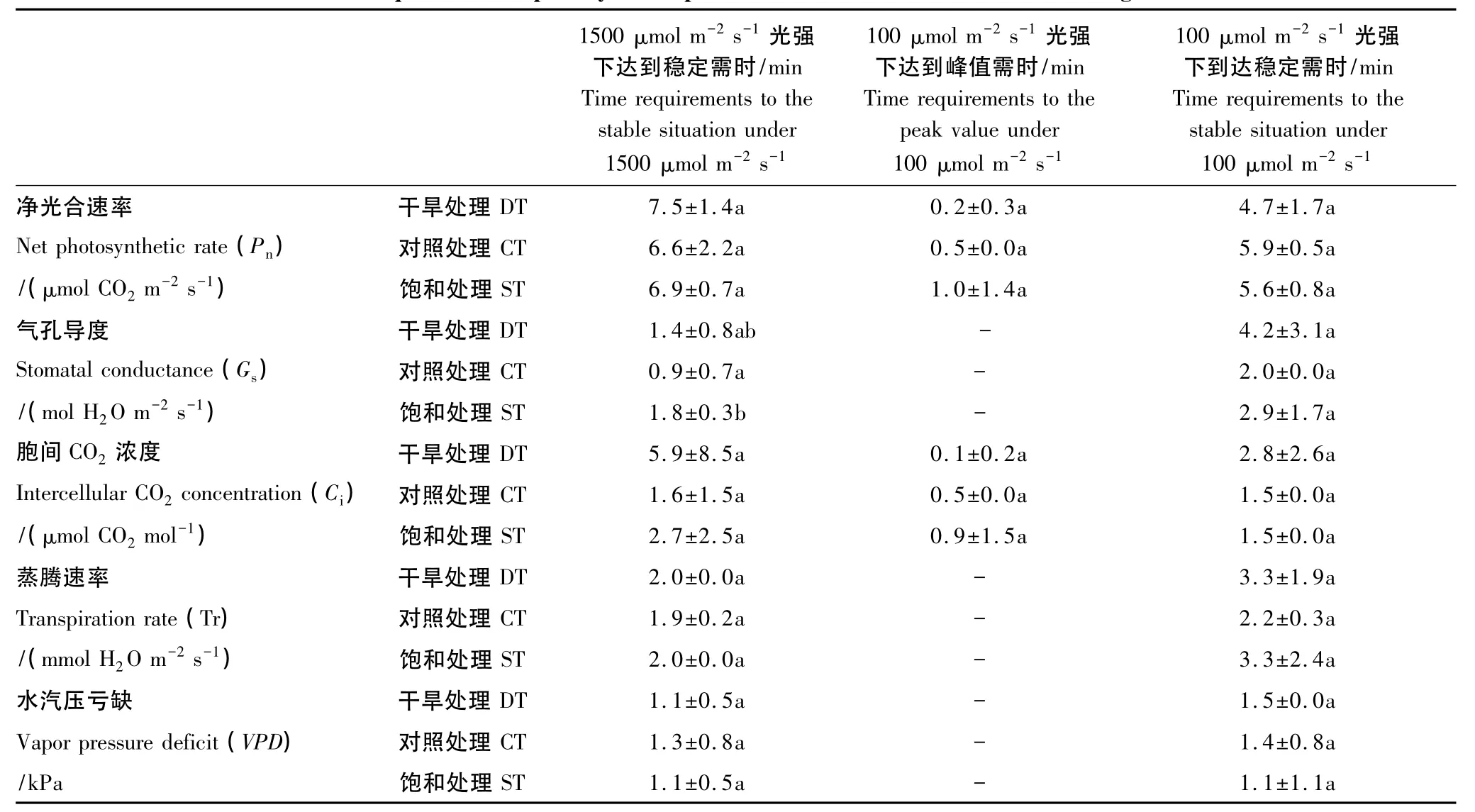
表1 光合参数到达稳定所需时间(N=5)Table 1 Time requirements of photosynthetic parameters become stable under different light conditions
3 讨论
3.1 四数木幼苗的光合效率
研究四数木幼苗在30%左右土壤体积含水量下最大净光合速率Pmax可达(9.708±3.225)μmol CO2m-2s-1,高于当地群落演替后期类群 Pmax平均值((5.37±0.56) μmol CO2m-2s-1),这与演替早期类群相似((9.58±0.97) μmol CO2m-2s-1)[17]。四数木幼苗此时(1059±232) μmol m-2s-1的光饱和点也高于相似处理条件下的番龙眼(Pometia pinnata)、梭果玉蕊(Barringtonia fusicarpa)等演替后期的顶极树种[18],这符合阳性植物光饱和点一般相对较高的特点[19],与早期研究中四数木为阳性树种的推断一致[5]。

图6 四数木幼苗主要光合参数对光强变化的响应时间(仅列出平均值,N=5)Fig.6 Response time of main photosynthetic parameters of Tetrameles nudiflora seedlings with light change
当土壤水分含量降低时,四数木幼苗光饱和点和最大净光合速率均出现明显下降,四数木幼苗的光合生长受到抑制。作为影响气孔响应最重要的环境变量,干旱处理下VPD始终相对较高,而气孔导度相对较低,表明该处理下叶片气孔开度较小,这有利于植物减少水分丧失,但也限制了CO2的交换,导致了较低的胞间CO2浓度和较低的净光合速率[20]。同时,即使是在水分供给有限情况下四数木的 Pmax仍高达(5.481±1.634)μmol CO2m-2s-1,依然高于当地演替后期类群。旱季的缺水环境可能会导致四数木幼苗净同化速率的降低,但相对其他当地演替后期物种而言仍具有一定的竞争优势。
3.2 四数木幼苗对光强增加的响应机制
本实验中由于前期已经历了整个光响应曲线测量的诱导,四数木幼苗气孔能够在光强变化时能够迅速开闭至稳定并带动蒸腾速率和叶面水汽压亏缺的快速变化,表明植物已成功完成前期光诱导过程,而Pn和Ci仍需5—7 min对新的光环境进行适应。以往研究表明不同植物对光斑的响应状况会存在差异,充分暗适应后的林下灌木对突然增加光强的响应时间(4 min)可能较冠层树种幼苗(9—12 min)更快[21],而经过弱光诱导后,演替前期种达到90%最大净光合速率的时间((5.37±0.56)min)却可能较演替后期种类更为迅速((9.58±0.97)min)[17]。对比以上结果发现,四数木在光强突然增加时的反应时间更接近于光诱导后的演替前期种类,且这种响应速度并未随水分处理改变而发生明显变化,表明这种对变化光强的时间响应规律可能是该物种的固有特性。

表2 光合参数到达稳定时数值(N=5)Table 2 Stable/peak value of photosynthetic parameters under different light conditions
3.3 四数木幼苗潜在的光保护机制
本研究中四数木幼苗从饱和光变至有限光时叶片净光合速率能够降低至一个较低水平,并在一段时间后恢复稳定。有研究表明,不同植物净光合速率对光强转换的响应曲线不同,一些植物对光强变化不明感,强光降低后光合速率变化呈L型曲线;而另一些植物在饱和光强下会引起部分补光色素复合体LHCⅡ从光系统II(PSⅡ)发生可逆脱离,在弱光下又重新结合,导致光强降低时的光合速率呈V型曲线变化[22]。本研究结果显示四数木幼苗在不同水分处理下均表现为明显的V型曲线(图6),这表明四数木幼苗在强光下能够发生补光色素复合体LHCII的可逆性脱离,这有利于植物在过量光环境下避免受到强光损伤,同时又能保证弱光下的光合作用趋向最大[23-24]。这种特征有助于四数木幼苗适应阳性生境,但同时也有可能对经常性光强变化时光合系统的反应速度造成限制,导致光斑环境下的整体光合效率相对偏低。
另一方面,虽然随着水分胁迫的加剧,四数木幼苗在强光和弱光下的净光合速率均出现降低,但是不同的水分环境似乎并未对光强改变时净光合速率达到的最低点造成太大改变。这是否说明水分胁迫仅对容易发生可逆性失活部分LHCII造成影响,而对光合系统的其他组分影响不大?该推论仍需进一步的实验加以验证。
虽然完全郁闭的森林可能不利于四数木幼苗的更新,但由于四数木在光照充足时,在不同水分梯度下的净光合速率均相对其他物种较高,可能具有更高的相对生长速率,而其成年植株一般都能够到达群落最上层并长期存活下去。这暗示四数木在当地植被破坏后的恢复中将有可能发挥重要作用,即在次生裸地上迅速恢复群落的最上层结构,及时形成一定程度的郁闭以阻止草本植物在此时的过度扩张,并提供有利于其他林下树种发挥竞争优势的适宜生境。相对其他先锋树种而言,四数木的较长寿命更有利于提供一个长期相对稳定的林下环境,是对当地整个群落演替过程具有持续贡献的阳性树种。
4 结论
相对于文献报道过的当地演替后期森林中的常见树种,四数木幼苗具有较高的的LSP和Pmax,而光强改变时其光合速率变化呈V型曲线。这些特征有利于四数木幼苗适应持续高强度的光照环境,但在间歇性光斑条件下则有可能受到抑制。考虑四数木成株所具有的较长寿命和较高层次,四数木应是对当地整个群落演替过程具有持续贡献的阳性树种。因此,在当地森林管理活动中,应当特别注意对四数木现有成株的保护,同时可在大型林窗或采伐迹地上适当引种四数木幼苗,发挥其阳性植物特点,更快更好的恢复当地被破坏或被干扰的自然生态系统。
[1]Zhang J H,Cao M.Tropical forest vegetation of Xishuangbanna,SW China and its secondary changes,with special reference to some problems in local nature conservation.Biological Conservation,1995,73(3):229-238.
[2]Zhu H.Ecological and biogeographical studies on the tropical rain forest of south Yunnan,SWChina with a special reference to its relation with rain forests of tropical Asia.Journal of Biogeography,1997,24(5):647-662.
[3]Marsden SJ,Jones M J.The nesting requirements of the parrots and hornbill of Sumba,Indonesia.Biological Conservation,1997,82(3):279-287.
[4]Tang Y,Yang X F,Cao M,Baskin C C,Baskin J M.Buttress trees elevate soil heterogeneity and regulate seedling diversity in a tropical rainforest.Plant and Soil,2011,338(1/2):301-309.
[5]Ma X X,Shuai J G,Xiao W X.Cultivation and preservation of Tetrameles nudiflora.Tropical Botanical Research,1996,(34):1-4.
[6]Zhang K Y.An analysis on the characteristics and forming factors of climates in the south part of Yunnan.Acta Meteorologica Sinica,1963,33(2):218-230.
[7]Liu W J,Zhang K Y,Wang C M,Li H M,Duan W P.The microclimate of dew and fog formation on canopy layer in the dry season in Xishuangbanna tropical rain forest.Acta Ecologica Sinica,2001,21(3):486-491.
[8]Chazdon R L.Sunflecks and their importance to forest understory plants.Advances in Ecological Research,1988,18:1-63.
[9]Chazdon R L,Pearcy R W.The importance of sunflecks for forest understory plants.Bioscience,1991,41(11):760-766.
[10]Jiang G M.Plant Ecophysiology.Beijing:Higher Education Press,2004.
[11]Way D A,Pearcy R W.Sunflecks in trees and forests:from photosynthetic physiology to global change biology.Tree Physiology,2012,32(9):1066-1081.
[12]Chen SB,Song A Q,Li Z J.Research advance in response of forest seedling regeneration to light environmental heterogeneity.Chinese Journal of Applied Ecology,2005,16(2):365-370.
[13]Bassman J H,Zwier JC.Gas exchange characteristics of Populustrichocarpa,Populusdeltoides and Populustrichocarpa×P.deltoides clones.Tree Physiology,1991,8(2):145-159.
[14]Cai Z Q,Chen Y J,Bongers F.Seasonal changes in photosynthesis and growth of Zizyphus attopensis seedlings in three contrasting microhabitats in a tropical seasonal rain forest.Tree Physiology,2007,27(6):827-836.
[15]Naumburg E,Ellsworth D S.Photosynthetic sunfleck utilization potential of understory saplings growing under elevated CO2in FACE.Oecologia,2000,122(2):163-174.
[16]Tausz M,Warren C R,Adams M A.Dynamic light use and protection from excess light in upper canopy and coppice leaves of Nothofagus cunninghamii in an old growth,cool temperate rainforest in Victoria,Australia.New Phytologist,2005,165(1):143-156.
[17]Chen J W,Zhang Q,Li X S,Cao K F.Steady and dynamic photosynthetic responses of seedlings from contrasting successional groups under lowlight growth conditions.Physiologia Plantarum,2010,141(1):84-95.
[18]Yu Y.The response of seed germination and seedling growth of 11 tree species to the light environment and soil moisture in tropical forest,Xishuangbanna[D].Mengla(MI):Xishuangbanna Tropical Botanical Garden,2008
[19]Lambers H,Chapin F SIII,Pons T L.Plant Physiological Ecology.Berlin:Springer,2008.
[20]Xu D Q.The Efficiency of Photosynthesis.Shanghai:Shanghai Scientific and Technological Press,2002.
[21]Cai Z Q,Rijkers T,Bongers F.Photosynthetic acclimation to light changes in tropical monsoon forest woody species differing in adult stature.Tree Physiology,2005,25(8):1023-1031.
[22]Chen Y,Xu D Q.Species dependence of the pattern of plant photosynthetic rate response to light intensity transition from saturating to limiting one.Journal of Plant Physiology and Molecular biology,2007,33(6):538-546.
[23]Chen Y,Xu D Q.Two patterns of leaf photosynthetic response to irradiance transition from saturating to limiting one in some plant species.New Phytologist,2006,169(4):789-798.
[24]Liao Y,Xu D Q.Novel evidence for a reversible dissociation of light-harvesting complex II from photosystem II reaction center complex induced by saturating light Illumination in soybean leaves.Journal of Integrative Plant Biology,2007,49(4):523-530.
参考文献:
[5]马信祥,帅建国,肖文祥.四数木的保存及繁殖栽培技术.热带植物研究,1996,(34):1-4.
[6]张克映.滇南气候的特征及其形成因子的初步分析.气象学报,1963,33(2):218-230.
[7]刘文杰,张克映,王昌命,李红梅,段文平.西双版纳热带雨林干季林冠层雾露形成的小气候特征研究.生态学报,2001,21(3):486-491.
[10]蒋高明.植物生理生态学.北京:高等教育出版社,2004.
[12]陈圣宾,宋爱琴,李振基.森林幼苗更新对光环境异质性的响应研究进展.应用生态学报,2005,16(2):365-370.
[18]于洋.西双版纳热带森林中11个树种的种子萌发和幼苗生长对光环境和土壤水分的响应[D].勐腊:中国科学院西双版纳热带植物园,2008.
[20]许大全.光合作用效率.上海:上海科学技术出版社,2002.
[22]陈悦,许大全.植物光合速率对光强从饱和到有限转变响应方式的物种依赖性.植物生理与分子生物学报,2007,33(6):538-546.
