硝普钠浸种对紫花苜蓿种子萌发及幼苗生长的影响
2013-12-06谷文英
潘 龙,谷文英
(1.中国农业科学院北京畜牧兽医研究所,北京 100193; 2.扬州大学动物科学与技术学院,江苏 扬州 225009)
硝普钠浸种对紫花苜蓿种子萌发及幼苗生长的影响
潘 龙1,2,谷文英2
(1.中国农业科学院北京畜牧兽医研究所,北京 100193; 2.扬州大学动物科学与技术学院,江苏 扬州 225009)
通过不同浓度的外源一氧化氮(NO)供体硝普钠(Sodium Nitropprusside,SNP)对紫花苜蓿(Medicagosativa)种子进行处理,研究其对紫花苜蓿种子萌发、幼苗胚根与胚轴生长、MDA含量及POD活性的影响。结果表明,与不处理对照组相比,低浓度SNP(50~100 μmol·L-1)组的紫花苜蓿种子发芽率最高,为对照组的121%。幼苗胚根与胚轴的长分别是对照组的139%和145%,均显著高于对照组(Plt;0.05);幼苗POD酶的活性也显著提高,MDA的含量仅为对照组的35%,显著低于对照组(Plt;0.05)。但较高浓度的SNP(gt;100 μmol·L-1)浸种,其发芽率降低,与对照组差异不显著(Pgt;0.05)。胚根与胚轴增长趋势也变缓;幼苗POD酶活性增长速度也明显降低,MDA含量有所增加,但仍低于对照组。SNP浸种能促进紫花苜蓿种子的萌发和幼苗的生长,提高幼苗POD酶的活性,降低MDA的含量,其适宜浓度为50~100 μmol·L-1。
一氧化氮;种子萌发;幼苗生长
紫花苜蓿(Medicagosativa)属于豆科多年生优质牧草,是常见牧草中营养价值最高的一种,蛋白含量高达20%左右,被誉为“牧草之王”[1-2],但紫花苜蓿种子的萌发常受到气候、土壤等因素的影响,许多种子不能有效利用,主要表现为种子发芽率不高,幼苗抗逆性不强,一定程度上制约着紫花苜蓿种植的推广,影响苜蓿草产量。
一氧化氮(NO)是分布于生物体内一种特殊的气体类生物活性分子,植物体可以产生内源性的NO[3]。NO在细胞内不稳定,具有自由基性质,常以一氧化氮自由基(NO·)、亚硝酰阳离子(NO+)和亚硝酰阴离子(NO-)3种生物学效应形式存在[4]。Corpas等[5]研究发现,内源性的NO在植物体内可以作为植物抗病反应的信号分子,参与植物生长发育的各个生理过程,如种子萌发、幼苗生长、细胞凋亡、防御基因的表达以及耐逆反应等;且NO有脂溶性,很容易穿透生物膜,利于影响与产生NO细胞相邻近的细胞[6]。但NO具有毒害和保护细胞的双重生理效应[7],这与植物细胞的生理条件状况和NO有效浓度有关[8]。
目前,关于提高紫花苜蓿的抗逆性研究已经受到重视,得到一些研究结果。如,沙引发处理能提高紫花苜蓿种子活力和抗盐胁迫能力[9];NO能缓解干旱胁迫造成的氧化损伤,提高苜蓿叶片叶绿素含量和光合作用能力,增强苜蓿的抗旱性[10]。关于外源NO对经济作物种子萌发影响的研究更受到广泛关注,如张少颖等[11]研究发现,硝普钠(SNP)浸种可以提高玉米(Zeamays)种子的发芽率,促进幼苗地上部和根的伸长生长,且利于玉米侧根的发芽,幼苗叶片中硝酸还原酶活性也得到提高;刘开力等[12]研究表明,SNP浸种可以提高盐胁迫下水稻(Oryzasativa)的耐盐比率,对盐胁迫下的幼苗生长有一定的缓解作用;张黛静等[13]试验证明,NO能够直接调节小麦(Triticumaestivum)生长、发育、衰老等生理作用,而且可以参与小麦对环境胁迫的应答;段培等[14]研究发现,SNP浸种预处理对盐胁迫下的小麦叶片氧化损伤有明显的缓解作用,同时能显著诱导盐胁迫下小麦叶片SOD、CAT、APX酶的活性,从而减轻盐胁迫下小麦叶片的氧化损伤;肖强和郑海雷[15]试验发现,较低盐度海水可以作为植物生长的营养液,促进小白菜(Brassicachinensis)种子萌发,外加0.01 mmol·L-1SNP能够提高小白菜种子的发芽率、发芽指数。
但关于外源NO对紫花苜蓿生长影响的研究报道较少,本试验探究外源NO对紫花苜蓿种子萌发及幼苗生长的影响,以期提高紫花苜蓿种子萌发率和幼苗的成活率,高效生产优质的苜蓿草。
1 材料与方法
1.1材料与仪器 供试紫花苜蓿种子来源于扬州大学农牧场,肾形,黄褐色,千粒重2.0 g,发芽率≥80%;外源NO供体采用SNP(分析纯),500 μmol·L-1的SNP约能产生2.0 μmol·L-1的NO[16];人工环境控制培养箱,超净台,高压灭菌锅等。
1.2种子处理 将SNP浓度设为7个水平,分别为0、10、25、50、100、250、500 μmol·L-1,其中0为对照组,以蒸馏水代替SNP溶液。不同浓度设置3个重复。
挑选饱满程度和大小接近的种子,用砂纸轻轻摩擦种皮,再将擦破皮的种子包裹在沙布中,用去离子水反复冲洗,然后用滤纸吸干水分[17];将种子均匀摆放在铺有3层滤纸的培养皿中,向每个培养皿中加入8 mL的各浓度SNP处理液[18],置于室内人工培养箱中,温度为24 ℃,湿度为70% ,每天12 h光照条件下进行种子萌发试验。
1.3种子观察与记录 以胚根突破种皮1 mm视为发芽[9],每天在规定的时间记录种子发芽情况,3 d后统计发芽势,7 d后统计发芽率,计算发芽指数(GI)和活力指数(VI);种子萌发第8天至第9天分别测定幼苗胚轴、胚根长度及鲜质量。
GI=∑(Gt/Dt);VI=GI×S.
式中,Gt为在t日的发芽数,Dt为发芽天数,S为胚轴长度。
1.4生理生化指标测定 种子萌发第8天至第9天分别测量幼苗胚根、胚轴MDA含量、POD的相对活性。MDA含量使用硫代巴比妥酸反应法测定,POD 活性测定采用愈创木酚法,以每分钟内OD470变化0.01为1 个酶活力单位,计算酶活性[19-23]。
1.5数据处理 所测的数据用Excel处理后,采用SPSS软件进行数据显著性分析。
2 结果与分析
2.1SNP对紫花苜蓿种子萌发的影响 SNP浓度在0~100 μmol·L-1范围内,种子发芽率由81%增加到98%,发芽率为对照组的121%,差异显著(Plt;0.05),但当SNP浓度继续增高时,发芽率转而开始降低,当SNP浓度为500 μmol·L-1时,发芽率降到80%,与对照组差异不显著(Pgt;0.05);当SNP浓度为100 μmol·L-1时发芽势及发芽指数达到最大,分别为对照的156%、148%,与对照组相比差异显著,当SNP浓度继续增大时,发芽势及发芽指数也开始降低,当SNP浓度达到500 μmol·L-1时,发芽势及发芽指数分别降到65.56%、26.40,但仍高于对照组,分别为对照组的118%、110%;苜蓿种子活力指数在SNP浓度为50 μmol·L-1时达到最大,为对照组的202%,差异显著,但当SNP浓度继续增大时,活力指数开始降低,当SNP浓度为500 μmol·L-1时,活力指数降到49.28,与对照差异不显著(表1)。因此,当SNP浓度在50~100 μmol·L-1时,种子的发芽情况最优。
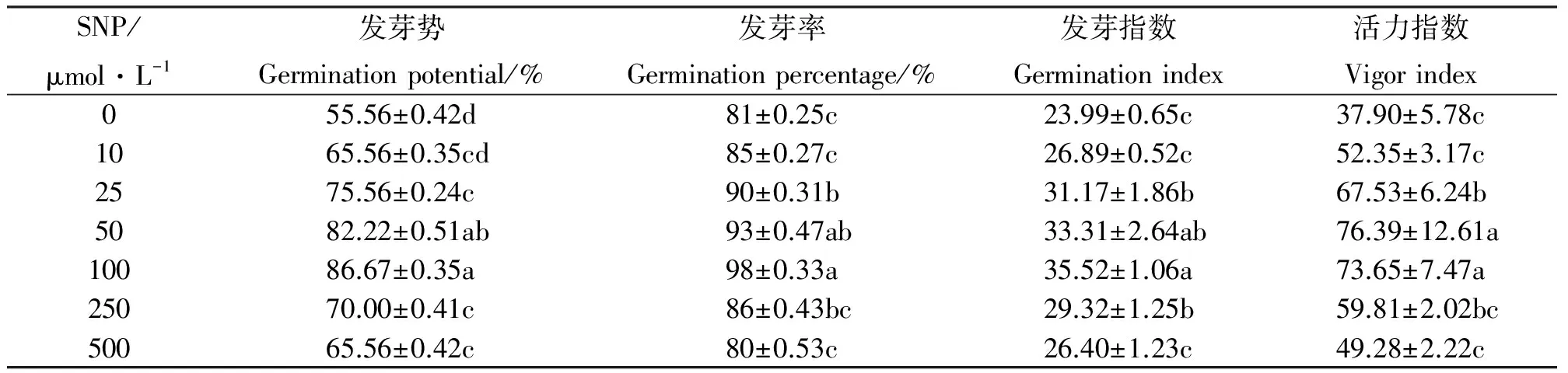
表1 SNP对紫花苜蓿种子萌发的影响Table 1 Effects of SNP on germination of alfalfa seed
注:同列不同字母表示在0.05水平上的差异显著(LSD法)。下表同。
Note:Different letters in the same column mean significant difference among the treatments at 0.05 level. The same below.
2.2SNP对紫花苜蓿幼苗生长的影响 紫花苜蓿幼苗的胚根、胚轴长及鲜质量随SNP浓度的增加呈现先增加后降低的趋势,当SNP浓度为50 μmol·L-1时幼苗的胚根、胚轴长及鲜质量达到最大,分别为对照组的139%、145%、143%,显著高于对照组(Plt;0.05)。当SNP浓度继续增加时,幼苗的胚根、胚轴长及鲜质量有所下降但仍高于对照组,当SNP浓度达到500 μmol·L-1,胚根、胚轴长均为对照组的118%,与对照组相比差异显著(表2)。由此说明,低浓度SNP(50~100 μmol·L-1)对苜蓿幼苗胚根、胚轴及鲜质量的增长有促进作用,而较高浓度SNP(gt;100 μmol·L-1)的作用不明显。
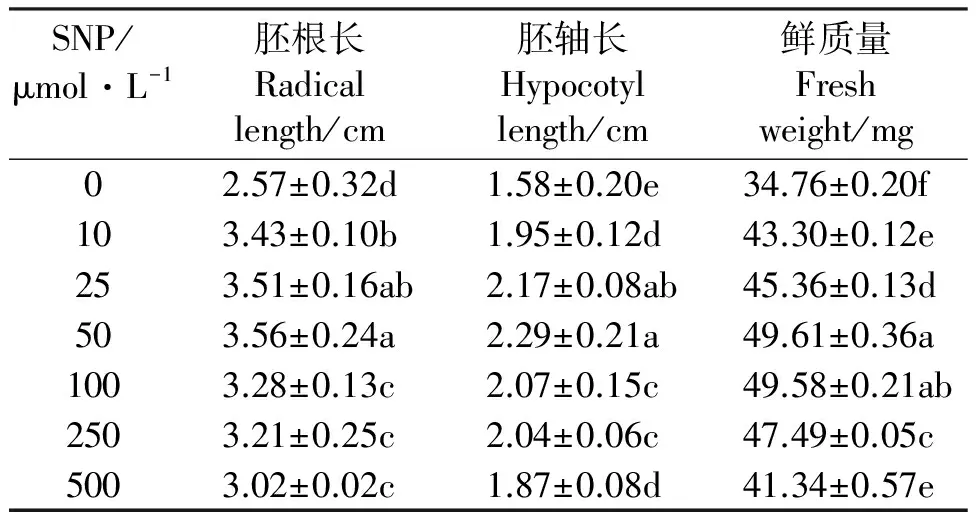
表2 SNP对紫花苜蓿胚根和胚轴生长的影响Table 2 Effects of SNP on growth of radical and hypocotyls of alfalfa seedling
2.3SNP对紫花苜蓿幼苗丙MDA含量的影响 MDA含量随SNP浓度增加呈先降低后升高的趋势,当SNP浓度为100 μmol·L-1时,MDA的含量最低,为对照组的35%,差异极显著(Plt;0.01)(图1)。但随着SNP浓度的继续增加,MDA的含量又有增加的趋势,当SNP浓度为500μmol·L-1时MDA的含量增加到22.55×10-3μmol·L-1,但仍低于对照组,为对照组的71%(Plt;0.05)。因此,适当的SNP浓度(50~100 μmol·L-1)可以降低苜蓿幼苗的膜脂过氧化水平,高浓度(gt;100 μmol·L-1)可能造成膜的伤害。
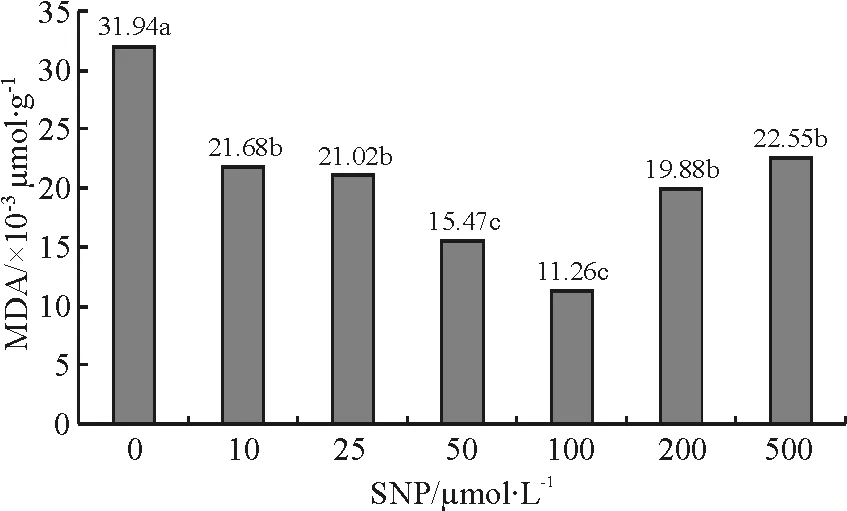
图1SNP对紫花苜蓿幼苗MDA含量的影响
Fig.1EffectsofSNPonMDAcontentofalfalfaseedling
注:不同字母表示不同浓度间差异显著(Plt;0.05)。下图同。
Note:Different lower case letters mean significant difference among treatments at 0.05 level.The same below.
2.4SNP对紫花苜蓿幼苗POD活性的影响 POD活性随SNP浓度的增加而增加,当SNP浓度为100 μmol·L-1时,POD活性为对照组的165%,差异极显著(Plt;0.01),但当SNP浓度继续增大时POD活性增加速度变缓,当达到500 μmol·L-1时,POD活性为330.8 U·min-1·g-1,与100 μmol·L-1的POD活性差异不显著(Pgt;0.05)(图2)。
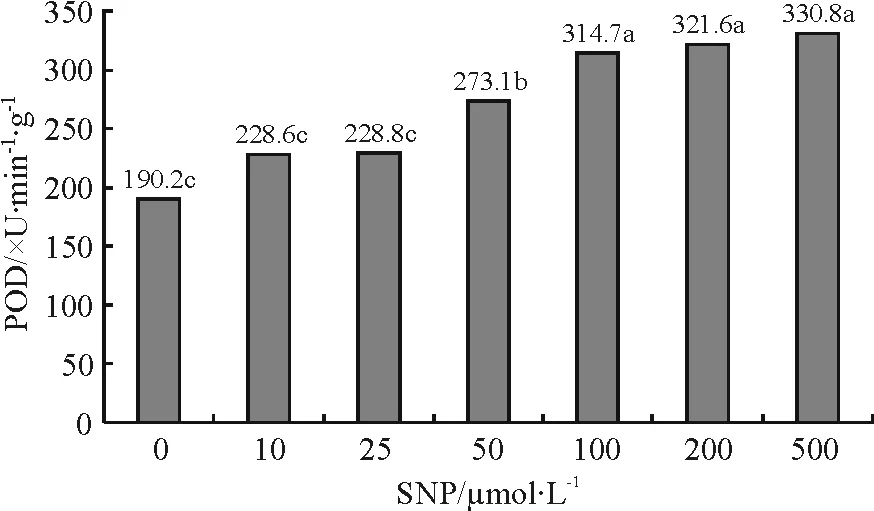
图2 SNP对紫花苜蓿幼苗POD活性的影响Fig.2 Effects of SNP on POD activity of alfalfa
3 讨论与结论
本研究表明,适当的SNP浓度(50~100 μmol·L-1)能显著改善紫花苜蓿种子的萌发和幼苗的生长,提高幼苗POD酶的活性,降低MDA的含量;但是较高的SNP浓度(gt;100 μmol·L-1)却有相反的趋势。该结论与陈世军等[24-25]在辣椒(Capsicumannuum)种子上的研究基本一致,低浓度的SNP(75或100 μmol·L-1)能显著提高辣椒种子的萌发率和抗逆性,但较高浓度的SNP处理,作用相反。与汪妮[26]研究SNP对谷子(Pennisetumglaucum)幼苗的抗氧化酶活性及MDA含量的影响也相一致,即随着SNP浓度的增加,谷子种子萌发幼苗的POD酶活性变化呈现出先升后降的趋势;幼苗的MDA含量则先降低后升高。
植物体内都会产生活性氧(Reactive Oxygen Species,ROS),正常情况下自由基处于动态平衡中,但受到胁迫时自由基就会升高,引起生理生化反应。ROS能与体内DNA、蛋白质、脂类等生物大分子反应,使DNA、蛋白质变性及脂质过氧化,降低酶活性、增大膜透性[27]和致基因突变[28],抑制植物生长。MDA是自由基导致膜质过氧化的最终分解产物,其含量可以反映膜损伤的程度[29-30]。 MDA积累过多,预示自由基处于高水平,反映植物遭受逆境程度较高[31]。本研究中,低浓度的SNP(0~100 μmol·L-1)能显著降低紫花苜蓿幼苗MDA的含量,而高浓度SNP(gt;100 μmol·L-1)则有增加趋势,与汪妮[26]对谷子种子萌发后幼苗的MDA含量在0~100 μmol·L-1范围内与SNP浓度呈显著负相关,在100~500 μmol·L-1范围内呈显著正相关,其中100 μmol·L-1时MDA含量最低,为对照的79.3%的研究结论基本一致。
POD则是植物体对细胞膜保护的一种抗氧化酶,能有效清除体内多余ROS,其活性的高低反映植物清除ROS的能力。POD活性随SNP浓度的增加而增加,虽然当SNP浓度gt;100 μmol·L-1时,POD增长速度变慢,但是当SNP浓度为 500 μmol·L-1时,POD活性最大,为对照组的173.9%,这表明SNP浸种能诱导POD活性,致使ROS减少,避免核酸、蛋白质变性和脂质过氧化,从而促进种子萌发。陈世军和张明生[25]研究证明,NO可以通过顺乌头酸、cGMP途径以及与H2O2、水杨酸等信号分子或与抗氧化酶类相互作用调节细胞内ROS的代谢。
本研究中,NO对苜蓿种子萌发的影响总体上与前人“低促高抑”的研究结果[32]基本一致,但关于其影响机制报道不一,Guerin等[33]认为NO可以提高α-淀粉酶活性、加速胚乳淀粉的降解;张华等[34]认为NO可以提高种子的通透性,利于水分的渗入;Leshem和Hamaraty[35]则认为NO可以直接作用于细胞壁组成,使细胞壁松弛,以及NO作用于磷脂膜的脂质双分子层,增强膜的流动性。NO缓解膜脂过氧化、提高保护酶系统,可能是由于NO对含铁相关酶类有很高的亲和性,调节过氧化氢酶、抗坏血酸过氧化物酶和细胞色素C氧化酶等酶类活性参与植物生理反应。
NO对植物的生长具有如此奇妙的作用,但由于植物体在一定的环境条件下可以产生内源性NO,同时NO也与植物体内的激素有着密切的复杂联系[36-37],所以NO对植物体的生理调节功能和信号传导机制有待进一步研究。只有揭示NO对植物体的调节机制,才能深入研究外源NO对植物的生理效应。
[1] 何云,霍文颖,张海棠,等.紫花苜蓿的营养价值及其影响因素[J].安徽农业科学,2007(7):3243-3244.
[2] 张春梅,王成章,胡喜峰,等.紫花苜蓿的营养价值及应用研究进展[J].中国饲料,2005(1):15-17.
[3] 葛超,找成昊,王孝杰,等.一氧化氮促种子萌发的研究进展[J].种子,2010(11):55-58.
[4] Neill S J,Desikan R, Hancock J T.Nitric oxide signaling in plant[J].New Phytologist,2003,159(1):11-35.
[5] Corpas F J,Barroso J B,Carreras A,etal.Constitutive arginine-dependent nitric oxide syntheses activity in different organs of pea seedlings during plant development[J].Plant,2006,224(2):246-254.
[6] 秦毓茜,李延红.一氧化氮在植物中的生理作用[J].安徽农业科学,2006,3(9):1802-1804.
[7] 吴春太.一氧化氮与植物激素的相互作用及其关系[J].基因组学与应用生物学,2010,29:1169-1176.
[8] 赵晓刚,徐张红,何奕昆,等.NO在植物中的调控作用[J].植物学通报,2004,21(1):44-51.
[9] 解秀娟,胡晋.沙引发对紫花苜蓿种子盐逆境下发芽及幼苗生理生化变化的影响[J].种子,2003(4):5-6.
[10] 姜义宝,杨玉荣,郑秋红.外源一氧化氮对干旱胁迫下苜蓿幼苗抗氧化酶活性和叶绿素荧光特性的影响[J].干旱地区农业研究,2008,26(13):65-68.
[11] 张少颖,任小林,程顺昌,等.外源一氧化氮供体浸种对玉米种子萌发和幼苗生长的影响[J].植物生理学通讯,2004,40(13):309-310.
[12] 刘开力,凌腾芳,刘志兵,等.外源NO供体SNP浸种对盐胁迫下水稻幼苗生长的影响[J].植物生理学通讯,2004,40(4):419-422.
[13] 张黛静,姜丽娜,邵云,等.NO在小麦生长发育与环境胁迫响应中的作用研究进展[J].麦类作物学报,2009,29(2):356-360.
[14] 段培,王芳,王宝山.NO供体SNP浸种显著缓解盐胁迫对小麦幼苗的氧化损伤[J].菏泽学院学报,2006,28(15):93-97.
[15] 肖强,郑海雷.外源NO对盐胁迫下小白菜种子萌发的影响[J].湖北民族学院学报(自然科学版),2008,26(3):266-268.
[16] Delledonne M,Xia Y j,Dixon R A,etal.Nitric oxide functions as a signal in plant disease resistance[J].Nature,1998,394:585-588.
[17] 陈世军,韦美玉.外源NO供体SNP对辣椒种子萌发的影响[J].湖北农业科学,2009,48(2):356-359.
[18] 陈世军,张明生,韦美玉.Cd2+对辣椒种子萌发的影响[J].种子,2009(6):23-25.
[19] 张志良,瞿伟靑,刘小方.植物生理实验指导[M].第四版.北京:高等教育出版社,2008.
[20] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2004:173.
[21] 王学奎.植物生理生化实验原理和技术[M].第二版.北京:高等教育出版社,2006.
[22] 刘萍,李明军.植物生理学实验技术[M].北京:高等教育出版社,2007.
[23] 张以顺,黄霞,陈云凤.植物生理学实验教程[M].北京:高等教育出版社,2009.
[24] 陈世军.外源NO供体SNP对Cd2+胁迫下辣椒种子萌发和幼苗生长的影响[D].贵阳:贵州大学,2009.
[25] 陈世军,张明生.外源NO供体SNP对Cd胁迫下辣椒种子萌发的影响[J].种子,2009(2):21-25.
[26] 汪妮.一氧化氮供体硝普钠对谷子幼苗抗氧化酶活性及膜脂过氧化物的影响[J].种子,2011(7):52-55.
[27] 马海燕,任小林,周会玲.一氧化氮处理砀生酥梨的保鲜效果[J].河南农业科学,2007(5):98-101.
[28] 陈世军,张明生.植物一氧化氮及对活性氧代谢的影响[J].安徽农业科学,2008,36(17):7116-7118.
[29] 赵世杰,许长成.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.
[30] 李纪元,饶龙斌,潘德寿,等.人工淹水胁迫下枫杨种源MDA含量的地理变异[J].浙江林业科技,1999,19(4):22-27.
[31] 黄玉山,罗广华,关粲文.镉诱导植物的自由基过氧化损伤[J].植物学报,1997,39(6):522-526.
[32] 陈世军,韦美玉.外源NO对辣椒幼苗生长及生理特性的影响[J].河南农业科学,2009(4):98-101.
[33] Guerin J R,Lance R C M,Wallace W.Release and activation of barley beta-amylase by malt endopeptidases[J].Journal of Cereal Science,1992,15:5-14.
[34] 张华,孙永刚,张帆,等.外源一氧化氮供体对渗透胁迫下小麦种子萌发和水解酶活性的影响[J].植物生理与分子生物学学报,2005,31(3):241-246.
[35] Leshem Y Y,Hamaraty E.Plant aging:the emission of NO and ethylene and effect of NO-releasing compounds on growth of pea (Pisumsativum) foliage[J].Journal of Plant Physical,1996,148:258-263.
[36] Zhang Y Y,Liu Y L.Source and function of Nitric Oxide in plants[J].Acta Botanica Boreali-Occidentalia Sinica,2004,24(5):921-929.
[37] 秦旈茜,李延红.一氧化氮在植物中的生理作用[J].安徽农业科学,2006,31(9):1802-1804.
EffectsofsoakingseedsinSNPonseedgerminationandseedlinggrowthofalfalfa
PAN Long1,2, GU Wen-ying2
(1.Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2.Animal Science amp; Technology, Yanzhou Unversity, Yanzhou 225009, China)
Effects of soaking seeds in sodium nitropprusside (SNP) on seed germination and seedling growth of alfalfa were studied. The results showed that, 1) seed germination rate and growth of radical and hypocotyls of soaking in 50-100 μmol·L-1SNP treatments were significantly higher than those in control, and they were up to 1.21,1.39 and 1.45 times as control, respectively; 2) The activity of POD in seedling was enhanced significantly, and MDA content in seedling was decreased to 35%, and significantly lower than those in the control group. For the seeds soaking in SNP with high concentration (gt;100 μmol·L-1), the germination rate began to drop and had no significantly different with control. At the same time, the trend of growth of radical and hypocotyls was slowing down. MDA content was increasing, but still lower than that in control, while the activity of POD was reducing significantly. In conclusion, alfalfa seed soaking in SNP can promote alfalfa seed germination and seedling growth, improve seedling POD activity and reduce content of MDA. The appropriate concentration is 50-100 μmol·L-1.
carbon monoxide; seed germination; seedling growth
GU Wen-ying E-mail:yligu@yahoo.com.cn
2012-04-21接受日期:2012-09-05
江苏高校优势学科建设工程资助项目(SJ2011092506);现代农业产业技术体系建设专项牧草产业体系资金(Z09090501040902)
潘龙(1988-),男,江苏邳州人,在读硕士生,研究方向为反刍动物营养与饲料科学。E-mail:panlong8809@163.com
谷文英(1969-),女,河南卫辉人,讲师,在读博士生,主要从事牧草栽培与组织培养方面的教学与研究。E-mail:yligu@yahoo.com.cn
S816;S541+.104;Q945.3
A
1001-0629(2013)01-0058-05
