3种拟青霉生物学特性的分析研究
2013-12-03张玉波杨伟伟
张玉波,凌 琪,陶 勇,杨伟伟
(1.安徽建筑工业学院教务处,合肥230601;2.安徽建筑工业学院环境与能源工程学院,合肥230601)
任何生物体的生长都遵循一定的规律,都要受外界环境条件影响。研究明确适宜的温度、pH值和光周期等生物学特性,才能成功地应用它们。环链拟青霉是拟青霉属(Paecilocyes Bainier)的一个种,粉拟青霉是自然界中控制昆虫种群的重要因子之一,玫烟色拟青霉昆虫寄主多样,是一种重要的昆虫病原真菌。近年来,随着害虫对单一菌种的免疫力增强,混菌防治害虫显得越来越重要,为此了解它们生物学特性方面的差异对开发和利用混菌防治资源具有重要意义[1-8]。
1 材料和方法
1.1 菌种及其来源
将3种采集到的标本在选择性培养基上多次分离纯化,通过镜检其产孢结构来鉴定真菌的属种[9]。得知3种真菌分别为拟青霉属的环链拟青霉、粉拟青霉和玫烟色拟青霉,具体3种供试拟青霉菌株拉丁文、寄主名称和地理来源见表1。

表1 3种供试菌株的拉丁文、寄主名称及地理来源Table 1 Latin,the name of the host and geographic origins of three tested isolates
1.2 培养基
PDA培养基 马铃薯200 g;葡萄糖20 g;琼脂20 g;蒸馏水1000 mL。
1.3 方法
1.3.1 生长曲线测定
液体种子制备 将PDA液体培养基分装到250 mL摇瓶内,每个摇瓶装100 mL,120℃高压蒸汽灭菌20 min,在无菌接种台上将3种拟青霉从水液保存管中接种到摇瓶内,放置于25℃、140 r/min的摇床上培养60 h。
生物量测定 将液体种子在无菌条件下用高速分散器打匀,微量取样器取2 mL接种到装有18 mL PDA培养基的50 mL摇瓶中,放置于25℃、140 r/min的摇床上培养。每个菌种设有3个重复。每天用抽滤瓶对20 mL的发酵液进行抽滤,用蒸馏水反复冲洗3次摇瓶后,收集菌丝体置于55℃电热鼓风干燥箱中烘干至恒重后,电子天平准确称重,得菌丝干重(生物量)[10]。
1.3.2 菌落生长量和产孢量测定
将铺有玻璃纸的PDA平板培养基培养7 d的菌落,用直径为0.3 mm的打孔器在距培养皿中心相同位置打孔,无菌条件下接种到PDA培养基上,倒置于25℃的光照培养箱中培养。每个菌种设有3个重复。每天用游标卡尺从菌落的两个垂直方向进行精确测量。
在测上述拟青霉生长量的同时,菌落生长到第10 d和第14 d时,用直径为0.3 mm的打孔器在距菌落中心相同位置截取菌块3个,放入20 mL 1‰的吐温80溶液中,用高速分散器将菌块充分打散配成孢子悬浮液。在显微镜下用血球计数板测定孢子的数目。
1.3.3 生长适温测定
将铺有玻璃纸的PDA平板培养基培养7 d的菌落,用打孔器在距培养皿中心相同位置打孔,在无菌条件下接种到PDA培养基上,分别放置于15℃、20℃、25℃、30℃的光照培养箱中倒置培养。每个温度处理均设有3个重复。每24 h用游标卡尺从菌落两个垂直方向进行精确测量。当菌落生长到第10 d、14 d时,用打孔器取菌块,放入20 mL 1‰的吐温80溶液中,用高速分散器将菌块充分打散配成孢子悬浮液。在显微镜下用血球计数板测定孢子的数目[11]。
1.3.4 最佳pH值的测定
用500 mL三角瓶配制PDA培养基,在灭菌之前用缓冲液将PDA培养基的pH值分别调到4、5、6、7、8、9、10,用直径为0.3 mm的打孔器在铺有玻璃纸的PDA平板培养基培养7 d的菌落上距培养皿中心相同位置打孔,在无菌条件下分别接种到不同pH值的PDA培养基上,放于25℃光照培养箱中倒置培养。每pH值中设有3个重复。每24 h用游标卡尺测量直径。当菌落生长到第10 d、14 d时,测定孢子数目。
2 结果与分析
2.1 最佳生长曲线
由图1可看出,3种拟青霉的生长曲线变化较明显,即pc312、pfu53和pf273的最佳生长时间分别是6 d、7 d 和5 d。
2.2 最大菌落生长量和产孢量

图1 3种拟青霉生长曲线Fig 1 Growth curve of the 3 different Paecilomyces spp

表2 3种拟青霉的菌落生长量和产孢量Table 2 Growth speed and conidiation of the 3 different Paecilomyces spp.
由表2可看出,3种拟青霉生长差异较显著,其菌落生长量的次序为pfu53>pc312>pf273;其产孢速率的次序为pfu53>pf273>pc312。
2.3 最佳生长适温

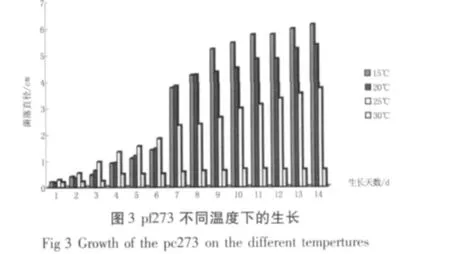


图5 3种拟青霉的产孢情况Fig 5 Condition of the 3 different Paecilomyces spp.
由图2、3和4可明显得出,pc312在4个温度梯度中除30℃外,其余3个温度均可以生长。且最适温度为25℃;pf273对30℃的高温适应很差,在其他3个温度中都可以生长,且最适温度为15℃;pfu53在30℃不能生长,在其余3个温度梯度中均可以良好生长,且在15℃生长最佳。同时通过图5也表明了产孢数量基本上和菌落直径生长速度相一致的规律。
2.4 最佳生长pH值
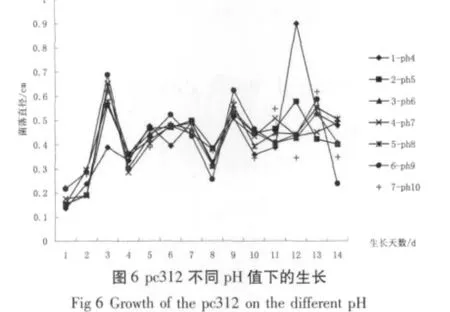

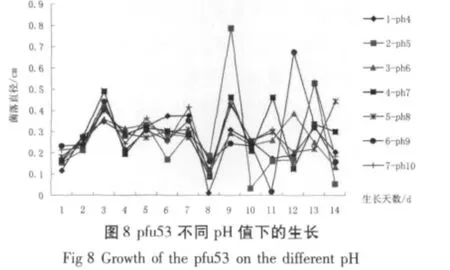

图9 3种拟青霉不同pH值下的产孢情况Fig 9 Conidiation of the three Paecilomyces spp.on the different pH
由图6、7和8可以看出,pc312在pH值4~10中均有生长趋势。其中在pH值为9的培养基上有明显的生长优势;采用各个折点所对应的菌落直径数值进行加权求平均的方法可以得出,pf273在pH值为7时生长最好。pfu53在最佳pH值为6时生长最佳。图9的变化趋势表明,3种拟青霉在第14 d的孢子数目和菌落的生长量呈同一规律:即pc312、pf273、pfu53所生长的最佳生长pH值分别为9、7、6。
3 讨论与分析
3.1 本研究为了准确描述菌落的性状,采用了菌落生长量和产孢量两个标准来衡量该属菌种的生物学特性[12]。从而为林业上的生物防治和工业上的大量发酵生产提供有效的理论依据。
3.2 在研究转接平皿的过程中,必须保证所转接的种子没有产孢或者产孢很少,以免在接种后,出现散孢的现象[13]。从而影响菌落直径的测量,导致实验数据不准确。在不同温度处理时,出现了菌落直径和所取菌块的孢子数目不符合的现象,通过比较分析发现是由于实验中测定孢子数目时的误差造成的。
3.3 通过对3种拟青霉的生物学特性分析,虽然它们同属于一个属,但它们之间的生物学差异较显著。至于对出现这种差异的解释,需要我们进一步用实验去探讨。以期为混菌防治提供理论依据,打破害虫对单一菌种的免疫力[14]。
3.4 在雨天多、湿度大、中低温度下有利于松毛虫卵的孵化及初孵幼虫的生长发育,极易引起马尾松毛虫的大发生。通过分析,3种拟青霉均适宜中、低温生活的菌株[15]。可以根据这一特点及马尾松毛虫生长发育的特性,在初春春雨或秋末秋雨来临之际进行林间喷洒拟青霉孢子粉,可能对马尾松毛虫等鳞翅目害虫有较好的防治效果[16]。同时利用3种拟青霉生物学特性的差异可在年周期中的不同时段进行林间交替施放,以期达到林间持续控制害虫的防治效果。
[1]蔡保灵.飞虱虫疫霉的培养贮存和生测实验[J].生物防治通报,1987,3(4):169-171.
[2]梁宗琦.拟青霉属的两个新种[J].微生物学报,1981,21(1):31-34.
[3]汪章勋.粉拟青霉不同菌株生物学特性的研究[J].安徽农业大学学报,2005,32(1):8-11.
[4]李 忠.玫烟色拟青霉的培养及固体培养基筛选[J].贵州农业科学,2002,30(6):27-28.
[5]宋玉双.浅谈中国松材成虫病的综合治理[J].森林病虫通讯,1992,3:26-28.
[6]Sampedro I.Organic matter transformation and detoxification in dry olive mill residue by the saprophytic fungus Paecilomyces farinosus[J].Process Biochemistry,2009,44(1):216-225.
[7]Mehmet K E,Gökce A.Effects of selected pesticides used against glasshouse tomato pests on colony growth and conidial germination of Paecilomyces fumosoroseus[J].Biological Control,2004,31(3):398-404.
[8]Castellanos-Mogue J.Pruebas de virulencia y determinaci n de actividad extracelular de proteasas tipo subtilisina(Pr1)y tipo tripsina(Pr2)durante la producción de propágulos de aislados de Paecilomyces fumosoroseus de mosquita blanca(Homoptera:Aleyrodidae)[J].Revista Iberoamericana de Micología,2007,24(1):62-68.
[9]王 滨,樊美珍,李增智.球孢白僵菌选择性培养基的筛选[J].安徽农业大学学报.2002,27(1):23-28.
[10]Kobayashi F.Ann Rev Entomol.,1984,29:120.
[11]Kaya S.Water,temperture on survival of Beauveria bassiana conidia:effect on Spodoptera exigua pupal mortality in twosoil type[J].J.Intertebr.Pathol.56:322-323.
[12]张兴立.关于害虫的微生物防治[J].微生物通报.2004,2(4):49-51.
[13]关 雄.中国虫生真菌研究与应用(第五卷)[A].北京:中国农业科技出版社,2004,3:171-172.
[14]包建中.中国生物防治[A].山西:山西科学技术出版社,1998,32.
[15]Sanson R A.Paecilomyces and some allied Hyphomycetes[J].Stud Mycol,1974,6:1-82.
[16]Nakata.Study on the Japanese pine sawyer beetle as the vector of pine wilt disease[J].Tokoyo Press,1997,6(2):478-479.
